吉林省长春市希望高中2020-2021学年高一下学期期末考试化学试题 PDF版含答案
文档属性
| 名称 | 吉林省长春市希望高中2020-2021学年高一下学期期末考试化学试题 PDF版含答案 |

|
|
| 格式 | |||
| 文件大小 | 560.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-22 00:00:00 | ||
图片预览



文档简介
2020—2021 学年度下学期期末质量测试
高一化学
本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,满分100分,考试时间为90
分钟。
注意事项:
1.答题前,考生必须将自己的姓名、准考证号填写清楚,并将准考证号准确的填涂在答题卡上。
2.选择题必须用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字迹工整、笔迹
清楚。
3.请按照题号顺序在各题目的区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无
效。
4.保持卡面清洁,不要折叠、不要弄破、不准使用涂改液、刮纸刀。
可能用到的相对原子质量:H-1 Cu-64 Zn-65 Ag-108
第 I 卷(选择题,共40分)
一、选择题(本大题包括20小题,每小题2分,共40分,每小题给出的四个选项中,只.有.一.项.是
符合题目要求的,请将正确选项填涂在答题卡上)
1.下列物质中,不属于合成材料的是( )
A.塑料 B.天然橡胶 C.合成纤维 D.合成橡胶
2.下列自然资源的开发利用过程只涉及物理变化的是( )
A.高炉炼铁 B.海水晒盐 C.水的电解 D.粮食酿酒
3.中国的中医中药博大精深。中医用药讲究十八反和十八畏,其中有“硫黄原是火中精,朴硝一见
便相争”,硫黄即硫单质。下列说法中正确的是
A.硫是一种淡黄色的能溶于水的固体
B.试管内壁上的硫黄可用二硫化碳清洗
C.过量的硫与铁反应生成Fe2S3,表现了硫单质的氧化性
D.硫在空气中燃烧生成二氧化硫,硫在过量氧气中燃烧生成三氧化硫
4.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则
成铜。熬胆矾铁釜,久之亦化为铜。”下列有关叙述错误的是( )
A.胆矾的化学式为CuSO4
B.胆矾可作为湿法冶铜的原料
C.“熬之则成胆矾”是浓缩结晶过程
D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应
5.下列有关化学用语表示正确的是( )
A.乙酸的结构简式:C2H4O2
1
- -
B.离子结构示意图 可以表示32S2 ,又可以表示34S2
C.空间充填模型 可以表示甲烷分子,也可以表示四氯化碳分子
D.NH3的电子式:
6.下列说法不正确的是
A.厨余垃圾中蕴藏着丰富的生物质能
B.天然气的主要成分甲烷是高效、较洁净的燃料
C.石油的分馏、煤的气化和液化都是物理变化
D.石油的裂化主要是为了得到更多的轻质油
7.由氯乙烯(CH2=CHCl)制得的聚氯乙烯( )可用来制造多种包装材料,下列
有关说法错误的是( )
A.聚氯乙烯属于高分子
B.氯乙烯可由乙烯与氯化氢加成制得
C.由氯乙烯制得聚氯乙烯符合“原子经济性”
D.大量使用聚氯乙烯塑料会造成白色污染
8.下列说法不.正.确.的是
A.葡萄糖能发生银镜反应
B.糖类、油脂、蛋白质都是高分子化合物
C.鸡蛋清溶液中加入硫酸铜溶液会发生变性
D.维生素C能用作食品中的抗氧化剂
9.某化学反应中,反应物B的物质的量浓度在20s内,从2.0mol/L变成了1.0mol/L,则这20s
内B的反应速率为( )
A.0.05mol/(L·s) B.0.05mol/L·s C.0.5mol/(L·s) D.0.05mol/L
10.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g
石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2。下列说法错误的是( )
A.Q1B.石墨不如金刚石稳定
C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低
D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多
2
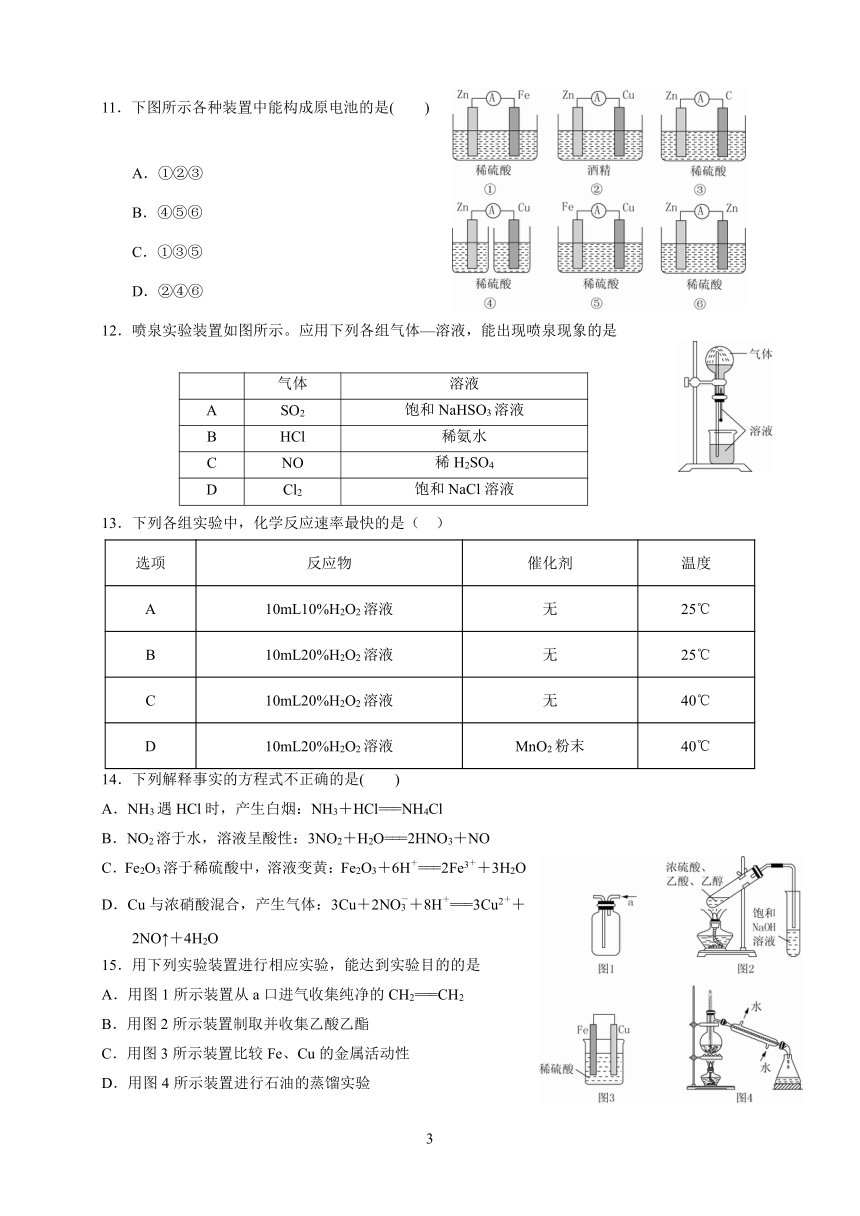
11.下图所示各种装置中能构成原电池的是( )
A.①②③
B.④⑤⑥
C.①③⑤
D.②④⑥
12.喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是
气体 溶液
A SO2 饱和NaHSO3溶液
B HCl 稀氨水
C NO 稀H2SO4
D Cl2 饱和NaCl溶液
13.下列各组实验中,化学反应速率最快的是( )
选项 反应物 催化剂 温度
A 10mL10%H2O2溶液 无 25℃
B 10mL20%H2O2溶液 无 25℃
C 10mL20%H2O2溶液 无 40℃
D 10mL20%H2O2溶液 MnO2粉末 40℃
14.下列解释事实的方程式不正确的是( )
A.NH3遇HCl时,产生白烟:NH3+HCl===NH4Cl
B.NO2溶于水,溶液呈酸性:3NO2+H2O===2HNO3+NO
+ +
C.Fe2O3溶于稀硫酸中,溶液变黄:Fe2O3+6H ===2Fe3 +3H2O
- + +
D.Cu与浓硝酸混合,产生气体:3Cu+2NO3+8H ===3Cu2 +
2NO↑+4H2O
15.用下列实验装置进行相应实验,能达到实验目的的是
A.用图1所示装置从a口进气收集纯净的CH2===CH2
B.用图2所示装置制取并收集乙酸乙酯
C.用图3所示装置比较Fe、Cu的金属活动性
D.用图4所示装置进行石油的蒸馏实验
3
16.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置
部分实验 a极质量减小,b极质 b极有气体产生,c极 d极溶解,c极 电流计指示在导线中电流
现象 量增加 无变化 有气体产生 从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.d>a>c>b B.b>c>d>a C.d>a>b>c D.a>b>d>c
17.其他条件不变时,能使反应速率加快的是( )
A.对于反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),增加Fe的量
B.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入Ar
C.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入N2
D.对于N2(g)+3H2(g) 2NH3(g),容器气体压强不变时,充入Ar
18.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸的性质不
相对应的一组是( )
A.浓硝酸使紫色石蕊溶液先变红后褪色——酸性和强氧化性
B.不能用稀硝酸与锌反应制氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞的氢氧化钠溶液的红色褪去——强氧化性
19.硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的
混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图
所示(CuS不溶于水)。下列说法中,不正确的是
+ +
A.过程①中,生成CuS的反应为H2S+Cu2 =CuS↓+2H
+
B.过程②中,Fe3 作氧化剂
C.回收S的总反应为2H2S+O2=2H2O+2S↓
D.过程③中,各元素化合价均未改变
20.20℃时,将0.1?molN2O4置于1?L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内
的气体逐渐变为红棕色: N2O4(g) 2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反
应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1︰2
②NO2的消耗速率与N2O4的消耗速率之比为2︰1
4
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.②③⑤⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
第Ⅱ卷(非选择题,共60分)
二、填空题
21.(14分)已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G
均为有机物,他们之间有如图转化关系,请回答下列问题:
(1) 写 出 A 中 官 能 团 的 名 称 : __________________ , B 中 官 能 团 的 结 构 简 式
_______________________。
(2)已知A与氢气反应生成F,在F的同系物中最简单的有机物的空间构型为________________。
(3)写出与F互为同系物的含4个碳原子的所有同分异构体的结构简式:
________________________。
(4)写出下列编号对应反应的化学方程式,并注明反应类型:
④_____________________________________________________,__________反应;
⑦_____________________________________________________,__________反应。
5
22.(10分)如图是人类从海水资源中提取某些重要化工原料的流程示意图:
请回答下列问题:
(1)操作A是________________和过滤(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是________(选填编号)。
A.氢氧化钠溶液 B.澄清石灰水
C.石灰乳 D.碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是___________________,用SO2水溶液吸收Br2 ,
吸收率可达95%,有关反应的离子方程式为________________________________。
(4)工业上由无水MgCl2制取镁的化学方程式为__________________。
23.(12分)Ⅰ.汽车尾气中NO生成过程的能量变化如图甲所示。1molN2和1molO2完全反应生成
NO会___________(填“吸收"或“放出")_______________kJ能量。
Ⅱ.将等物质的量的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g) 2HI(g)(正反应放
- -
热),反应经过5min测得碘化氢的浓度为0.5mol·L 1,碘蒸气的浓度为0.25mol·L 1请填写以下
空白:
(1)v(HI)=_____________;v(H2)=_____________;氢气的起始浓度=_____________。
6
(2)若上述反应达到平衡时,则平衡浓度c(HI)、c(I2)、c(H2)的关系是__________________(填“相
等”“2∶1∶1”或“均为恒量”)。
高温
24.(12分)现有反应:A.CaCO3=====CaO+CO2↑ B.Zn+H2SO4===ZnSO4+H2↑
高温
C.C+CO2=====2CO D.2KOH+H2SO4===K2SO4+2H2O
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图所示的是______________(填
反应序号)。
(2)在常温下,上述四个反应中可用于设计原电池的是________(填反应序号),根据该原电池回答下
列问题:
①负极发生________(填“氧化”或“还原”)反应;正极的电极反应式为________________________。
②当导线中有1mol电子通过时,理论上发生的变化是________(填序号)。
a.溶液增重32.5g
b.溶液增重31.5g
c.析出1gH2
d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,
同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示,反应
速率变快的原因是________(填序号)。
a.CuSO4作催化剂
-
b.加入硫酸铜溶液增大了c(SO24 )
+
c.Zn首先与Cu2 反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
7
三、实验题
25.(12 分)某化学学习小组采用下图所示装置,对浓硝酸与木炭的反应进行探究(已知:
△
4HNO3=====4NO2↑+O2↑+2H2O)。
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,伸入三口烧瓶中,并塞
紧瓶塞,滴加浓硝酸,可观察到三口烧瓶中气体的颜色为________,产生该气体的化学方程式是
________________________。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,
该白色沉淀为________________(填化学式)。
(3)装置B的作用是________________。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是________。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶中收集的无色气体是氧气,则氧气的来源是________________。
8
2020—2021 学年度下学期期末质量测试
高一化学 答案及评分标准
一、选择题(每小题2分,共40分)
1-5 BBBAB 6-10 CBBAB 11-15 CBDDC 16-20 CCDDB
二、填空题
21.(14分) (1)碳碳双键(1分) -OH(1分)
(2)正四面体(2分)(3)CH3CH2CH2CH3 (2分) CH3CH(CH3)CH3(2分)
浓硫酸
(4)④CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O(2分)酯化(或取代)(1分)
△
催化剂
⑦CH2===CH2+HCl――→CH3CH2Cl (2分) 加成(1分)
△
22.(10分,每空2分)
(1)蒸发结晶
(2)C
- -
(3)Cl2+2Br ===Br2+2Cl
+ - -
Br2+SO2+2H2O===4H +SO24 +2Br
通电
(4)MgCl2(熔融)=====Mg+Cl2↑
23.(12分,每空2分)Ⅰ.(1)吸收;180
- - - - -
Ⅱ.(1)0.1mol·L 1·min 1 0.05mol·L 1·min 1 0.5mol·L 1
(2)均为恒量
24.(12分,每空2分)
(1)C
+ -
(2)B ①氧化 2H +2e ===H2↑ ②bc
(3)c
25.(12分,每空2分)
△
(1)红棕色 C+4HNO3(浓)=====4NO2↑+CO2↑+2H2O
(2)BaCO3
(3)防倒吸
(4)①AC ②HNO3的分解
9
高一化学
本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,满分100分,考试时间为90
分钟。
注意事项:
1.答题前,考生必须将自己的姓名、准考证号填写清楚,并将准考证号准确的填涂在答题卡上。
2.选择题必须用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字迹工整、笔迹
清楚。
3.请按照题号顺序在各题目的区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无
效。
4.保持卡面清洁,不要折叠、不要弄破、不准使用涂改液、刮纸刀。
可能用到的相对原子质量:H-1 Cu-64 Zn-65 Ag-108
第 I 卷(选择题,共40分)
一、选择题(本大题包括20小题,每小题2分,共40分,每小题给出的四个选项中,只.有.一.项.是
符合题目要求的,请将正确选项填涂在答题卡上)
1.下列物质中,不属于合成材料的是( )
A.塑料 B.天然橡胶 C.合成纤维 D.合成橡胶
2.下列自然资源的开发利用过程只涉及物理变化的是( )
A.高炉炼铁 B.海水晒盐 C.水的电解 D.粮食酿酒
3.中国的中医中药博大精深。中医用药讲究十八反和十八畏,其中有“硫黄原是火中精,朴硝一见
便相争”,硫黄即硫单质。下列说法中正确的是
A.硫是一种淡黄色的能溶于水的固体
B.试管内壁上的硫黄可用二硫化碳清洗
C.过量的硫与铁反应生成Fe2S3,表现了硫单质的氧化性
D.硫在空气中燃烧生成二氧化硫,硫在过量氧气中燃烧生成三氧化硫
4.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则
成铜。熬胆矾铁釜,久之亦化为铜。”下列有关叙述错误的是( )
A.胆矾的化学式为CuSO4
B.胆矾可作为湿法冶铜的原料
C.“熬之则成胆矾”是浓缩结晶过程
D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应
5.下列有关化学用语表示正确的是( )
A.乙酸的结构简式:C2H4O2
1
- -
B.离子结构示意图 可以表示32S2 ,又可以表示34S2
C.空间充填模型 可以表示甲烷分子,也可以表示四氯化碳分子
D.NH3的电子式:
6.下列说法不正确的是
A.厨余垃圾中蕴藏着丰富的生物质能
B.天然气的主要成分甲烷是高效、较洁净的燃料
C.石油的分馏、煤的气化和液化都是物理变化
D.石油的裂化主要是为了得到更多的轻质油
7.由氯乙烯(CH2=CHCl)制得的聚氯乙烯( )可用来制造多种包装材料,下列
有关说法错误的是( )
A.聚氯乙烯属于高分子
B.氯乙烯可由乙烯与氯化氢加成制得
C.由氯乙烯制得聚氯乙烯符合“原子经济性”
D.大量使用聚氯乙烯塑料会造成白色污染
8.下列说法不.正.确.的是
A.葡萄糖能发生银镜反应
B.糖类、油脂、蛋白质都是高分子化合物
C.鸡蛋清溶液中加入硫酸铜溶液会发生变性
D.维生素C能用作食品中的抗氧化剂
9.某化学反应中,反应物B的物质的量浓度在20s内,从2.0mol/L变成了1.0mol/L,则这20s
内B的反应速率为( )
A.0.05mol/(L·s) B.0.05mol/L·s C.0.5mol/(L·s) D.0.05mol/L
10.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g
石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2。下列说法错误的是( )
A.Q1
C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低
D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多
2
11.下图所示各种装置中能构成原电池的是( )
A.①②③
B.④⑤⑥
C.①③⑤
D.②④⑥
12.喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是
气体 溶液
A SO2 饱和NaHSO3溶液
B HCl 稀氨水
C NO 稀H2SO4
D Cl2 饱和NaCl溶液
13.下列各组实验中,化学反应速率最快的是( )
选项 反应物 催化剂 温度
A 10mL10%H2O2溶液 无 25℃
B 10mL20%H2O2溶液 无 25℃
C 10mL20%H2O2溶液 无 40℃
D 10mL20%H2O2溶液 MnO2粉末 40℃
14.下列解释事实的方程式不正确的是( )
A.NH3遇HCl时,产生白烟:NH3+HCl===NH4Cl
B.NO2溶于水,溶液呈酸性:3NO2+H2O===2HNO3+NO
+ +
C.Fe2O3溶于稀硫酸中,溶液变黄:Fe2O3+6H ===2Fe3 +3H2O
- + +
D.Cu与浓硝酸混合,产生气体:3Cu+2NO3+8H ===3Cu2 +
2NO↑+4H2O
15.用下列实验装置进行相应实验,能达到实验目的的是
A.用图1所示装置从a口进气收集纯净的CH2===CH2
B.用图2所示装置制取并收集乙酸乙酯
C.用图3所示装置比较Fe、Cu的金属活动性
D.用图4所示装置进行石油的蒸馏实验
3
16.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置
部分实验 a极质量减小,b极质 b极有气体产生,c极 d极溶解,c极 电流计指示在导线中电流
现象 量增加 无变化 有气体产生 从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.d>a>c>b B.b>c>d>a C.d>a>b>c D.a>b>d>c
17.其他条件不变时,能使反应速率加快的是( )
A.对于反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),增加Fe的量
B.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入Ar
C.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入N2
D.对于N2(g)+3H2(g) 2NH3(g),容器气体压强不变时,充入Ar
18.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸的性质不
相对应的一组是( )
A.浓硝酸使紫色石蕊溶液先变红后褪色——酸性和强氧化性
B.不能用稀硝酸与锌反应制氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞的氢氧化钠溶液的红色褪去——强氧化性
19.硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的
混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图
所示(CuS不溶于水)。下列说法中,不正确的是
+ +
A.过程①中,生成CuS的反应为H2S+Cu2 =CuS↓+2H
+
B.过程②中,Fe3 作氧化剂
C.回收S的总反应为2H2S+O2=2H2O+2S↓
D.过程③中,各元素化合价均未改变
20.20℃时,将0.1?molN2O4置于1?L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内
的气体逐渐变为红棕色: N2O4(g) 2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反
应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1︰2
②NO2的消耗速率与N2O4的消耗速率之比为2︰1
4
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.②③⑤⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
第Ⅱ卷(非选择题,共60分)
二、填空题
21.(14分)已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G
均为有机物,他们之间有如图转化关系,请回答下列问题:
(1) 写 出 A 中 官 能 团 的 名 称 : __________________ , B 中 官 能 团 的 结 构 简 式
_______________________。
(2)已知A与氢气反应生成F,在F的同系物中最简单的有机物的空间构型为________________。
(3)写出与F互为同系物的含4个碳原子的所有同分异构体的结构简式:
________________________。
(4)写出下列编号对应反应的化学方程式,并注明反应类型:
④_____________________________________________________,__________反应;
⑦_____________________________________________________,__________反应。
5
22.(10分)如图是人类从海水资源中提取某些重要化工原料的流程示意图:
请回答下列问题:
(1)操作A是________________和过滤(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是________(选填编号)。
A.氢氧化钠溶液 B.澄清石灰水
C.石灰乳 D.碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是___________________,用SO2水溶液吸收Br2 ,
吸收率可达95%,有关反应的离子方程式为________________________________。
(4)工业上由无水MgCl2制取镁的化学方程式为__________________。
23.(12分)Ⅰ.汽车尾气中NO生成过程的能量变化如图甲所示。1molN2和1molO2完全反应生成
NO会___________(填“吸收"或“放出")_______________kJ能量。
Ⅱ.将等物质的量的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g) 2HI(g)(正反应放
- -
热),反应经过5min测得碘化氢的浓度为0.5mol·L 1,碘蒸气的浓度为0.25mol·L 1请填写以下
空白:
(1)v(HI)=_____________;v(H2)=_____________;氢气的起始浓度=_____________。
6
(2)若上述反应达到平衡时,则平衡浓度c(HI)、c(I2)、c(H2)的关系是__________________(填“相
等”“2∶1∶1”或“均为恒量”)。
高温
24.(12分)现有反应:A.CaCO3=====CaO+CO2↑ B.Zn+H2SO4===ZnSO4+H2↑
高温
C.C+CO2=====2CO D.2KOH+H2SO4===K2SO4+2H2O
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图所示的是______________(填
反应序号)。
(2)在常温下,上述四个反应中可用于设计原电池的是________(填反应序号),根据该原电池回答下
列问题:
①负极发生________(填“氧化”或“还原”)反应;正极的电极反应式为________________________。
②当导线中有1mol电子通过时,理论上发生的变化是________(填序号)。
a.溶液增重32.5g
b.溶液增重31.5g
c.析出1gH2
d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,
同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示,反应
速率变快的原因是________(填序号)。
a.CuSO4作催化剂
-
b.加入硫酸铜溶液增大了c(SO24 )
+
c.Zn首先与Cu2 反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
7
三、实验题
25.(12 分)某化学学习小组采用下图所示装置,对浓硝酸与木炭的反应进行探究(已知:
△
4HNO3=====4NO2↑+O2↑+2H2O)。
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,伸入三口烧瓶中,并塞
紧瓶塞,滴加浓硝酸,可观察到三口烧瓶中气体的颜色为________,产生该气体的化学方程式是
________________________。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,
该白色沉淀为________________(填化学式)。
(3)装置B的作用是________________。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是________。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶中收集的无色气体是氧气,则氧气的来源是________________。
8
2020—2021 学年度下学期期末质量测试
高一化学 答案及评分标准
一、选择题(每小题2分,共40分)
1-5 BBBAB 6-10 CBBAB 11-15 CBDDC 16-20 CCDDB
二、填空题
21.(14分) (1)碳碳双键(1分) -OH(1分)
(2)正四面体(2分)(3)CH3CH2CH2CH3 (2分) CH3CH(CH3)CH3(2分)
浓硫酸
(4)④CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O(2分)酯化(或取代)(1分)
△
催化剂
⑦CH2===CH2+HCl――→CH3CH2Cl (2分) 加成(1分)
△
22.(10分,每空2分)
(1)蒸发结晶
(2)C
- -
(3)Cl2+2Br ===Br2+2Cl
+ - -
Br2+SO2+2H2O===4H +SO24 +2Br
通电
(4)MgCl2(熔融)=====Mg+Cl2↑
23.(12分,每空2分)Ⅰ.(1)吸收;180
- - - - -
Ⅱ.(1)0.1mol·L 1·min 1 0.05mol·L 1·min 1 0.5mol·L 1
(2)均为恒量
24.(12分,每空2分)
(1)C
+ -
(2)B ①氧化 2H +2e ===H2↑ ②bc
(3)c
25.(12分,每空2分)
△
(1)红棕色 C+4HNO3(浓)=====4NO2↑+CO2↑+2H2O
(2)BaCO3
(3)防倒吸
(4)①AC ②HNO3的分解
9
同课章节目录
