第三单元 课题2 原子的结构课件——2021-2022学年九年级化学人教版上册(23张PPT)
文档属性
| 名称 | 第三单元 课题2 原子的结构课件——2021-2022学年九年级化学人教版上册(23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-24 08:51:19 | ||
图片预览







文档简介
原子的 结 构
课题2
原子的结构
人教版九年级化学上册
学习目标
1.了解原子是由质子、中子和电子构成的。
2.理解构成原子的粒子间的关系。
原子的构成
显微镜下的多原子分子
我们可以看到分子整齐地排列着,每一个分子由大小不同的原子构成。我们能看到的最小的微粒就是原子,通过研究发现原子是可以再分的。
1.原子是由哪几部分构成的?
2.原子核是由哪些粒子构成的?这些粒子有什么不同?
3.原子核和核外电子都带电,为什么整个原子不显电性?
4.不同类原子内部构成有什么不同?
讨论题
阅读第53页的内容,思考以下问题:
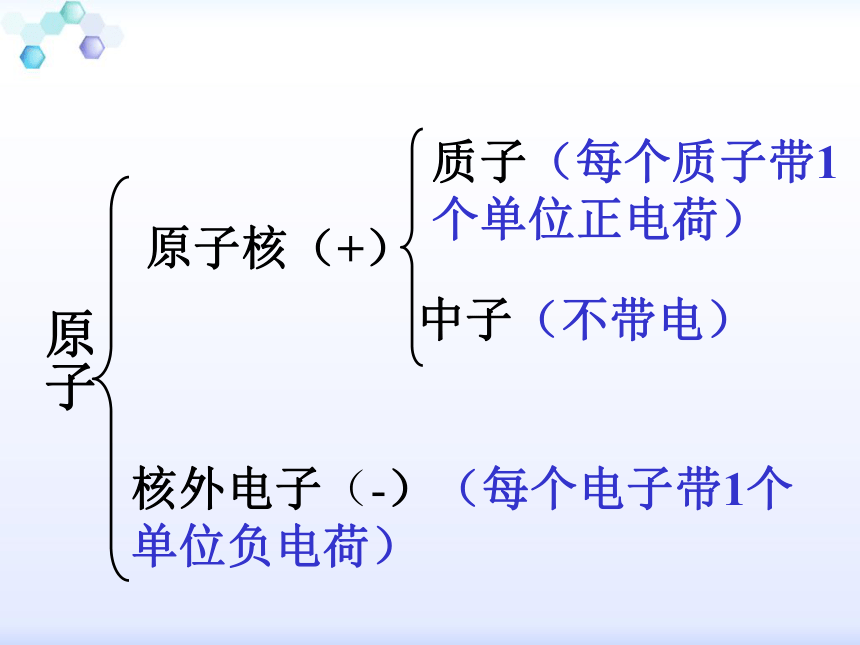
原子
原子核(+)
核外电子(-)(每个电子带1个单位负电荷)
质子(每个质子带1个单位正电荷)
中子(不带电)
原子的探索
1.道尔顿最先提出原子学说,他认为原子是不可再分的实心球体
2.汤姆生发现电子后,提出原子的枣糕模型,即带负电的电子嵌在均匀带正电的原子内。
3.卢瑟福根据阿尔法粒子散射实验提出核式结构,认为原子分为原子核和电子。
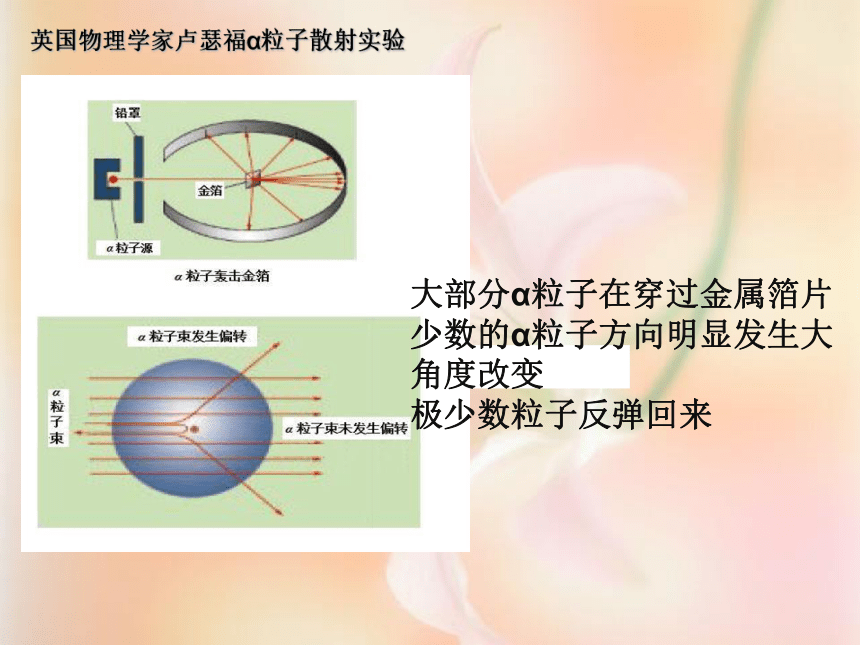
英国物理学家卢瑟福α粒子散射实验
大部分α粒子在穿过金属箔片
少数的α粒子方向明显发生大角度改变
极少数粒子反弹回来
为什么?
?大部分α粒子在穿过金属箔片而不改变原来的运动方向—— ?少数的α粒子方向明显发生大角度改变——
?极少数粒子反弹回来——
原子内部有很大的空间
原子核带正电,α粒子途径金原子核附近时,受到斥力而改变了运动方向。
原子中有一个很小的原子核,原子核很小,但集中了较大的质量。
原子核
原子
原子核比原子小得多
〖结论〗
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
1.原子是由哪几部分构成的?
2.原子核是由哪些粒子构成的?这些粒子有什么不同?
3.原子核和核外电子都带电,为什么整个原子不显电性?
4.不同类原子内部构成有什么不同?
讨论题
阅读第53页的内容,思考以下问题:
思考:原子中存在带电的粒子,为什么整个原子不显电性?
原子是由原子核和核外电子构成的,原子核又由质子和中子构成,质子带正电,中子不带电;原子核所带的正电荷和核外电子带负电荷量相等,但电性相反,所以整个原子不显电性。
思考:原子核还能不能再分?
1964年10月16日,我国第一颗原子弹爆炸成功,原子弹爆炸正是利用原子核裂变时产生的巨大能量,这说明了原子核还能再分。科学家通过不断的实验探究,获得了原子核由质子和中子构成的结论,其中质子带正电荷,中子不带电。并且在不同的原子中,质子、中子本身都一样,区别在于,不同的原子中所含的质子、中子数目不同。
( P70表4-1)构成原子的粒子的电性和质量
粒子
种类
电性
质量
质子
1个单位正电荷
1.6726×10-27kg
中子
不带电
1.6749×10-27kg
电子
1个单位负电荷
质子质量的1/1836
?从上表你能得出哪些发现?
B幻灯片 15
发现1:质子和电子的电量相同,……
发现2:原子的质量主要集中在……
构成原子的三种基本微粒质子、中子、电子各有何特点,不同原子的内部构成有何不同。
观察4-2表,相互讨论,总结交流。
几种原子的构成
原子种类
质子数
中子数
电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
氯
17
18
17
图4-2
原子构成的规律:
⑴、核电荷数 = 质子数 = 核外电子数
(原子核所带的电荷数简称为核电荷数)
⑵、质子数不一定等于中子数。
⑶、原子中不一定含有中子。
⑷、原子里质子数不同,原子种类也不同。
课堂练习
1.下列关于原子的叙述中,错误的是( )
A、原子呈电中性 B、原子是实心球体
C、原子由原子核和核外电子构成 D、原子可以构成分子
2.钛和钛合金被认为是21世纪重要的金属材料,它们具有熔点高、密度小、抗腐蚀性能好等优良性能,因此被广泛用于火箭、航天飞机、船舶和化工等。已知钛原子的质子数为22,中子数为26,则钛原子的核外电子数为( )
A、48 B、26 C、22 D、4
B
C
3.下列粒子中带正电荷的是( )。(填序号)
①电子 ②质子 ③中子 ④原子核
⑤原子 ⑥分子
②④
4.在原子中( )
A.质子数一定等于中子数
B.质子数一定等于电子数
C.质子数、中子数、电子数三者相等
D.原子核所带的电荷数跟核外电子的电荷数相等
BD
5.已知1个水分子由2个氢原子和1个氧原子构成,每个氢原子的核电荷数为1,每个氧原子的原子核内有8个质子,则1个水分子里有_____个质子, _____个原子核, _____个电子,整个水分子(填”显”或“不显”) _____电性。
10
3
10
不显
练习2:填表:
原子名 称
原 子 核
核 外 电子数
核电荷数
质子数
中子数
碳
6
6
氧
8
8
钠
11
硫
16
镁
12
12
6
6
8
8
11
12
11
16
16
16
12
12
课题2
原子的结构
人教版九年级化学上册
学习目标
1.了解原子是由质子、中子和电子构成的。
2.理解构成原子的粒子间的关系。
原子的构成
显微镜下的多原子分子
我们可以看到分子整齐地排列着,每一个分子由大小不同的原子构成。我们能看到的最小的微粒就是原子,通过研究发现原子是可以再分的。
1.原子是由哪几部分构成的?
2.原子核是由哪些粒子构成的?这些粒子有什么不同?
3.原子核和核外电子都带电,为什么整个原子不显电性?
4.不同类原子内部构成有什么不同?
讨论题
阅读第53页的内容,思考以下问题:
原子
原子核(+)
核外电子(-)(每个电子带1个单位负电荷)
质子(每个质子带1个单位正电荷)
中子(不带电)
原子的探索
1.道尔顿最先提出原子学说,他认为原子是不可再分的实心球体
2.汤姆生发现电子后,提出原子的枣糕模型,即带负电的电子嵌在均匀带正电的原子内。
3.卢瑟福根据阿尔法粒子散射实验提出核式结构,认为原子分为原子核和电子。
英国物理学家卢瑟福α粒子散射实验
大部分α粒子在穿过金属箔片
少数的α粒子方向明显发生大角度改变
极少数粒子反弹回来
为什么?
?大部分α粒子在穿过金属箔片而不改变原来的运动方向—— ?少数的α粒子方向明显发生大角度改变——
?极少数粒子反弹回来——
原子内部有很大的空间
原子核带正电,α粒子途径金原子核附近时,受到斥力而改变了运动方向。
原子中有一个很小的原子核,原子核很小,但集中了较大的质量。
原子核
原子
原子核比原子小得多
〖结论〗
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
1.原子是由哪几部分构成的?
2.原子核是由哪些粒子构成的?这些粒子有什么不同?
3.原子核和核外电子都带电,为什么整个原子不显电性?
4.不同类原子内部构成有什么不同?
讨论题
阅读第53页的内容,思考以下问题:
思考:原子中存在带电的粒子,为什么整个原子不显电性?
原子是由原子核和核外电子构成的,原子核又由质子和中子构成,质子带正电,中子不带电;原子核所带的正电荷和核外电子带负电荷量相等,但电性相反,所以整个原子不显电性。
思考:原子核还能不能再分?
1964年10月16日,我国第一颗原子弹爆炸成功,原子弹爆炸正是利用原子核裂变时产生的巨大能量,这说明了原子核还能再分。科学家通过不断的实验探究,获得了原子核由质子和中子构成的结论,其中质子带正电荷,中子不带电。并且在不同的原子中,质子、中子本身都一样,区别在于,不同的原子中所含的质子、中子数目不同。
( P70表4-1)构成原子的粒子的电性和质量
粒子
种类
电性
质量
质子
1个单位正电荷
1.6726×10-27kg
中子
不带电
1.6749×10-27kg
电子
1个单位负电荷
质子质量的1/1836
?从上表你能得出哪些发现?
B幻灯片 15
发现1:质子和电子的电量相同,……
发现2:原子的质量主要集中在……
构成原子的三种基本微粒质子、中子、电子各有何特点,不同原子的内部构成有何不同。
观察4-2表,相互讨论,总结交流。
几种原子的构成
原子种类
质子数
中子数
电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
氯
17
18
17
图4-2
原子构成的规律:
⑴、核电荷数 = 质子数 = 核外电子数
(原子核所带的电荷数简称为核电荷数)
⑵、质子数不一定等于中子数。
⑶、原子中不一定含有中子。
⑷、原子里质子数不同,原子种类也不同。
课堂练习
1.下列关于原子的叙述中,错误的是( )
A、原子呈电中性 B、原子是实心球体
C、原子由原子核和核外电子构成 D、原子可以构成分子
2.钛和钛合金被认为是21世纪重要的金属材料,它们具有熔点高、密度小、抗腐蚀性能好等优良性能,因此被广泛用于火箭、航天飞机、船舶和化工等。已知钛原子的质子数为22,中子数为26,则钛原子的核外电子数为( )
A、48 B、26 C、22 D、4
B
C
3.下列粒子中带正电荷的是( )。(填序号)
①电子 ②质子 ③中子 ④原子核
⑤原子 ⑥分子
②④
4.在原子中( )
A.质子数一定等于中子数
B.质子数一定等于电子数
C.质子数、中子数、电子数三者相等
D.原子核所带的电荷数跟核外电子的电荷数相等
BD
5.已知1个水分子由2个氢原子和1个氧原子构成,每个氢原子的核电荷数为1,每个氧原子的原子核内有8个质子,则1个水分子里有_____个质子, _____个原子核, _____个电子,整个水分子(填”显”或“不显”) _____电性。
10
3
10
不显
练习2:填表:
原子名 称
原 子 核
核 外 电子数
核电荷数
质子数
中子数
碳
6
6
氧
8
8
钠
11
硫
16
镁
12
12
6
6
8
8
11
12
11
16
16
16
12
12
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
