京改版化学九年级上册 5.3 化合价 课件(23张PPT)
文档属性
| 名称 | 京改版化学九年级上册 5.3 化合价 课件(23张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-24 10:58:53 | ||
图片预览





文档简介
化合价
中学化学 九年级 上册
第5章 第3节
原子
原子核
(+)
质子(+)
中子
核外电子(–)
最外层电子数影响
元素的化学性质
质子数决定元素的种类
复习:
+17
+1
1
2
8
+11
+12
2
2
1
8
8
判断下列是哪种元素的原
子结构示意图?
氢
H
氯
Cl
钠
Na
镁
Mg
2
7
+13
2
8
铝
Al
3
+7
2
5
氮
N
复习:
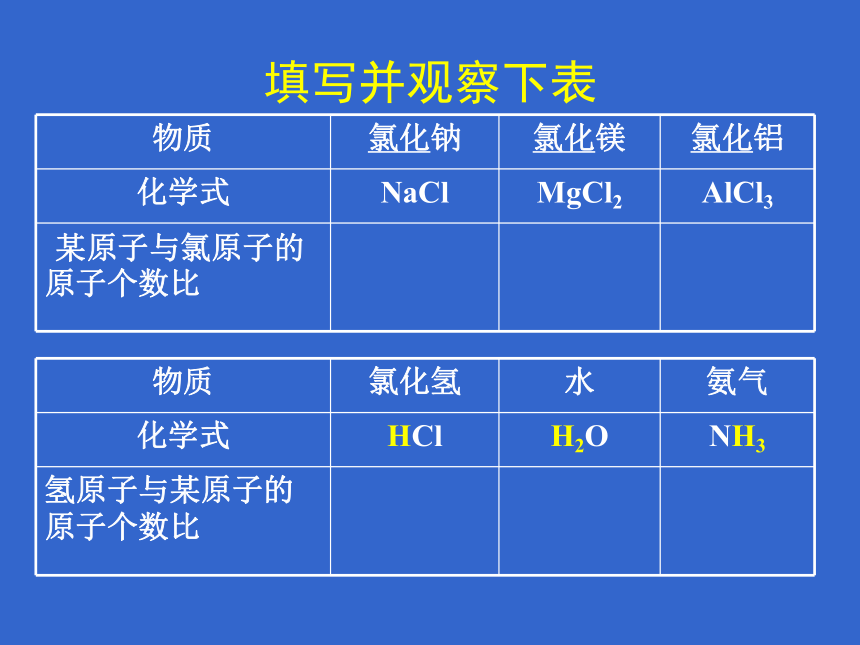
物质
氯化钠
氯化镁
氯化铝
化学式
NaCl
MgCl2
AlCl3
某原子与氯原子的 原子个数比
物质
氯化氢
水
氨气
化学式
HCl
H2O
NH3
氢原子与某原子的 原子个数比
填写并观察下表
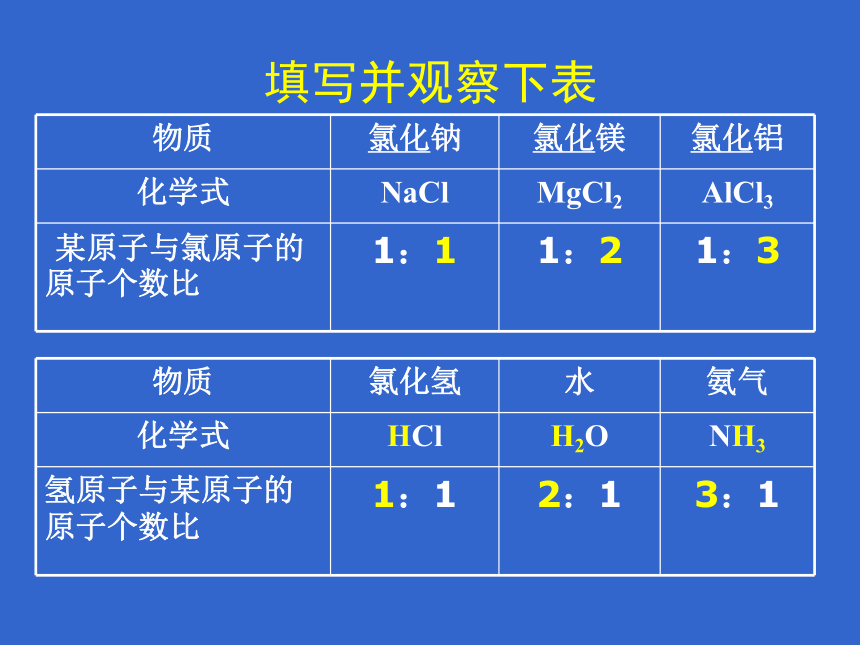
物质
氯化钠
氯化镁
氯化铝
化学式
NaCl
MgCl2
AlCl3
某原子与氯原子的 原子个数比
1:1
1:2
1:3
物质
氯化氢
水
氨气
化学式
HCl
H2O
NH3
氢原子与某原子的 原子个数比
1:1
2:1
3:1
填写并观察下表
小游戏:化合物的形成
说明:请4组同学分别代表钠、镁、铝、氯元素,模拟氯化钠、氯化镁、氯化铝形成的过程。原子得失电子数目及带电情况请贴在你的右肩上。表示的化合价贴在头上。
-1
+1
+2
-1
+3
-1
NaCl MgCl2 AlCl3
化合物的形成
得1e
得1e
得1e
失1e
失2e
失3e
宏观:化合价
微观:一个原子得失电子数
*
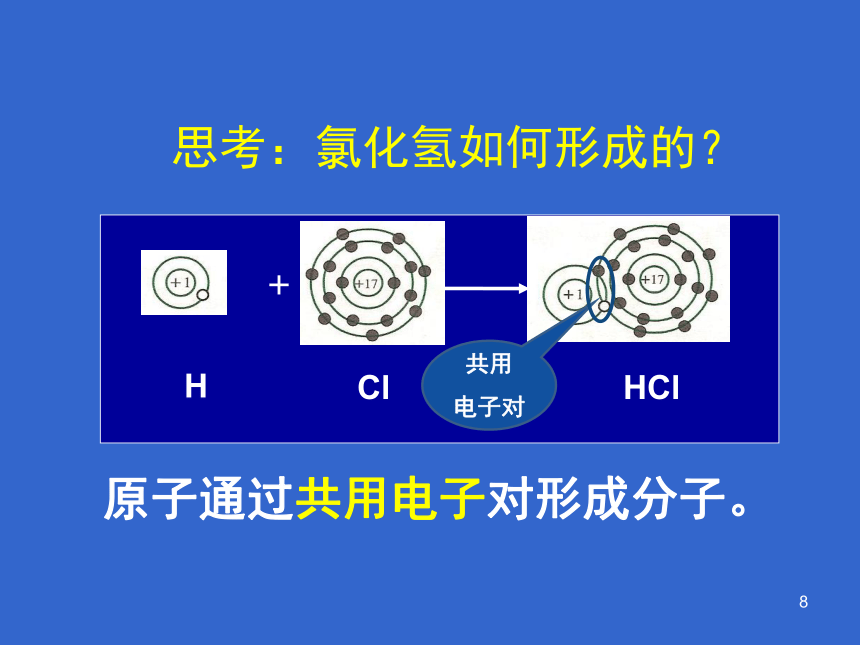
思考:氯化氢如何形成的?
原子通过共用电子对形成分子。
+
共用
电子对
H
Cl
HCl
H Cl
×
●
●
●
●
●
●
●
●
H O
×
●
●
●
●
●
×
H
●
●
H
H N
×
●
●
×
●
×
H
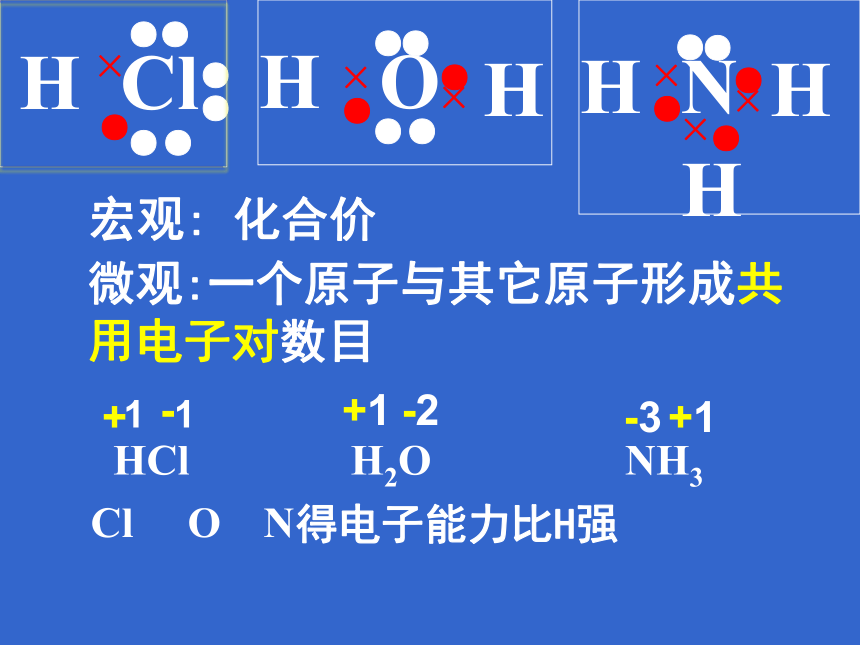
-
+
+1
-2
-3
+1
微观:一个原子与其它原子形成共用电子对数目
宏观: 化合价
HCl H2O NH3
Cl O N得电子能力比H强
1
1
元素的化合价是元素的
原子在形成化合物时表现出
来的一种性质。
化合价有正价和负价。
请结合第三章的图3-11思考并讨论
元素化合价的数值 、正负性与元素的原子结构有什么联系?完成下表。
化合物
离子化合物
共价化合物
数值
正价
负价
原则
单质中元素的化合价为零
一个原子得失电子的数目
一个原子共用电子对数目
一个原子失去电子的数目
电子对偏离的原子
电子对偏向的原子
一个原子得到电子的数目
化合物中正负化合价的代数和为零
元素化合价的确定
化合价口诀(黄色为负价)
一价氢氯钾钠银,
二价氧钙镁钡锌,
三铝四硅五价磷,
二、三铁,二、四碳,
二、四、六硫都齐全,
铜汞二价最常见。
根的价要记清,-1硝酸 氢氧根,
-2硫酸 碳酸根,+1价的是铵根。
莫忘单质价为零。
常见原子团化合价写法
氢氧根: 硝酸根: 硫酸根:
碳酸根: 铵根: 磷酸根:
【例题1】高锰酸钾是实验室制取氧气的原料,其加热后生成氧气和另外两种含锰元素的化合物。请写出以上三种含锰元素化合物的化学式,并标出每种化合物中锰元素的化合价。
根据化学式计算元素的化合价
重铬酸钾(K2Cr2O7)可用于检查司机是否喝酒,该物质中Cr的化合价为 。
K2Cr2O7
(+1)×2+(x)×2+(-2)×7=0
x = +6
+6
+1 X -2
化学式 化合价
推求
依据化合价书写简单的化学式
【例题2】硫在空气中燃烧时会生成带有刺激性气味的含硫氧化物,其中硫元素的化合价为+4,氧元素的化合价为-2,写出这种含硫氧化物的化学式和名称。
1.写出元素符号(正价在前负价在后)
2.标出元素化合价
3.交叉约简标数目
4.检验
SO
+4-2
2
化合价 化学式
推求
写出+5价磷元素组成氧化物
的化学式
【练习1】
﹣1
OH
﹣2
CO3
化学式
名称
化学式
名称
+1
Na
+2
Ca
【练习2】
﹣1
OH
﹣2
CO3
化学式
名称
化学式
名称
+1
Na
NaOH
氢氧化钠
Na2CO3
碳酸钠
+2
Ca
Ca(OH)2
氢氧化钙
CaCO3
碳酸钙
氢氧化某
某酸某
【练习2】
原子
物质
原子核
核外电子
质子
中子
相对原子质量
分 子
构成
组成
元素
数字
元素符号
表示
构成
化学式
化合价
组成
确定原子个数比
元素的性质表现
依据结构推其化合价
离 子
NaClO4 KClO3 NaClO
+5
+7
+1
-1
0
Cl2 NaCl
KClO3 NaClO
【练习】将下列物质按氯元素的化合价由高到低的顺序排列:
Cl2 NaClO4 NaCl
中学化学 九年级 上册
第5章 第3节
原子
原子核
(+)
质子(+)
中子
核外电子(–)
最外层电子数影响
元素的化学性质
质子数决定元素的种类
复习:
+17
+1
1
2
8
+11
+12
2
2
1
8
8
判断下列是哪种元素的原
子结构示意图?
氢
H
氯
Cl
钠
Na
镁
Mg
2
7
+13
2
8
铝
Al
3
+7
2
5
氮
N
复习:
物质
氯化钠
氯化镁
氯化铝
化学式
NaCl
MgCl2
AlCl3
某原子与氯原子的 原子个数比
物质
氯化氢
水
氨气
化学式
HCl
H2O
NH3
氢原子与某原子的 原子个数比
填写并观察下表
物质
氯化钠
氯化镁
氯化铝
化学式
NaCl
MgCl2
AlCl3
某原子与氯原子的 原子个数比
1:1
1:2
1:3
物质
氯化氢
水
氨气
化学式
HCl
H2O
NH3
氢原子与某原子的 原子个数比
1:1
2:1
3:1
填写并观察下表
小游戏:化合物的形成
说明:请4组同学分别代表钠、镁、铝、氯元素,模拟氯化钠、氯化镁、氯化铝形成的过程。原子得失电子数目及带电情况请贴在你的右肩上。表示的化合价贴在头上。
-1
+1
+2
-1
+3
-1
NaCl MgCl2 AlCl3
化合物的形成
得1e
得1e
得1e
失1e
失2e
失3e
宏观:化合价
微观:一个原子得失电子数
*
思考:氯化氢如何形成的?
原子通过共用电子对形成分子。
+
共用
电子对
H
Cl
HCl
H Cl
×
●
●
●
●
●
●
●
●
H O
×
●
●
●
●
●
×
H
●
●
H
H N
×
●
●
×
●
×
H
-
+
+1
-2
-3
+1
微观:一个原子与其它原子形成共用电子对数目
宏观: 化合价
HCl H2O NH3
Cl O N得电子能力比H强
1
1
元素的化合价是元素的
原子在形成化合物时表现出
来的一种性质。
化合价有正价和负价。
请结合第三章的图3-11思考并讨论
元素化合价的数值 、正负性与元素的原子结构有什么联系?完成下表。
化合物
离子化合物
共价化合物
数值
正价
负价
原则
单质中元素的化合价为零
一个原子得失电子的数目
一个原子共用电子对数目
一个原子失去电子的数目
电子对偏离的原子
电子对偏向的原子
一个原子得到电子的数目
化合物中正负化合价的代数和为零
元素化合价的确定
化合价口诀(黄色为负价)
一价氢氯钾钠银,
二价氧钙镁钡锌,
三铝四硅五价磷,
二、三铁,二、四碳,
二、四、六硫都齐全,
铜汞二价最常见。
根的价要记清,-1硝酸 氢氧根,
-2硫酸 碳酸根,+1价的是铵根。
莫忘单质价为零。
常见原子团化合价写法
氢氧根: 硝酸根: 硫酸根:
碳酸根: 铵根: 磷酸根:
【例题1】高锰酸钾是实验室制取氧气的原料,其加热后生成氧气和另外两种含锰元素的化合物。请写出以上三种含锰元素化合物的化学式,并标出每种化合物中锰元素的化合价。
根据化学式计算元素的化合价
重铬酸钾(K2Cr2O7)可用于检查司机是否喝酒,该物质中Cr的化合价为 。
K2Cr2O7
(+1)×2+(x)×2+(-2)×7=0
x = +6
+6
+1 X -2
化学式 化合价
推求
依据化合价书写简单的化学式
【例题2】硫在空气中燃烧时会生成带有刺激性气味的含硫氧化物,其中硫元素的化合价为+4,氧元素的化合价为-2,写出这种含硫氧化物的化学式和名称。
1.写出元素符号(正价在前负价在后)
2.标出元素化合价
3.交叉约简标数目
4.检验
SO
+4-2
2
化合价 化学式
推求
写出+5价磷元素组成氧化物
的化学式
【练习1】
﹣1
OH
﹣2
CO3
化学式
名称
化学式
名称
+1
Na
+2
Ca
【练习2】
﹣1
OH
﹣2
CO3
化学式
名称
化学式
名称
+1
Na
NaOH
氢氧化钠
Na2CO3
碳酸钠
+2
Ca
Ca(OH)2
氢氧化钙
CaCO3
碳酸钙
氢氧化某
某酸某
【练习2】
原子
物质
原子核
核外电子
质子
中子
相对原子质量
分 子
构成
组成
元素
数字
元素符号
表示
构成
化学式
化合价
组成
确定原子个数比
元素的性质表现
依据结构推其化合价
离 子
NaClO4 KClO3 NaClO
+5
+7
+1
-1
0
Cl2 NaCl
KClO3 NaClO
【练习】将下列物质按氯元素的化合价由高到低的顺序排列:
Cl2 NaClO4 NaCl
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
