第4章《认识化学变化》测试题(含答案)-2021-2022学年九年级化学沪教版上册(word版 含答案)
文档属性
| 名称 | 第4章《认识化学变化》测试题(含答案)-2021-2022学年九年级化学沪教版上册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 133.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-25 00:00:00 | ||
图片预览



文档简介
第4章《认识化学变化》测试题
一、单选题
1.2019年5月12日是我国第11个全国防灾减灾日,主题是“提高灾害防治能力,构筑生命安全防线”。下列做法中,符合安全要求的是
A.化工厂厂区严禁烟火 B.在加油站里接打电话
C.危险药品随意放置 D.占用消防通道停车
2.密闭容器中飘浮的下列物质,遇明火不可能发生爆炸的是( )
A.棉絮 B.面粉 C.沙尘 D.炭粉
3.逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.氢气爆炸、火药爆炸都有新物质生成,因此爆炸都是化学变化
B.氧化物中含有氧元素,则含有氧元素的化合物一定是氧化物
C.蜡烛燃烧生成CO2和H2O,则蜡烛里一定含有碳元素和氢元素
D.分子是保持物质化学性质的最小粒子,因此分子不可再分
4.黑火药的主要成分是硝酸钾、木炭粉、硫磺粉等,点燃时发生爆炸的化学方程式为:S+2KNO3+3CfalseK2S+3CO2↑+X↑,其中X的化学式是
A.N2 B.NO2 C.NO D.N2O
5.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如下图所示:下列说法不正确的是
A.乙可能是单质
B.丁可能是反应的催化剂
C.该反应是化合反应
D.甲和乙的质量之和一定等于生成丙的质量
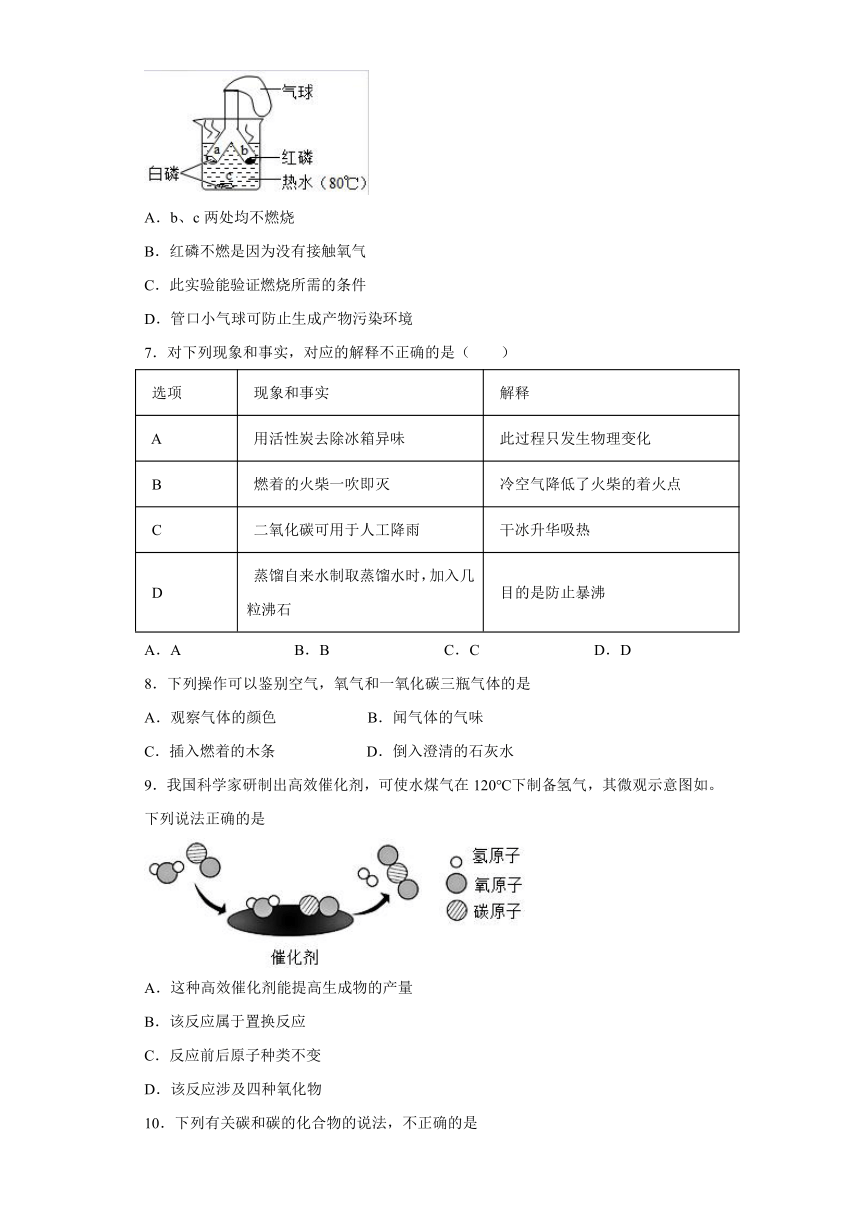
6.如图所示,将白磷和红磷分装于Y形试管的2个支管中,管口系牢小气球,将2个支管同时伸入相同深度的热水中。下列说法不正确的是
A.b、c两处均不燃烧
B.红磷不燃是因为没有接触氧气
C.此实验能验证燃烧所需的条件
D.管口小气球可防止生成产物污染环境
7.对下列现象和事实,对应的解释不正确的是( )
选项
现象和事实
解释
A
用活性炭去除冰箱异味
此过程只发生物理变化
B
燃着的火柴一吹即灭
冷空气降低了火柴的着火点
C
二氧化碳可用于人工降雨
干冰升华吸热
D
蒸馏自来水制取蒸馏水时,加入几粒沸石
目的是防止暴沸
A.A B.B C.C D.D
8.下列操作可以鉴别空气,氧气和一氧化碳三瓶气体的是
A.观察气体的颜色 B.闻气体的气味
C.插入燃着的木条 D.倒入澄清的石灰水
9.我国科学家研制出高效催化剂,可使水煤气在120℃下制备氢气,其微观示意图如。下列说法正确的是
A.这种高效催化剂能提高生成物的产量
B.该反应属于置换反应
C.反应前后原子种类不变
D.该反应涉及四种氧化物
10.下列有关碳和碳的化合物的说法,不正确的是
A.金刚石是天然存在的最硬的物质
B.CO2、CO的组成元素相同,化学性质也相同
C.CO极易与血红蛋白结合,造成生物体内缺氧,严重时危及生命
D.金刚石、石墨物理性质有很大差异的原因是碳原子排列方式不同
11.在100g含碳酸钙90%的石灰石中,加入过量的稀盐酸(杂质不参加反应)。有关说法正确的是( )
A.参加反应的碳酸钙与生成的二氧化碳的质量比为1:1
B.盐酸过量越多,生成的二氧化碳也越多
C.参加反应的碳酸钙的物质的量为0.1mol
D.生成的氯化钙中,钙元素的质量为36g
12.地球大气的演化经历了原始大气、次生大气和现代大气三个阶段,次生大气中部分成分的微观示意图如下:
甲
乙
丙
一定条件下,3.4g甲物质和4.8g氧气恰好完全反应,生成5.4g乙物质和另一种物质X,下列判断不正确的是
A.物质甲的化学式是NH3
B.物质X的质量为2.8g
C.物质X的化学式是N2
D.该反应化学方程式中物质X与O2的化学计量数之比为3∶2
13.某气体由CH4、CO、H2中的一种或几种组成,取该气体样品在氧气中完全燃烧,测 得生成的CO2和H2O的质量比为11:9,下列判断正确的是( )
A.原气体可能是H2和 CH4 的混合物
B.原气体中一定含有CH4
C.原气体中若含有CO,则一定含有 H2
D.气体中若同时含有CH4、CO 和H2,则 CO与H2的质量之比为 14:1
14.下列说法不正确的是
A.家里因为电路短路而造成火灾,应该迅速拉下电闸,再取水扑灭
B.赤壁大战中,庞统献给曹操的铁索连环之计,使木船不能摆脱铁索的束缚,及时驶离着火区域,这属于逆向使用灭火原理的例子
C.木屋着火时,迅速浇水,不能隔绝可燃物与氧气接触,却能够提升其着火点而灭火
D.厨房的油锅着火时,用锅盖盖上去灭火比浇水灭火合理
15.在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物X。取一定质量的AgNO3固体充分光照,测得反应后生成Ag、O2、X的质量分别为10.8g、mg、4.6g。下列说法正确的是
A.AgNO3固体应密封保存在无色细口瓶中
B.m=1.6
C.X的化学式为NO
D.该反应方程式中Ag与O2的化学计量数之比为3:2
二、填空题
16.(1)现有A.钛合金B.稀有气体C.氢氧化钙D氯化钠四种物质,选择适当的物质填空(填字母)
①农业上用来选种的物质________。
②与人体具有很好相容性的金属材料______。
③可用来中和酸性土壤的物质______。
④可以发出不同颜色电光源的物质_______。
(2)煤、石油、天然气是不可再生的三大化石燃料。如今,天然气已成为城市家庭的主要生活燃料之一。天然气的主要成分是_______(填化学式)。为防止因天然气泄漏造成危险,可在家中安装报警器,在甲、乙两图中,安装位置正确的是_______。
(3)煤的气化是把煤变为清沽能源的重要环节之一,其中一个重要的反应是:false,其中X的化学式是____。
17.建筑材料中常用到下列反应。请写出有关的化学方程式。
(1)石灰石煅烧制得生石灰(CaO)和二氧化碳________________________________;
(2)用生石灰与水反应制石灰浆(氢氧化钙)_________________________________;
(3)用石灰浆刷墙壁,墙上附着一层白色坚硬的物质____________________________。
18.下列各实验均给出两步主要操作,请将需要先进行的操作的序号填在空白处。
(1)检查装置气密性:__________。①用手捂住容器外壁 ②将导管插入水中
(2)用托盘天平称取5g食盐:____。①向天平左盘中加入食盐②在天平右盘放5g砝码
(3)高锰酸钾制取氧气____。①将导管撤离水面 ②停止加热
(4)一氧化碳还原氧化铜:___________。 ①加热 ②通CO
19.写出下列反应的文字表达式或符号表达式(下同)。
(1)碳酸氢铵加热______。
(2)实验室制取二氧化碳______。
(3)加热碱式碳酸铜______。
(4)镁条燃烧______。
三、推断题
20.已知A﹣E都是初中化学中的常见物质,其中A和D是无色无味气体,B是黑色粉末,C是红色固体,它们的转化关系如图所示(部分反应的反应条件或生成物已省略)。
(1)写出各物质的化学式:A._____B._____C._____D._____E._____。
(2)写出反应①的化学方程式:_____;若反应③的反应条件是高温,请写出反应③的化学方程式:_____,属于_____反应(填基本反应类型)。
(3)D转化为A的化学方程式:_____。
四、实验题
21.在“质量守恒定律”的教学中,老师引导同学们进行“化学反应中反应物与生成物的质量关系”的实验探究,请你参与探究并回答有关问题:
(1)如图A、B所示,将锥形瓶(反应物未接触)放在天平上,右盘加砝码使之平衡,取下锥形瓶,将锥形瓶中两种物质混合,反应完全后将锥形瓶再放回天平左盘上。
①A瓶重新放回到天平上,天平 _______ (填“能”或“不能”)保持平衡。
②B瓶重新放回到天平上,天平能否保持平衡? _________ ,理由是 _________ 。
③从原子的角度分析“质量守恒定律” _________________________________ 。
(2)如上图C所示,用细线系住镁条使之平衡,然后在镁条一端用酒精灯加热。镁条在加热的条件下,能与空气中的氧气反应生成氧化镁。
①写出镁在空气中加热的文字表达式 _________________________________ 。
②加热一段时间后,镁条 ________________ (填“能”或“不能”)保持平衡。
(3)某同学利用如图所示的装置测定空气中氧气的含量(体积分数)。他的操作过程如下(有100mL和500mL量筒供选用):
①检查整个装置的气密性后,将c处的止水夹夹紧,点燃红磷后,迅速插入左边的广口瓶中;
②待燃烧停止,整个装 置冷却至室温后,将c处的止水夹打开。结果发现烧杯中的水进入到广口瓶中;
③待烧杯中的水不能再进入广口瓶后,打开广口瓶的橡胶塞,将广口瓶中的水全部倒入到100mL量筒中,测得其中水的体积为76ml。
④该同学又设法准确地测定了广口瓶中空气的体积,数据为400mL。
回答下列问题:①红磷燃烧时最明显的现象是 ___________________________ ;
②该同学测得的空气中氧气的体积分数为 ________ %。与理论值21%相比较,产生误差的原因很可能是 _____________________ (导气管的体积可忽略不计)。
五、计算题
22.实验室有一瓶含杂质的氯酸钾17.5g。某兴趣小组利用该药品和二氧化锰制取氧气,收集到氧气4.8g。请计算受热分解的氯酸钾的质量分数。
23.黄铜是铜和锌的合金,某化学兴趣小组的同学们在测定黄铜中铜的含量时,取黄铜样品40g,放入烧杯中,向其中加入200g稀硫酸,恰好完全反应,反应后烧杯中剩余物的总质量为239.6g。请计算:
(1)产生氢气的质量_____;
(2)黄铜中铜的质量分数。
参考答案
1.A 2.C 3.C 4.A 5.D 6.B 7.B 8.C 9.C 10.B 11.D 12.D 13.C 14.C 15.B
16.D A C B CH4 甲 H2O
17.CaCO3falseCaO+CO2↑ CaO + H2O = Ca(OH)2 CO2 +Ca(OH)2 = CaCO3↓+ H2O
18.② ② ① ②
19.碳酸氢铵false氨气+水+二氧化碳或NH4HCO3falseNH3+H2O+CO2 碳酸钙+稀盐酸→氯化钙+水+二氧化碳或CaCO3+HCl→CaCl2+H2O+CO2 碱式碳酸铜false氧化铜+水+二氧化碳或Cu2(OH)2CO3falseCuO+H2O+CO2 镁+氧气false氧化镁或Mg+O2falseMgO
20.CO CuO Cu CO2 CaCO3 CuO+COfalseCu+CO2 CaCO3falseCaO+CO2↑ 分解反应 CO2+Cfalse2CO
21.能 不能 过氧化氢在二氧化锰的催化作用下生成氧气,气体从锥形瓶中逸出,使锥形瓶中质量减小 化学反应中原子的种类、数目、质量都没有改变,所以反应前后的质量总相等 镁+氧气氧化镁 不能 产生大量白烟 19% 红磷的量不足
22.70%
23.(1)0.4g;(2)67.5%
一、单选题
1.2019年5月12日是我国第11个全国防灾减灾日,主题是“提高灾害防治能力,构筑生命安全防线”。下列做法中,符合安全要求的是
A.化工厂厂区严禁烟火 B.在加油站里接打电话
C.危险药品随意放置 D.占用消防通道停车
2.密闭容器中飘浮的下列物质,遇明火不可能发生爆炸的是( )
A.棉絮 B.面粉 C.沙尘 D.炭粉
3.逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.氢气爆炸、火药爆炸都有新物质生成,因此爆炸都是化学变化
B.氧化物中含有氧元素,则含有氧元素的化合物一定是氧化物
C.蜡烛燃烧生成CO2和H2O,则蜡烛里一定含有碳元素和氢元素
D.分子是保持物质化学性质的最小粒子,因此分子不可再分
4.黑火药的主要成分是硝酸钾、木炭粉、硫磺粉等,点燃时发生爆炸的化学方程式为:S+2KNO3+3CfalseK2S+3CO2↑+X↑,其中X的化学式是
A.N2 B.NO2 C.NO D.N2O
5.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如下图所示:下列说法不正确的是
A.乙可能是单质
B.丁可能是反应的催化剂
C.该反应是化合反应
D.甲和乙的质量之和一定等于生成丙的质量
6.如图所示,将白磷和红磷分装于Y形试管的2个支管中,管口系牢小气球,将2个支管同时伸入相同深度的热水中。下列说法不正确的是
A.b、c两处均不燃烧
B.红磷不燃是因为没有接触氧气
C.此实验能验证燃烧所需的条件
D.管口小气球可防止生成产物污染环境
7.对下列现象和事实,对应的解释不正确的是( )
选项
现象和事实
解释
A
用活性炭去除冰箱异味
此过程只发生物理变化
B
燃着的火柴一吹即灭
冷空气降低了火柴的着火点
C
二氧化碳可用于人工降雨
干冰升华吸热
D
蒸馏自来水制取蒸馏水时,加入几粒沸石
目的是防止暴沸
A.A B.B C.C D.D
8.下列操作可以鉴别空气,氧气和一氧化碳三瓶气体的是
A.观察气体的颜色 B.闻气体的气味
C.插入燃着的木条 D.倒入澄清的石灰水
9.我国科学家研制出高效催化剂,可使水煤气在120℃下制备氢气,其微观示意图如。下列说法正确的是
A.这种高效催化剂能提高生成物的产量
B.该反应属于置换反应
C.反应前后原子种类不变
D.该反应涉及四种氧化物
10.下列有关碳和碳的化合物的说法,不正确的是
A.金刚石是天然存在的最硬的物质
B.CO2、CO的组成元素相同,化学性质也相同
C.CO极易与血红蛋白结合,造成生物体内缺氧,严重时危及生命
D.金刚石、石墨物理性质有很大差异的原因是碳原子排列方式不同
11.在100g含碳酸钙90%的石灰石中,加入过量的稀盐酸(杂质不参加反应)。有关说法正确的是( )
A.参加反应的碳酸钙与生成的二氧化碳的质量比为1:1
B.盐酸过量越多,生成的二氧化碳也越多
C.参加反应的碳酸钙的物质的量为0.1mol
D.生成的氯化钙中,钙元素的质量为36g
12.地球大气的演化经历了原始大气、次生大气和现代大气三个阶段,次生大气中部分成分的微观示意图如下:
甲
乙
丙
一定条件下,3.4g甲物质和4.8g氧气恰好完全反应,生成5.4g乙物质和另一种物质X,下列判断不正确的是
A.物质甲的化学式是NH3
B.物质X的质量为2.8g
C.物质X的化学式是N2
D.该反应化学方程式中物质X与O2的化学计量数之比为3∶2
13.某气体由CH4、CO、H2中的一种或几种组成,取该气体样品在氧气中完全燃烧,测 得生成的CO2和H2O的质量比为11:9,下列判断正确的是( )
A.原气体可能是H2和 CH4 的混合物
B.原气体中一定含有CH4
C.原气体中若含有CO,则一定含有 H2
D.气体中若同时含有CH4、CO 和H2,则 CO与H2的质量之比为 14:1
14.下列说法不正确的是
A.家里因为电路短路而造成火灾,应该迅速拉下电闸,再取水扑灭
B.赤壁大战中,庞统献给曹操的铁索连环之计,使木船不能摆脱铁索的束缚,及时驶离着火区域,这属于逆向使用灭火原理的例子
C.木屋着火时,迅速浇水,不能隔绝可燃物与氧气接触,却能够提升其着火点而灭火
D.厨房的油锅着火时,用锅盖盖上去灭火比浇水灭火合理
15.在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物X。取一定质量的AgNO3固体充分光照,测得反应后生成Ag、O2、X的质量分别为10.8g、mg、4.6g。下列说法正确的是
A.AgNO3固体应密封保存在无色细口瓶中
B.m=1.6
C.X的化学式为NO
D.该反应方程式中Ag与O2的化学计量数之比为3:2
二、填空题
16.(1)现有A.钛合金B.稀有气体C.氢氧化钙D氯化钠四种物质,选择适当的物质填空(填字母)
①农业上用来选种的物质________。
②与人体具有很好相容性的金属材料______。
③可用来中和酸性土壤的物质______。
④可以发出不同颜色电光源的物质_______。
(2)煤、石油、天然气是不可再生的三大化石燃料。如今,天然气已成为城市家庭的主要生活燃料之一。天然气的主要成分是_______(填化学式)。为防止因天然气泄漏造成危险,可在家中安装报警器,在甲、乙两图中,安装位置正确的是_______。
(3)煤的气化是把煤变为清沽能源的重要环节之一,其中一个重要的反应是:false,其中X的化学式是____。
17.建筑材料中常用到下列反应。请写出有关的化学方程式。
(1)石灰石煅烧制得生石灰(CaO)和二氧化碳________________________________;
(2)用生石灰与水反应制石灰浆(氢氧化钙)_________________________________;
(3)用石灰浆刷墙壁,墙上附着一层白色坚硬的物质____________________________。
18.下列各实验均给出两步主要操作,请将需要先进行的操作的序号填在空白处。
(1)检查装置气密性:__________。①用手捂住容器外壁 ②将导管插入水中
(2)用托盘天平称取5g食盐:____。①向天平左盘中加入食盐②在天平右盘放5g砝码
(3)高锰酸钾制取氧气____。①将导管撤离水面 ②停止加热
(4)一氧化碳还原氧化铜:___________。 ①加热 ②通CO
19.写出下列反应的文字表达式或符号表达式(下同)。
(1)碳酸氢铵加热______。
(2)实验室制取二氧化碳______。
(3)加热碱式碳酸铜______。
(4)镁条燃烧______。
三、推断题
20.已知A﹣E都是初中化学中的常见物质,其中A和D是无色无味气体,B是黑色粉末,C是红色固体,它们的转化关系如图所示(部分反应的反应条件或生成物已省略)。
(1)写出各物质的化学式:A._____B._____C._____D._____E._____。
(2)写出反应①的化学方程式:_____;若反应③的反应条件是高温,请写出反应③的化学方程式:_____,属于_____反应(填基本反应类型)。
(3)D转化为A的化学方程式:_____。
四、实验题
21.在“质量守恒定律”的教学中,老师引导同学们进行“化学反应中反应物与生成物的质量关系”的实验探究,请你参与探究并回答有关问题:
(1)如图A、B所示,将锥形瓶(反应物未接触)放在天平上,右盘加砝码使之平衡,取下锥形瓶,将锥形瓶中两种物质混合,反应完全后将锥形瓶再放回天平左盘上。
①A瓶重新放回到天平上,天平 _______ (填“能”或“不能”)保持平衡。
②B瓶重新放回到天平上,天平能否保持平衡? _________ ,理由是 _________ 。
③从原子的角度分析“质量守恒定律” _________________________________ 。
(2)如上图C所示,用细线系住镁条使之平衡,然后在镁条一端用酒精灯加热。镁条在加热的条件下,能与空气中的氧气反应生成氧化镁。
①写出镁在空气中加热的文字表达式 _________________________________ 。
②加热一段时间后,镁条 ________________ (填“能”或“不能”)保持平衡。
(3)某同学利用如图所示的装置测定空气中氧气的含量(体积分数)。他的操作过程如下(有100mL和500mL量筒供选用):
①检查整个装置的气密性后,将c处的止水夹夹紧,点燃红磷后,迅速插入左边的广口瓶中;
②待燃烧停止,整个装 置冷却至室温后,将c处的止水夹打开。结果发现烧杯中的水进入到广口瓶中;
③待烧杯中的水不能再进入广口瓶后,打开广口瓶的橡胶塞,将广口瓶中的水全部倒入到100mL量筒中,测得其中水的体积为76ml。
④该同学又设法准确地测定了广口瓶中空气的体积,数据为400mL。
回答下列问题:①红磷燃烧时最明显的现象是 ___________________________ ;
②该同学测得的空气中氧气的体积分数为 ________ %。与理论值21%相比较,产生误差的原因很可能是 _____________________ (导气管的体积可忽略不计)。
五、计算题
22.实验室有一瓶含杂质的氯酸钾17.5g。某兴趣小组利用该药品和二氧化锰制取氧气,收集到氧气4.8g。请计算受热分解的氯酸钾的质量分数。
23.黄铜是铜和锌的合金,某化学兴趣小组的同学们在测定黄铜中铜的含量时,取黄铜样品40g,放入烧杯中,向其中加入200g稀硫酸,恰好完全反应,反应后烧杯中剩余物的总质量为239.6g。请计算:
(1)产生氢气的质量_____;
(2)黄铜中铜的质量分数。
参考答案
1.A 2.C 3.C 4.A 5.D 6.B 7.B 8.C 9.C 10.B 11.D 12.D 13.C 14.C 15.B
16.D A C B CH4 甲 H2O
17.CaCO3falseCaO+CO2↑ CaO + H2O = Ca(OH)2 CO2 +Ca(OH)2 = CaCO3↓+ H2O
18.② ② ① ②
19.碳酸氢铵false氨气+水+二氧化碳或NH4HCO3falseNH3+H2O+CO2 碳酸钙+稀盐酸→氯化钙+水+二氧化碳或CaCO3+HCl→CaCl2+H2O+CO2 碱式碳酸铜false氧化铜+水+二氧化碳或Cu2(OH)2CO3falseCuO+H2O+CO2 镁+氧气false氧化镁或Mg+O2falseMgO
20.CO CuO Cu CO2 CaCO3 CuO+COfalseCu+CO2 CaCO3falseCaO+CO2↑ 分解反应 CO2+Cfalse2CO
21.能 不能 过氧化氢在二氧化锰的催化作用下生成氧气,气体从锥形瓶中逸出,使锥形瓶中质量减小 化学反应中原子的种类、数目、质量都没有改变,所以反应前后的质量总相等 镁+氧气氧化镁 不能 产生大量白烟 19% 红磷的量不足
22.70%
23.(1)0.4g;(2)67.5%
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
