江苏省2020-2021学年下学期高一5月百校联考化学试卷 (含答案)
文档属性
| 名称 | 江苏省2020-2021学年下学期高一5月百校联考化学试卷 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 291.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-25 08:37:29 | ||
图片预览

文档简介
江苏省百校联考高一年级月考卷
化 学 试 卷2021.05
考生注意:
1.本试卷分选择题和非选择题两部分,共100分。考试时间75分钟。
2.请将各题答案填写在答题卡上。
3.可能用到的相对原子质量:H 1 C 12 O 16 Ca 40
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
1.民以食为天,《黄帝内经》说:“五谷为养,五果为助,五畜为益,五菜为充”。下列说法正确的是
A.“五谷”富含淀粉,淀粉是天然高分子化合物
B.“五果”富含糖类,其中的葡萄糖、蔗糖都能发生水解反应
C.“五畜”富含油脂和蛋白质,它们的组成元素相同
D.“五菜”富含纤维素,纤维素不属于糖类物质
2.化学上常从“宏观、微观、符号”三重表征角度认识物质及其变化。一定条件下,容器中各微粒发生化学反应前后的变化如图所示,其中符号“、”代表不同元素的原子。
该化学反应的类型不一定是
A.分解反应 B.氧化还原反应 C.吸热反应 D.可逆反应
3.下列设备工作时,将化学能转化为热能的是
4.有机化合物是生命活动的物质基础,也是能源和材料开发的基础物质。下列说法正确的是
A.分馏石油可以得到植物油、柴油、润滑油
B.尼龙耐磨性高于棉花和羊毛,也是天然高分子材料
C.煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
D.不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物
阅读下列资料,完成5~8题:地球上的氮元素对动植物有重要作用,其中氨是无色气体、有强烈的刺激气味,易被液化成无色的液体。具有还原性,用于制液氮、硝酸。铵盐是由氨与酸作用得到的,氨和铵盐的制取和性质及应用一直是研究的热点。
5.氨和铵盐在生产、生活中有广泛应用。下列物质的性质与用途不具有对应关系的是
A.氨易液化,可用来做制冷剂
B.氯化铵易溶于水,可用来制取氨气
C.碳酸氢铵易分解,可用来做食品膨松剂
D.磷酸氢铵含有N、P两种元素,可用来做复合化肥
6.研究表明,大气中的氨是雾霾的促进剂,雾霾中含有的硝酸铵和硫酸铵都与氨相关,为减少氨排放,下列解决方案不可行的是
A.改变自然界氮循环途径,使其不产生氨 B.加强对含氨废水的处理,降低氨气排放
C.采用氨法对烟气脱硝时,设置除氨设备 D.增加使用生物有机肥料,减少使用化肥
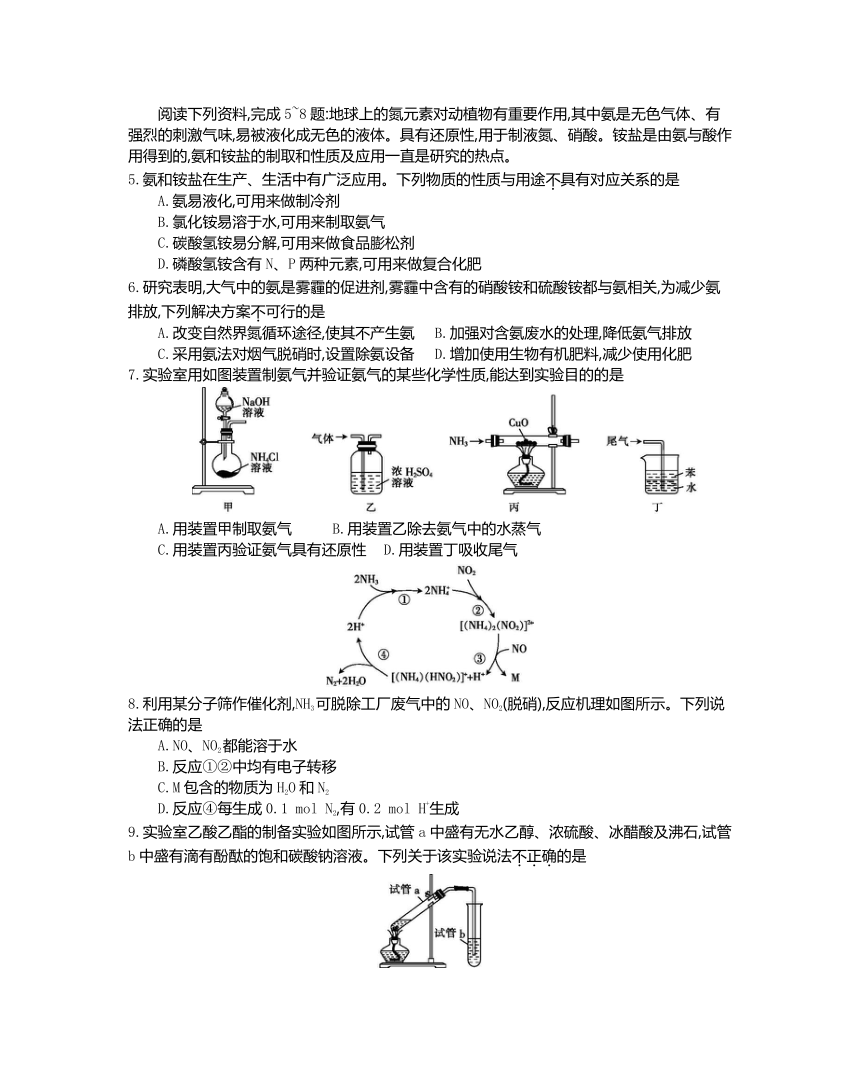
7.实验室用如图装置制氨气并验证氨气的某些化学性质,能达到实验目的的是
A.用装置甲制取氨气 B.用装置乙除去氨气中的水蒸气
C.用装置丙验证氨气具有还原性 D.用装置丁吸收尾气
8.利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2(脱硝),反应机理如图所示。下列说法正确的是
A.NO、NO2都能溶于水
B.反应①②中均有电子转移
C.M包含的物质为H2O和N2
D.反应④每生成0.1 mol N2,有0.2 mol H+生成
9.实验室乙酸乙酯的制备实验如图所示,试管a中盛有无水乙醇、浓硫酸、冰醋酸及沸石,试管b中盛有滴有酚酞的饱和碳酸钠溶液。下列关于该实验说法不正确的是
A.试管a中放入沸石的目的是防止加热时液体暴沸
B.导管不伸入试管b中液面以下,其目的是防止倒吸
C.试管b中溶液红色变浅,是因为碳酸钠与乙醇发生反应
D.用分液漏斗分离试管b中液体时,应先放出水相后再从分液漏斗上口倒出乙酸乙酯
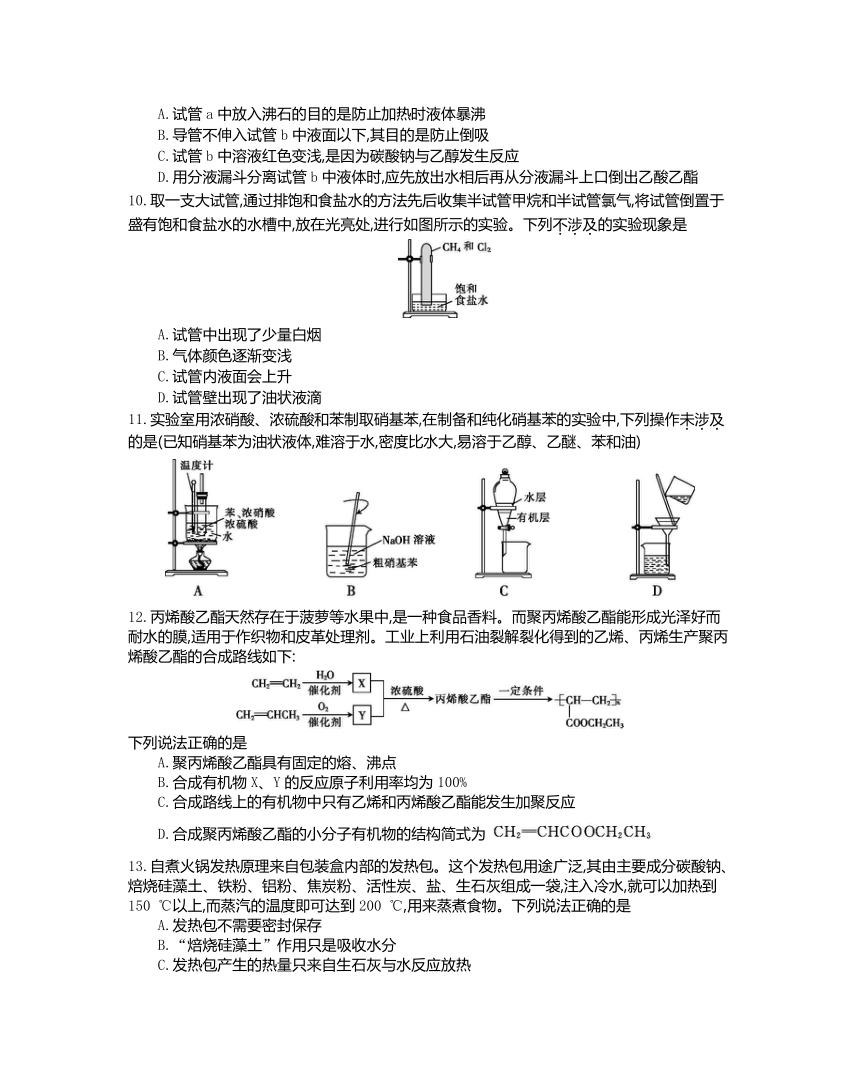
10.取一支大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,将试管倒置于盛有饱和食盐水的水槽中,放在光亮处,进行如图所示的实验。下列不涉及的实验现象是
A.试管中出现了少量白烟
B.气体颜色逐渐变浅
C.试管内液面会上升
D.试管壁出现了油状液滴
11.实验室用浓硝酸、浓硫酸和苯制取硝基苯,在制备和纯化硝基苯的实验中,下列操作未涉及的是(已知硝基苯为油状液体,难溶于水,密度比水大,易溶于乙醇、乙醚、苯和油)
12.丙烯酸乙酯天然存在于菠萝等水果中,是一种食品香料。而聚丙烯酸乙酯能形成光泽好而耐水的膜,适用于作织物和皮革处理剂。工业上利用石油裂解裂化得到的乙烯、丙烯生产聚丙烯酸乙酯的合成路线如下:
下列说法正确的是
A.聚丙烯酸乙酯具有固定的熔、沸点
B.合成有机物X、Y的反应原子利用率均为100%
C.合成路线上的有机物中只有乙烯和丙烯酸乙酯能发生加聚反应
D.合成聚丙烯酸乙酯的小分子有机物的结构简式为
13.自煮火锅发热原理来自包装盒内部的发热包。这个发热包用途广泛,其由主要成分碳酸钠、焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰组成一袋,注入冷水,就可以加热到150 ℃以上,而蒸汽的温度即可达到200 ℃,用来蒸煮食物。下列说法正确的是
A.发热包不需要密封保存
B.“焙烧硅藻土”作用只是吸收水分
C.发热包产生的热量只来自生石灰与水反应放热
D.铁粉、焦炭粉、盐及水等构成原电池,加快铁被氧化速率
14.在一密闭容器中加入X、Y、Z三种气体,保持一定温度,在t1~t4测得各物质的浓度如表所示。下列结论正确的是
测定时刻/s
t1
t2
t3
t4
c(X)/mol·L-1
6
3
2
2
c(Y)/mol·L-1
5
3.5
3
3
c(Z)/mol·L-1
1
2.5
3
3
A.t3 s时反应已经完全停止
B.在容器中发生的反应为2X+YZ
C.t4 s时正、逆反应速率不相等
D.t2~t3 s内X的平均反应速率为2t3-t2 mol·L-1·s-1
二、非选择题:共4小题,共58分。
15.(14分)自然界的许多动植物中含有有机酸,例如,蚂蚁体内含有蚁酸(甲酸),菠菜中含有草酸(乙二酸),柑橘中能提取柠檬酸。
(1)甲酸(HCOOH)与乙酸互称为 ▲ 。?
(2)工业上用乙烯合成乙二酸(HOOC—COOH)流程如下:
①反应类型:AB为 ▲ ,BC为 ▲ 。?
②X为 ▲ (化学式),D为 ▲ (结构简式)。?
(3)与乙酸相似,柠檬酸()的酸性比碳酸的强,能与碳酸钠溶液反应放出CO2气体,其反应方程式为 ▲ 。?
16.(14分)以淀粉为原料在一定条件制取系列有机物的转化关系如图所示:
(1)A的结构简式为 ▲ 。?
(2)C分子中的官能团为 ▲ 。?
(3)乳酸B转化生成D的化学方程式为 ▲ 。?
(4)能说明淀粉完全水解生成葡萄糖的实验现象是 ▲ 。?
(5)设计检验糖尿病人尿液中含有葡萄糖的实验方案: ▲ 。(实验中须使用的试剂有2%CuSO4溶液、10%NaOH溶液)?
17.(14分)硝酸是强酸之一,且是一种重要的化工原料,同时硝酸的形成也是氮循环的一环。某实验小组用如下实验装置模拟工业上制取硝酸:
(1)提供氧气,要使装置B中充满反应物的操作是 ▲ 。?
(2)写出装置B中发生反应的化学方程式: ▲ 。?
(3)装置C的作用是 ▲ 。?
(4)装置F中发生的主要反应:NO+NO2+2NaOH2NaNO2+H2O;2NO2+2NaOHNaNO2+NaNO3+H2O。实验后装置F中NaNO2和NaNO3物质的量浓度较大的是 ▲ 。?
(5)现有硝酸和Cu粉,请设计制备Cu(NO3)2溶液的最佳方案: ▲ 。?
18.(16分)葡萄糖酸钙[(C6H11O7)2Ca]是吸收效果好的营养强化剂,常温下易溶于沸水,几乎不溶于乙醇。一种制备葡萄糖酸钙的实验流程如下:
(1)已知葡萄糖分子的结构简式为CH2OH(CHOH)4CHO,则葡萄糖酸分子的结构简式为 ▲ 。?
(2)制取葡萄糖酸选择的最佳加热方式是 ▲ 。随反应温度的升高,葡萄糖转化率也随之升高,但反应温度高于60 ℃时,葡萄糖转化率逐渐减小,葡萄糖转化率减小的可能原因是 ▲ 。?
(3)判断葡萄糖酸反应完全的标志是 ▲ 。?
(4)葡萄糖酸钙结晶时需要加入乙醇,其目的是 ▲ 。?
(5)称取制得的产品0.600 g置于烧杯中,加入蒸馏水溶解;加入足量草酸铵[(NH4)2C2O4]溶液,用氨水调节pH为4~5,生成白色沉淀,过滤、洗涤;将洗涤后所得的固体溶于稀硫酸中,用0.02000 mol·L-1 KMnO4标准溶液滴定,消耗KMnO4标准溶液25.00 mL。根据以上实验数据,测得产品中葡萄糖酸钙晶体的纯度为 ▲ 。(5H2C2O4+2MnO4-+6H+2Mn2++10CO2↑+8H2O,写出计算过程)?
化学试卷参考答案
1.A 2.C 3.B 4.D 5.B 6.A 7.C 8.C 9.C 10.A 11.D 12.D 13.D 14.B
15.(14分)
(1)同系物(2分)
(2)①加成反应(2分);取代反应(2分)
②Br2(2分);OHC—CHO(3分)
(3)+3Na2CO3+3CO2↑+3H2O(3分)
16.(14分)
(1)CH3CH2OH(2分)
(2)羟基、酯基(2分)
(3)CH3COOH+CH3CH(OH)COOHCH3COOCH(CH3)COOH+H2O(3分)
(4)水解液中滴加碘水,不出现蓝色(3分)
(5)在试管中加入适量的10%NaOH溶液,滴入几滴2%CuSO4溶液,振荡后加入适量尿液,加热(煮沸),若有砖红色沉淀产生,说明尿液中含有葡萄糖(4分)
17.(14分)
(1)从a处鼓入氧气,同时将氨气带入装置B中(3分)
(2)4NH3+5O24NO+6H2O(3分)
(3)吸收多余的氨气(2分)
(4)NaNO2(3分)
(5)将红色Cu粉置于坩埚中加热至变成黑色氧化铜,再滴加稀硝酸至黑色固体完全溶解(3分)
18.(16分)
(1)CH2OH(CHOH)4COOH(2分)
(2)水浴加热(2分);温度高于60 ℃,H2O2发生分解,氧化能力减弱(3分)
(3)加入CaCO3悬浊液后不再产生气体(3分)
(4)降低葡萄糖酸钙的溶解度,便于形成晶体析出(3分)
(5)n(MnO4-)=0.0200 mol·L-1×25.00 mL×10-3 L·mL-1=5.0×10-4 mol,由于5[(C6H11O7)2Ca]~5CaC2O4~5H2C2O4~2MnO4-,n[(C6H11O7)2Ca]=52n(MnO4-)=52×5.0×10-4 mol=1.250×10-3 mol,产品中葡萄糖酸钙晶体的纯度为1.250×10-3mol×430g·mol-10.600g=0.8958(3分)
化 学 试 卷2021.05
考生注意:
1.本试卷分选择题和非选择题两部分,共100分。考试时间75分钟。
2.请将各题答案填写在答题卡上。
3.可能用到的相对原子质量:H 1 C 12 O 16 Ca 40
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
1.民以食为天,《黄帝内经》说:“五谷为养,五果为助,五畜为益,五菜为充”。下列说法正确的是
A.“五谷”富含淀粉,淀粉是天然高分子化合物
B.“五果”富含糖类,其中的葡萄糖、蔗糖都能发生水解反应
C.“五畜”富含油脂和蛋白质,它们的组成元素相同
D.“五菜”富含纤维素,纤维素不属于糖类物质
2.化学上常从“宏观、微观、符号”三重表征角度认识物质及其变化。一定条件下,容器中各微粒发生化学反应前后的变化如图所示,其中符号“、”代表不同元素的原子。
该化学反应的类型不一定是
A.分解反应 B.氧化还原反应 C.吸热反应 D.可逆反应
3.下列设备工作时,将化学能转化为热能的是
4.有机化合物是生命活动的物质基础,也是能源和材料开发的基础物质。下列说法正确的是
A.分馏石油可以得到植物油、柴油、润滑油
B.尼龙耐磨性高于棉花和羊毛,也是天然高分子材料
C.煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
D.不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物
阅读下列资料,完成5~8题:地球上的氮元素对动植物有重要作用,其中氨是无色气体、有强烈的刺激气味,易被液化成无色的液体。具有还原性,用于制液氮、硝酸。铵盐是由氨与酸作用得到的,氨和铵盐的制取和性质及应用一直是研究的热点。
5.氨和铵盐在生产、生活中有广泛应用。下列物质的性质与用途不具有对应关系的是
A.氨易液化,可用来做制冷剂
B.氯化铵易溶于水,可用来制取氨气
C.碳酸氢铵易分解,可用来做食品膨松剂
D.磷酸氢铵含有N、P两种元素,可用来做复合化肥
6.研究表明,大气中的氨是雾霾的促进剂,雾霾中含有的硝酸铵和硫酸铵都与氨相关,为减少氨排放,下列解决方案不可行的是
A.改变自然界氮循环途径,使其不产生氨 B.加强对含氨废水的处理,降低氨气排放
C.采用氨法对烟气脱硝时,设置除氨设备 D.增加使用生物有机肥料,减少使用化肥
7.实验室用如图装置制氨气并验证氨气的某些化学性质,能达到实验目的的是
A.用装置甲制取氨气 B.用装置乙除去氨气中的水蒸气
C.用装置丙验证氨气具有还原性 D.用装置丁吸收尾气
8.利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2(脱硝),反应机理如图所示。下列说法正确的是
A.NO、NO2都能溶于水
B.反应①②中均有电子转移
C.M包含的物质为H2O和N2
D.反应④每生成0.1 mol N2,有0.2 mol H+生成
9.实验室乙酸乙酯的制备实验如图所示,试管a中盛有无水乙醇、浓硫酸、冰醋酸及沸石,试管b中盛有滴有酚酞的饱和碳酸钠溶液。下列关于该实验说法不正确的是
A.试管a中放入沸石的目的是防止加热时液体暴沸
B.导管不伸入试管b中液面以下,其目的是防止倒吸
C.试管b中溶液红色变浅,是因为碳酸钠与乙醇发生反应
D.用分液漏斗分离试管b中液体时,应先放出水相后再从分液漏斗上口倒出乙酸乙酯
10.取一支大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,将试管倒置于盛有饱和食盐水的水槽中,放在光亮处,进行如图所示的实验。下列不涉及的实验现象是
A.试管中出现了少量白烟
B.气体颜色逐渐变浅
C.试管内液面会上升
D.试管壁出现了油状液滴
11.实验室用浓硝酸、浓硫酸和苯制取硝基苯,在制备和纯化硝基苯的实验中,下列操作未涉及的是(已知硝基苯为油状液体,难溶于水,密度比水大,易溶于乙醇、乙醚、苯和油)
12.丙烯酸乙酯天然存在于菠萝等水果中,是一种食品香料。而聚丙烯酸乙酯能形成光泽好而耐水的膜,适用于作织物和皮革处理剂。工业上利用石油裂解裂化得到的乙烯、丙烯生产聚丙烯酸乙酯的合成路线如下:
下列说法正确的是
A.聚丙烯酸乙酯具有固定的熔、沸点
B.合成有机物X、Y的反应原子利用率均为100%
C.合成路线上的有机物中只有乙烯和丙烯酸乙酯能发生加聚反应
D.合成聚丙烯酸乙酯的小分子有机物的结构简式为
13.自煮火锅发热原理来自包装盒内部的发热包。这个发热包用途广泛,其由主要成分碳酸钠、焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰组成一袋,注入冷水,就可以加热到150 ℃以上,而蒸汽的温度即可达到200 ℃,用来蒸煮食物。下列说法正确的是
A.发热包不需要密封保存
B.“焙烧硅藻土”作用只是吸收水分
C.发热包产生的热量只来自生石灰与水反应放热
D.铁粉、焦炭粉、盐及水等构成原电池,加快铁被氧化速率
14.在一密闭容器中加入X、Y、Z三种气体,保持一定温度,在t1~t4测得各物质的浓度如表所示。下列结论正确的是
测定时刻/s
t1
t2
t3
t4
c(X)/mol·L-1
6
3
2
2
c(Y)/mol·L-1
5
3.5
3
3
c(Z)/mol·L-1
1
2.5
3
3
A.t3 s时反应已经完全停止
B.在容器中发生的反应为2X+YZ
C.t4 s时正、逆反应速率不相等
D.t2~t3 s内X的平均反应速率为2t3-t2 mol·L-1·s-1
二、非选择题:共4小题,共58分。
15.(14分)自然界的许多动植物中含有有机酸,例如,蚂蚁体内含有蚁酸(甲酸),菠菜中含有草酸(乙二酸),柑橘中能提取柠檬酸。
(1)甲酸(HCOOH)与乙酸互称为 ▲ 。?
(2)工业上用乙烯合成乙二酸(HOOC—COOH)流程如下:
①反应类型:AB为 ▲ ,BC为 ▲ 。?
②X为 ▲ (化学式),D为 ▲ (结构简式)。?
(3)与乙酸相似,柠檬酸()的酸性比碳酸的强,能与碳酸钠溶液反应放出CO2气体,其反应方程式为 ▲ 。?
16.(14分)以淀粉为原料在一定条件制取系列有机物的转化关系如图所示:
(1)A的结构简式为 ▲ 。?
(2)C分子中的官能团为 ▲ 。?
(3)乳酸B转化生成D的化学方程式为 ▲ 。?
(4)能说明淀粉完全水解生成葡萄糖的实验现象是 ▲ 。?
(5)设计检验糖尿病人尿液中含有葡萄糖的实验方案: ▲ 。(实验中须使用的试剂有2%CuSO4溶液、10%NaOH溶液)?
17.(14分)硝酸是强酸之一,且是一种重要的化工原料,同时硝酸的形成也是氮循环的一环。某实验小组用如下实验装置模拟工业上制取硝酸:
(1)提供氧气,要使装置B中充满反应物的操作是 ▲ 。?
(2)写出装置B中发生反应的化学方程式: ▲ 。?
(3)装置C的作用是 ▲ 。?
(4)装置F中发生的主要反应:NO+NO2+2NaOH2NaNO2+H2O;2NO2+2NaOHNaNO2+NaNO3+H2O。实验后装置F中NaNO2和NaNO3物质的量浓度较大的是 ▲ 。?
(5)现有硝酸和Cu粉,请设计制备Cu(NO3)2溶液的最佳方案: ▲ 。?
18.(16分)葡萄糖酸钙[(C6H11O7)2Ca]是吸收效果好的营养强化剂,常温下易溶于沸水,几乎不溶于乙醇。一种制备葡萄糖酸钙的实验流程如下:
(1)已知葡萄糖分子的结构简式为CH2OH(CHOH)4CHO,则葡萄糖酸分子的结构简式为 ▲ 。?
(2)制取葡萄糖酸选择的最佳加热方式是 ▲ 。随反应温度的升高,葡萄糖转化率也随之升高,但反应温度高于60 ℃时,葡萄糖转化率逐渐减小,葡萄糖转化率减小的可能原因是 ▲ 。?
(3)判断葡萄糖酸反应完全的标志是 ▲ 。?
(4)葡萄糖酸钙结晶时需要加入乙醇,其目的是 ▲ 。?
(5)称取制得的产品0.600 g置于烧杯中,加入蒸馏水溶解;加入足量草酸铵[(NH4)2C2O4]溶液,用氨水调节pH为4~5,生成白色沉淀,过滤、洗涤;将洗涤后所得的固体溶于稀硫酸中,用0.02000 mol·L-1 KMnO4标准溶液滴定,消耗KMnO4标准溶液25.00 mL。根据以上实验数据,测得产品中葡萄糖酸钙晶体的纯度为 ▲ 。(5H2C2O4+2MnO4-+6H+2Mn2++10CO2↑+8H2O,写出计算过程)?
化学试卷参考答案
1.A 2.C 3.B 4.D 5.B 6.A 7.C 8.C 9.C 10.A 11.D 12.D 13.D 14.B
15.(14分)
(1)同系物(2分)
(2)①加成反应(2分);取代反应(2分)
②Br2(2分);OHC—CHO(3分)
(3)+3Na2CO3+3CO2↑+3H2O(3分)
16.(14分)
(1)CH3CH2OH(2分)
(2)羟基、酯基(2分)
(3)CH3COOH+CH3CH(OH)COOHCH3COOCH(CH3)COOH+H2O(3分)
(4)水解液中滴加碘水,不出现蓝色(3分)
(5)在试管中加入适量的10%NaOH溶液,滴入几滴2%CuSO4溶液,振荡后加入适量尿液,加热(煮沸),若有砖红色沉淀产生,说明尿液中含有葡萄糖(4分)
17.(14分)
(1)从a处鼓入氧气,同时将氨气带入装置B中(3分)
(2)4NH3+5O24NO+6H2O(3分)
(3)吸收多余的氨气(2分)
(4)NaNO2(3分)
(5)将红色Cu粉置于坩埚中加热至变成黑色氧化铜,再滴加稀硝酸至黑色固体完全溶解(3分)
18.(16分)
(1)CH2OH(CHOH)4COOH(2分)
(2)水浴加热(2分);温度高于60 ℃,H2O2发生分解,氧化能力减弱(3分)
(3)加入CaCO3悬浊液后不再产生气体(3分)
(4)降低葡萄糖酸钙的溶解度,便于形成晶体析出(3分)
(5)n(MnO4-)=0.0200 mol·L-1×25.00 mL×10-3 L·mL-1=5.0×10-4 mol,由于5[(C6H11O7)2Ca]~5CaC2O4~5H2C2O4~2MnO4-,n[(C6H11O7)2Ca]=52n(MnO4-)=52×5.0×10-4 mol=1.250×10-3 mol,产品中葡萄糖酸钙晶体的纯度为1.250×10-3mol×430g·mol-10.600g=0.8958(3分)
同课章节目录
