南京市2012届高三化学考前复习资料-元素化合物流程题(第16题)
文档属性
| 名称 | 南京市2012届高三化学考前复习资料-元素化合物流程题(第16题) |  | |
| 格式 | zip | ||
| 文件大小 | 622.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-21 21:32:17 | ||
图片预览


文档简介
2012届高三化学考前复习资料(T16)
《元素化合物流程题》
【知识与方法归纳】
新课改后的高考题非常重视与生产、生活的密切联系,其中与化工生产实际相联系的元素化合物流程题(化学工艺流程题)已逐渐成为近年来高考试题的新亮点。
一、题型特点
命题背景源于教材中的化学工业知识、实际化工物质生产流程和最新的科技及环境保护等知识素材,注重考查学生化学实验基本操作能力、综合运用知识解决实际问题的能力和获取信息及加工信息的能力,具有信息量大、情境陌生、选材新颖、综合性强等特点。
试题通常在题干中给出化工生产流程图(有时增加图表数据信息),以填空题的形式呈现,考查内容涉及工业技术、实验技术、元素及化合物知识及基本反应规律、化学反应原理、反应条件的控制(温度、pH、投料比)、能量、绿色化工等方面。
二、解题策略与方法归纳
1、学会识别流程图
流程图中箭头进入的是反应物(投料),箭头出去的是生成物(产物、副产物),返回的箭头一般是“循环利用”的物质。
工业生产流程主线与核心的分析如下图:
2、善于利用题给信息和运用化学原理思考以下问题:
①生产过程的目的、作用,设计的原理;②化学反应条件控制的原理;③实验基本操作(物质的分离操作、除杂试剂的选择、生产条件的控制等);④资源的回收和利用;⑤绿色化学原理与环境保护等。
3、带着问题精心研究工艺流程的目的和过程,明确所需解答的问题,不纠缠于无关步骤,作答时要注意化学用语(化学式、化学方程式、离子方程式)的准确表达,文字表达要精准、到位。
4、熟悉工业流程中常见的操作与名词
(1)原料的预处理
①溶解:对金属及其氧化物通常采用酸溶,如用硫酸、盐酸、硝酸等,有时也常用碱溶(如铝及氧化铝等物质)。
②研磨:增大反应物接触面积,以加快反应速率或使反应更充分。
③灼烧:如从海带中提取碘。
④煅烧:使物质高温下分解,或改变结构、使杂质高温氧化、分解等。如煅烧石灰石、高岭土。
(2)控制反应条件的方法
pH的控制:调节溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀。
加热的目的:加快反应速率或促进化学平衡的移动
降温的目的:防止某物质在高温下会分解,或为使平衡向需要的方向移动。
趁热过滤:防止某物质降温时会析出。
冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
利用有机溶剂(乙醇、乙醚等)洗涤:洗去晶体表面的杂质,降低晶体的溶解度,使晶体快速干燥。
(3)常见名词
浸出:固体加水(或酸)溶解得到离子;
浸出率:固体溶解后,离子在溶液中的含量的多少;
酸浸:在酸溶液中反应使可溶性金属离子进入溶液,不溶物通过过滤除去的溶解过程;
水浸:与水接触反应或溶解;
水洗:通常为除去水溶性杂质。
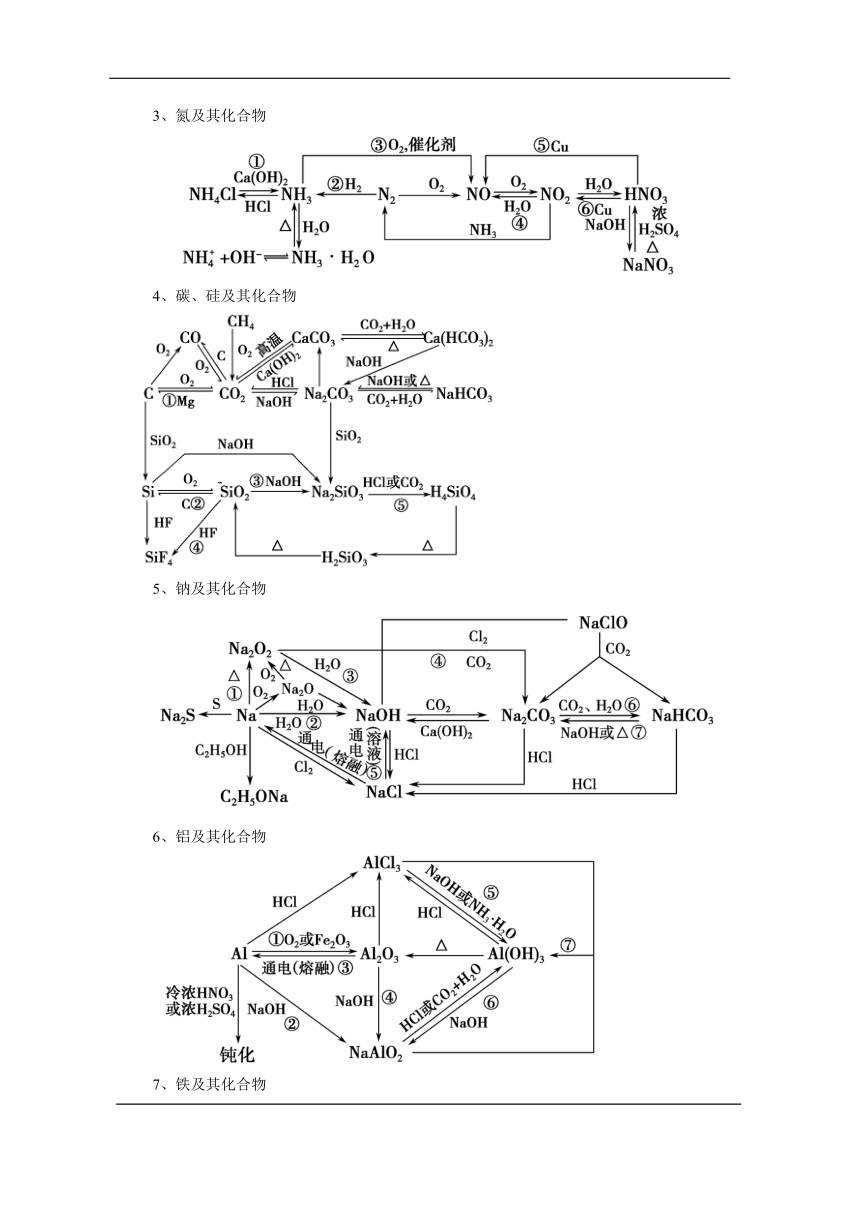
三、重要元素及其化合物的知识网络
1、氯及其化合物
2、硫及其化合物
3、氮及其化合物
4、碳、硅及其化合物
5、钠及其化合物
6、铝及其化合物
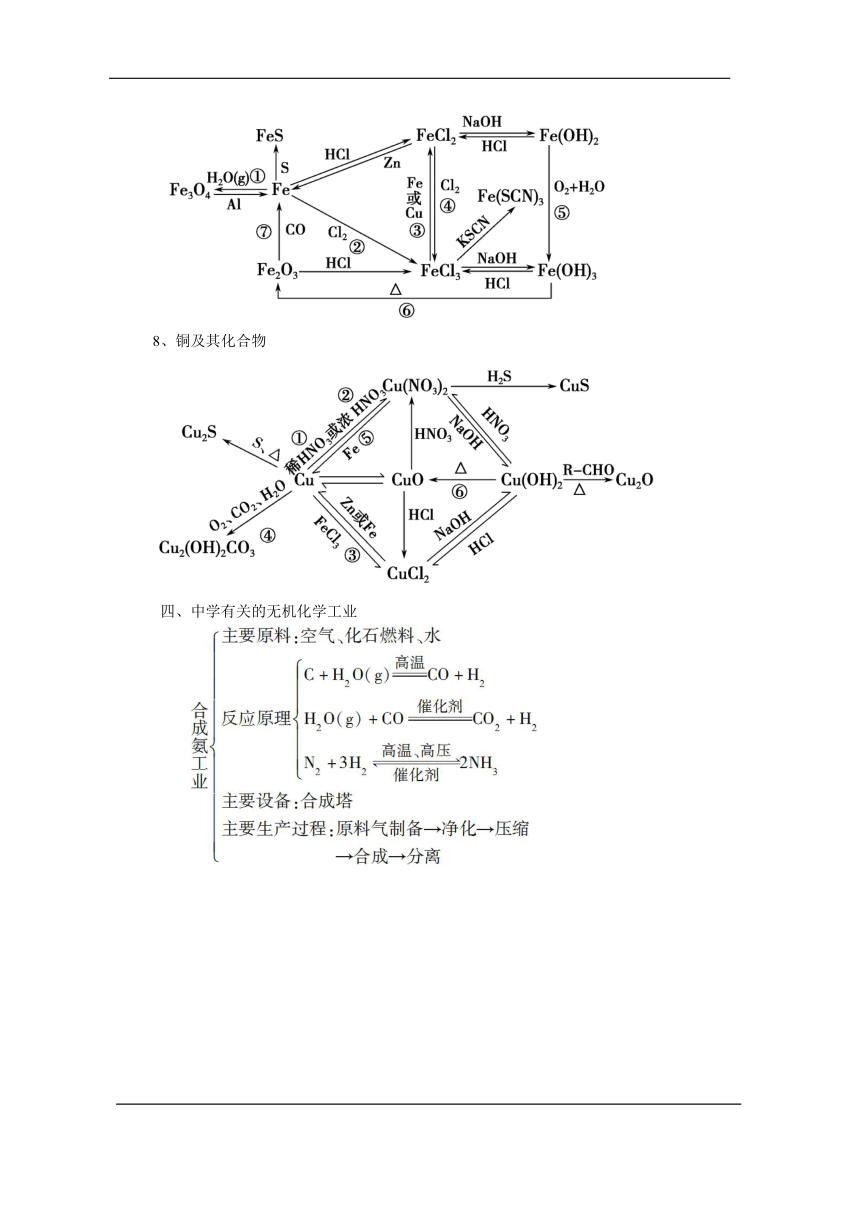
7、铁及其化合物
8、铜及其化合物
四、中学有关的无机化学工业
【真题模拟题训练】
1.(2011江苏高考)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为SO2(g)+O2(g)SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
【参考答案与解析】
解析:
本题以“硫铁矿(FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)”为背景,将Fe、S、Cl等元素及其化合物的性质、化学反应原理、生产或实验过程中的尾气成分的分析和处理等知识原理融合在实际生产工艺之中,考查学生对化学知识的灵活应用能力、思维的全面性和深刻性,以及应用元素化合物知识和化学反应原理解决实际问题的能力,体现化学学科的应用性和实践性,突出对新信息的处理能力的要求。
平衡常数的表达式为生成物浓度的化学计量数次方的乘积与反应物浓度的化学计量数次方乘积的比值,化学方程式中的固体和纯液体的浓度为常数,通常不计入表达式中;过量的SO2与NaOH溶液反应生成NaHSO3。酸溶时采用过量的盐酸可以提高铁元素的浸出率,后续操作中FeCl3溶液需经蒸发浓缩以获得FeCl3·6H2O晶体,而过量酸的存在可以抑制Fe3+水解。通Cl2可以将Fe2+氧化为Fe3+,尾气中含有过量的Cl2和由浓盐酸挥发出来的HCl气体,均会污染空气。
参考答案:
(1)k=c2(SO3)/c(O2)·c2(SO2) (2分) SO2+NaOH=NaHSO3 (2分)
(2)提高铁元素的浸出率 (2分) 抑制Fe3+水解 (2分)
(3)Cl2+2Fe2+=2Cl-+2Fe3+ (2分) Cl2 、HCl (2分)
【典型错误与矫正】
(1)k=c (SO3) 2/c(O2)·c (SO2) 2 〔注意幂次方的位置,应写为k=c2(SO3)/c(O2)·c2(SO2) 〕 SO2+2NaOH=Na2SO3+ H2O (错写成NaOH过量时的反应方程式)
SO2+OH—=HSO3— (错写成离子方程式)
(2)加快酸溶速率 (加过量酸是为了充分反应以提高铁元素的浸出率,酸浓度不变时对酸溶速率无影响)。
(后续操作要蒸发浓缩FeCl3溶液以获得FeCl3·6H2O晶体,过量酸可以抑制Fe3+水解。)
(3)Cl2+Fe2+=2Cl-+Fe3+ (配平错误)
Cl2+2FeCl2=2FeCl3(错写成化学方程式)
Cl2 (遗漏了盐酸挥发出来的“ HCl”气体)
2.(2012南京二模)以电石渣[主要成分是Ca(OH)2,含SiO2、Al2O3以及其它少量杂质]为原料生产氯酸钾联产碳酸钙的流程如下:
回答下列问题:
(1)电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:
_____________________________________、__________________________________。
(2)氯化过程的温度控制在75~80℃,该过程主要反应的化学方程式为:
________________________________________________________________________。
(3)该流程中加入活性炭的作用是_____________________________________________。
(4)该流程中碳化反应的离子方程式为_________________________________________。
(5)副产品A的化学式为________________。
【参考答案与解析】
解析;
本题以“电石渣为原料生成氯酸钾和碳酸钙的工艺流程”为背景设计问题,考查元素化合物知识、化学方程式及离子方程式的书写、控制反应条件如温度的目的、中间添加物的作用、产物的判断等知识。
电石渣溶于水后形成Ca(OH)2悬浊液可以与SiO2、Al2O3发生反应,反应原理同NaOH的反应相似,生成物为CaSiO3 、Ca(AlO2)2。氯化过程在温度较低时主要生成Ca(ClO)2,该流程控制温度在75~80℃时反应产物主要为Ca(ClO3)2,化学方程式为6Cl2 + 6Ca(OH)2 Ca(ClO3)2 + 5CaCl2 + 6H2O。活性炭具有很强的吸附性,可以吸附有毒、有异味的气体,在滤液中加入活性炭可以利用其吸附性除去过量的氯气,以防止后续实验中氯气逸出污染环境。流程中的碳化反应是向过滤所得溶液(溶质主要为CaCl2)中通入NH3 和CO2,反应生成CaCO3和副产品NH4Cl,其离子方程式为:Ca2+ + 2NH3 + CO2 + H2O = CaCO3↓ + 2NH4+。
参考答案:
(1)Ca(OH)2 + SiO2 = CaSiO3 + H2O (2分) Ca(OH)2 + Al2O3 = Ca(AlO2)2 + H2O(2分)
(2)6Cl2 + 6Ca(OH)2 Ca(ClO3)2 + 5CaCl2 + 6H2O(2分)
(3)吸附氯气,防止在后续实验中氯气逸出污染环境 (2分)
(4)Ca2+ + 2NH3 + CO2 + H2O = CaCO3↓ + 2NH4+(2分)
(5)NH4Cl(或其他合理答案)(2分)
【典型错误与矫正】
(1)CaC2 + 2H2O = Ca(OH)2 + H2C2↑ (由题干信息知电石渣中无CaC2 ,不发生此反应)
SiO2 + H2O = H2SiO3 (SiO2不能与 H2O反应)
3Ca(OH)2 + Al2O3 = 3CaO + 2Al(OH)3 (产物不合理,CaO在H2O中不存)
2Ca(OH)2 + Al2O3 = 2CaAlO2 + 2H2O 〔(Ca(AlO2)2的化学式书写错误)〕
(2)2Cl2 + 2Ca(OH)2 Ca(ClO)2 + CaCl2 + 2H2O 〔75~80℃时主要产物为Ca(ClO3)2〕
CaSiO3 + H2O + Cl2 = CaCl2 + H2SiO3 (产物不合理)
Ca(AlO2)2 + 6Cl2 + 2H2O = Ca(ClO3)2+ 2AlCl3+4HCl (产物不合理)
(3)吸附悬浊杂质;吸附其他杂质;吸附杂质H2SiO3 ; 除去CaSiO3;吸水;
(活性炭是为了吸附有毒的氯气,防止在后续实验中氯气逸出污染环境)
(4)(错写成化学方程式、缺少“↓”符号 )
(5) Al(OH)3 (依据“碳化”步骤的化学方程式可知为NH4Cl或其他合理答案)
3.(2012盐城二模)聚硅硫酸铁(PFSS)是新型无机高分子混凝剂,广泛应用于水的净化处理。PFSS化学组成可表示为:[Fe2(OH)n(SO4)3-n/2(SiO2)x]m,由钢渣合成PFSS主要工艺流程如下:
(1)酸浸时,采用100~140℃和2~3h,其目的是 。
(2)氧化时,需将溶液冷却到40℃以下,其目的是 。
开始沉淀pH 沉淀完全pH
Al3+ 3.5 4.7
Fe3+ 1.9 3.2
(3)除Al3+时,先调节pH值到 (参见右表),得Fe(OH)3沉淀,过滤除去滤液,再用硫酸溶解Fe(OH)3得硫酸铁溶液。
(4)Na2SiO3溶液可由SiO2渣除杂后与35%的NaOH溶液反应 制备,该反应的离子方程式为 。
(5)水解聚合时,强力搅拌的目的是 ;检验透明橙红色液体中,其分散质直径在l~l00nm的简单方法是 。
【参考答案与解析】
解析:
本题以“钢渣为原料合成PFSS的工艺流程”为背景设计问题,考查元素化合物知识与离子方程式的书写、反应条件(温度)控制的目的、反应条件(pH值)的选择、工艺操作的目的、胶体的性质与检验等知识。
用工业硫酸浸取钢渣采用较高的温度和较长的时间是为了提高浸取率;由于H2O2溶液受热易分解,所以在氧化时需将溶液冷却到40℃以下,以防止H2O2分解损失;由工艺流程可知调节pH值的目的是使溶液中Fe3+形成Fe(OH)3沉淀,铝元素仍以Al3+形式留在溶液中通过过滤而除去。根据图表中数据可确定pH值范围为3.2—3.5;SiO2与NaOH溶液反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;水解聚合时强力搅拌的目的是使反应物充分接触,分散质均匀分散;分散质直径在l~l00nm的透明橙红色液体属于胶体,可利用激光笔照射液体,通过观察是否产生丁达尔效应的简单方法加以检验。
参考答案:
(1)提高铁元素的浸取率(或“提高反应速率”、“加速完全溶解”等)。(2分)
(2)防止H2O2分解损失。(2分)
(3)3.2—3.5,(2分)
(4) SiO2+2OH-=SiO32-+H2O。(2分)
(5)使反应物充分接触,分散质均匀分散;(2分)用激光笔照射液体,观察是否有丁达尔效应。(2分)
【典型错误与矫正】
(1)保证FeO、Fe2O3 、Al2O3充分溶解。(酸浸时采用较高温度与较长时间的目的是加快反应速率和充分溶解,以提高铁元素的浸取率)
(2)提高氧化效率;保证氧化充分、彻底;(未理解真正原因,H2O2溶液受热易分解,为“防止H2O2分解损失”,氧化时需将溶液冷却到40℃以下。
(5) 加快反应速率;使反应更加充分;
(强力搅拌是为形成透明橙红色液体,使其分散质直径达到l~l00nm范围形成胶体,所以目的是“使反应物充分接触,分散质均匀分散”)
丁达尔效应 (“丁达尔效应”是胶体的性质,特定操作下产生的现象,答题时应说明操作的方法、发生的现象、得出的结论)
4.(2012 苏锡常镇一模)锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在一定条件下反应生成Li2SO4(以及MgSO4、硅铝化合物等物质),进而制备金属锂,其生产流程如下:
(1)用氧化物形式表示LiAlSi2O6的组成: 。
(2)沉淀X主要成分为CaCO3和 。
(3)写出盐酸与Li2CO3反应的离子方程式: 。
(4)写出电解熔融LiCl时阴极的电极反应式: 。
(5)流程中两次使用了Na2CO3溶液,试说明前后浓度不同的原因:前者是
;后者是 。
【参考答案与解析】
解析:
本题以“硫酸与β-锂辉矿为主要原料制备金属锂的工业生产流程”为背景设计问题,将元素化合物知识、氧化物形式表示化合物组成的方法、离子方程式的书写、电极反应式的书写、流程中间产物的判断、沉淀的溶解平衡与试剂浓度的选择等知识融合在实际生产工艺之中加以考查。
以氧化物形式表示LiAlSi2O6的组成时,可将其化学式中所有原子的数目扩大为2倍,再行改写即可得到Li2O·Al2O3·4SiO2。β-锂辉矿(LiAlSi2O6和少量钙镁杂质)经焙烧、加浓硫酸、水浸、用碳酸钙调节溶液pH=6,经过滤后所得滤液中主要含Li+、SO42—和少量的Ca2+、Mg2+等离子。加入Ca(OH)2调节pH=11可生成Mg(OH)2沉淀除去Mg2+,再加适量稀碳酸钠溶液可以生成CaCO3沉淀除去Ca2+,所以沉淀X为Mg(OH)2 和CaCO3。此步骤使用稀碳酸钠溶液是为了防止生成Li2CO3沉淀而导致锂元素的损失。而在后续操作中向20% Li2SO4溶液中加入饱和碳酸钠溶液(增大CO32-离子浓度)的目的是为了让溶液中Li+尽可能转化为Li2CO3沉淀,以减少锂元素的损耗,达到充分利用锂元素的目的。盐酸与Li2CO3反应的离子方程式为:Li2CO3+2H+=2Li++CO2↑ + H2O,因Li2CO3为沉淀不能拆分;熔融LiCl电解时阴极的电极反应式为:Li++ e-=Li。
参考答案:
(1)Li2O·Al2O3·4SiO2(2分)
(2)Mg(OH)2(2分)
(3)Li2CO3+2H+=2Li++CO2↑ + H2O(2分)
(4)Li++ e-=Li(2分)
(5)浓度过大会使部分Li+ 沉淀(2分)
此时浓度大则有利于Li2CO3沉淀的生成(2分,其他合理答案均可)
【典型错误与矫正】
(1) (Li2O)0.5·(Al2O3) 0.5·(SiO2) 2 ;1/2Li2O·1/2Al2O3·2SiO 2
(表达不符合要求,应为Li2O·Al2O3·4SiO2 )
(2)MgCO3 〔Mg(OH)2 比MgCO3更难溶,应生成Mg(OH)2沉淀〕
(3)CO32—+ 2H+= CO2↑ + H2O (因Li2CO3为沉淀,书写离子方程式时不能拆分)
(4)2Cl—-2 e-=Cl2(错写为阳极电极反应)
(5)用于沉淀少量杂质;沉淀少量Ca2+,浓度不宜太大;沉淀 Ca2+ Mg2+;
(未读懂工艺流程的生产原理,从Li2CO3的溶解平衡考虑,如CO32—浓度过大会使部分Li+ 沉淀,而导致锂元素损失)
为了生成Li2CO3沉淀。(应突出回答浓度大的原因,有利于生成Li2CO3沉淀,充分利用锂元素,减少锂元素的损失)
5.(2012苏北四市二模)辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
(1)写出浸取过程中Cu2S溶解的离子方程式 。
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是
、 。
(3)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为 ;向滤液M中加入(或通入)下列 (填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是 ;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是 。
【参考答案与解析】
解析:
本题以“辉铜矿为原料制取硝酸铜的工艺流程”为背景设计问题,将元素化合物知识、离子方程式的书写、控制反应条件的目的、化学反应原理(反应速率、盐类水解)等知识融合在实际生产工艺中加以考查。
用FeCl3溶液浸取辉铜矿的原理是利用Fe3+氧化Cu2S生成可溶性的Cu2+和Fe2+,不溶的单质S可以用苯溶解回收,根据氧化还原反应的原理写出该离子方程式:Cu2S+4Fe3+=2Cu2++4Fe2++S。回收S的温度控制在50~60℃的原因是:如温度过低溶解速率太小,而温度过高则导致溶剂苯挥发损失。用Fe置换浸取液所得的滤液M中含Fe2+,可以通入Cl2将其氧化生成FeCl3而循环利用,且不会引入新的杂质;置换所得Cu及过量的Fe加HNO3后生成氮氧化物NOx,与氧气、水反应生成硝酸可循环利用,化学方程式为:4NOx +(5-2x)O2+2H2O=4HNO3。保温除铁过程中加入CuO的目的是调节溶液的pH,使溶液中Fe3+完全转化为Fe(OH)3沉淀而除去,并且不会引入新的杂质离子;蒸发浓缩Cu(NO3)2时加入硝酸调节溶液的pH,可以抑制Cu2+的水解。
参考答案:
(1)Cu2S+4Fe3+=2Cu2++4Fe2++S (2分)
(2)温度高苯容易挥发,温度低溶解速率小 (2分)
(3)4NOx +(5-2x)O2+2H2O=4HNO3 (2分) b (2分)
(4)调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀(2分)
抑制Cu2+的水解(不带入其他杂质) (2分)
【典型错误与矫正】
(1)Cu2S+2Fe3+=2Cu2++Fe2++ Fe S
(因Fe3+氧化性较强,可以将—2价S元素氧化为S单质,不会生成Fe S )
(2)温度低反应速率小 (因苯与S不发生化学反应,应回答“温度低溶解速率小”)
(3)4NO2 +O2+2H2O=4HNO3 (应按照NOx参加反应书写化学方程式)
(4)除去过量的铁 〔答题不够明确,是通过加CuO来“调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀”〕
6.(2012通泰扬一模)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 Fe(OH)3 Fe(OH)2 Al(OH)3
开始沉淀 2.3 7.5 3.4
完全沉淀 3.2 9.7 4.4
回答下列问题:
⑴加入少量NaHCO3的目的是调节pH,使溶液中的 沉淀,该工艺中“搅拌”的作用是 。
⑵在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 。
⑶碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
⑷在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
【参考答案与解析】
解析:
本题以“废铁屑(含少量氧化铝、氧化铁等)为原料生产碱式硫酸铁”为背景命题,结合工艺流程和图表考查元素化合物知识、化工操作的目的与作用、盐类水解与离子方程式的书写、影响化学反应速率的因素、离子的检验、有关氧化还原反应的计算等知识。
硫酸浸取废铁屑后所得溶液中含Fe2+和少量Al3+,加入少量NaHCO3调节pH可以使Al3+沉淀而除去, “搅拌”可以加快反应速率;反应Ⅱ通入的O2与NaNO2均作氧化剂,根据得失电子守恒,可以计算出标准状况下11.2LO2与2mol NaNO2得到的电子数相等;依据原子守恒及电荷守恒可以写出Fe(OH)2+水解生成Fe2(OH)42+的离子方程式:2Fe(OH)2++2H2OFe2(OH)42++2H+;因产品碱式硫酸铁中含Fe3+,检验是否含Fe2+时不能使用氯水和KSCN溶液的方法,也不能用NaOH溶液,可以滴入几滴酸性KMnO4溶液,如含Fe2+则溶液紫色褪去,反之溶液紫色不褪。
参考答案:
⑴Al3+ (2分) 加快反应速率 (2分)
⑵氧化剂 (2分) 2mol (2分)
⑶2Fe(OH)2++2H2OFe2(OH)42++2H+ (2分)
⑷D (2分)
【典型错误与矫正】
⑴Fe2+ (根据工艺流程该步操作是为保留Fe2+,除去杂质Al3+离子)
⑶〔因部分水解,要用“”符号,要注意电荷守恒、原子守恒〕
⑷AB;C (因产品中含Fe3+,检验Fe2+时不能采用加氯水和KSCN溶液的方法,也不能用加NaOH溶液,否则会引起干扰;可以用酸性KMnO4溶液检验Fe2+的存在,如含Fe2+,则滴入几滴酸性KMnO4后,溶液紫色会褪去,否则不褪。选D)
β-锂辉矿
焙烧
溶液
铝硅
化合物沉淀
沉淀X
Li2SO4
溶液
20%Li2SO4
溶液
Li2CO3
沉淀
成品
Li2CO3
LiCl
溶液
无水
LiCl
金属锂
LiCl
研磨
浓硫酸
①水浸泡
②CaCO3中和
调节pH=6
①Ca(OH)2调节pH=11
②适量稀Na2CO3溶液
蒸发浓缩
Na2CO3
饱和溶液
盐酸
洗涤
干燥
一定
条件
熔融
电解
同课章节目录
