第1章 化学反应 单元检测卷(含答案)
文档属性
| 名称 | 第1章 化学反应 单元检测卷(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 317.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-07-27 12:48:03 | ||
图片预览




文档简介
第1章
化学反应检测卷
一、选择题(每小题2分,共30分)
1.
化学上常对物质进行分类和研究,以下物质中属于金属氧化物的是(
)
A.
HNO3
B.
MgO
C.
O2
D.
NaCl
2.
(台州中考)下列化学反应中,属于化合反应的是(
)
A.
CaCO3CaO+CO2↑
B.
H2O+CO2H2CO3
C.
H2+CuOH2O+Cu
D.
BaCl2+H2SO4BaSO4↓+2HCl
3.
我国载人航天技术达到了世界先进水平。其中“神舟号”系列火箭使用的一种燃料是偏二甲肼,其化学式为C2H8N2,燃烧时发生如下反应:C2H8N2+2X2CO2+4H2O+3N2,则X的化学式是
……………(
)
A.
NO
B.
NO2
C.
N2O
D.
N2O4
4.
氢能是公认的清洁能源,作为低碳和零碳能源正在脱颖而出。21世纪,我国被国际公认为最有可能率先实现氢燃料电池和氢能汽车产业化的国家。氢燃料电池反应的化学方程式为:2H2+O22H2O,从方程式中获取的信息错误的是(
)
A.
反应前后,元素的种类没有变化
B.
在常温下氢气与氧气混合就可以发生反应
C.
4g氢气与32g氧气完全反应,可以生成36g水
D.
反应前后,氢原子和氧原子的数目都没有改变
5.
为了保证长时间潜航,潜水艇中要装备氧气再生装置,有以下几种制氧的方法:①加热高锰酸钾;②电解水(水氧气+氢气);③常温下过氧化钠固体与二氧化碳反应生成碳酸钠和氧气。你认为最适合潜水艇内制氧气的方法是
(
)
A.
①
B.
②
C.
③
D.
全部可以
6.
一氧化氮在常温下是一种无色气体,密度比空气稍大,难溶于水,它能跟空气中的氧气反应生成红棕色的二氧化氮。现要收集一瓶一氧化氮气体,宜采用的方法是(
)
A.
排水法
B.
向上排空气法
C.
排水法或向下排空气法
D.
向下排空气法
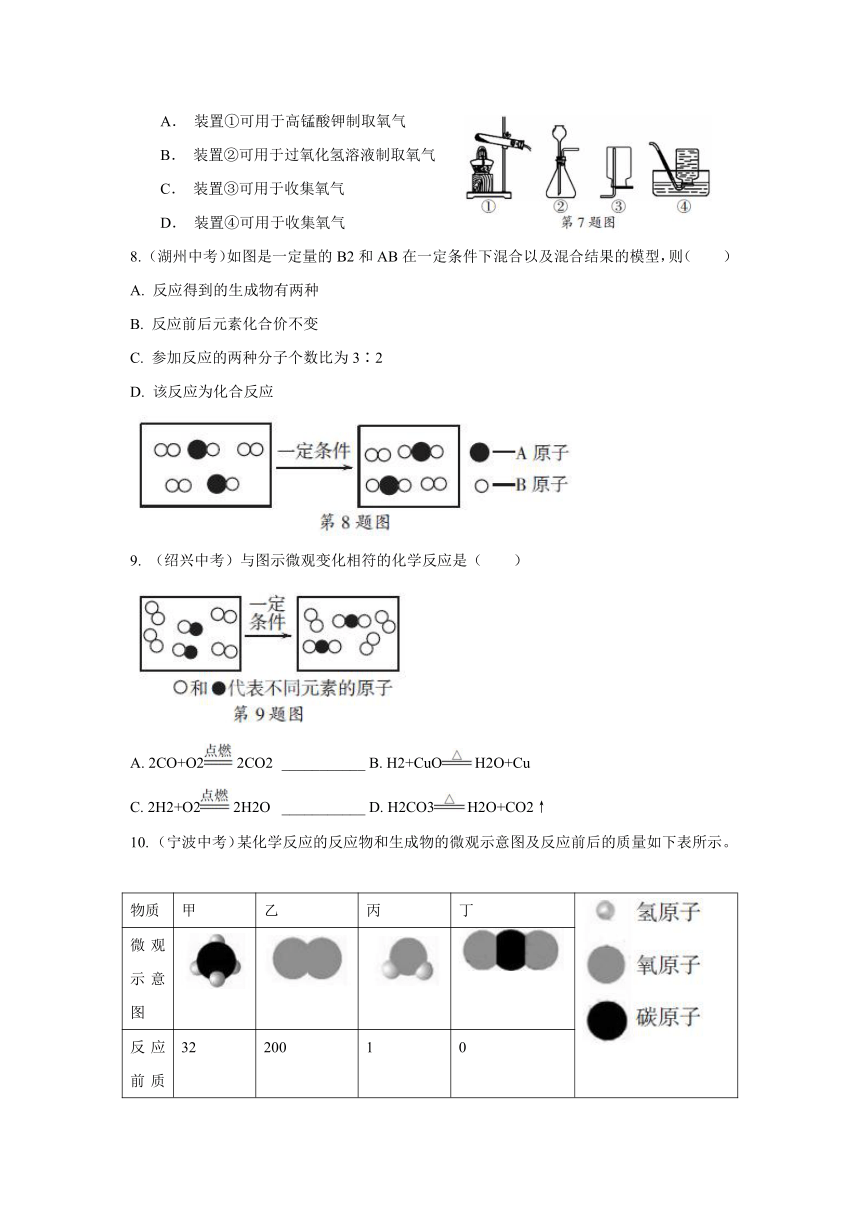
7.
实验室制取氧气,下列说法错误的是(
)
A.
装置①可用于高锰酸钾制取氧气
B.
装置②可用于过氧化氢溶液制取氧气
C.
装置③可用于收集氧气
D.
装置④可用于收集氧气
8.
(湖州中考)如图是一定量的B2和AB在一定条件下混合以及混合结果的模型,则(
)
A.
反应得到的生成物有两种
B.
反应前后元素化合价不变
C.
参加反应的两种分子个数比为3∶2
D.
该反应为化合反应
9.
(绍兴中考)与图示微观变化相符的化学反应是(
)
A.
2CO+O22CO2
___________
B.
H2+CuOH2O+Cu
C.
2H2+O22H2O
___________
D.
H2CO3H2O+CO2↑
10.
(宁波中考)某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示。
物质
甲
乙
丙
丁
微观示意图
反应前质量/g
32
200
1
0
反应后质量/g
0
x
y
z
下列有关该反应的说法正确的是(
)
A.
甲物质由碳原子和氢原子直接构成
B.
该反应属于置换反应
C.
参加反应的反应物分子个数比为1∶1
D.
x+y+z=233
11.
乙醇(俗名酒精)是一种“绿色能源”,推广使用乙醇汽油有利于保护环境。乙醇完全燃烧的反应可表示为C2HxO+yO22CO2+3H2O,其中x、y的数值分别是
(
)
A.
6、3
B.
6、6
C.
5、7
D.
3、3
12.
某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示。下列关于该过程的说法正确的是(
)
A.
c代表氧气
B.
t2时刻,O2开始产生
C.
t1时刻,KMnO4开始分解
D.
起催化作用物质的质量一直保持不变
13.
实验室用如图所示装置制取氧气,下列实验操作正确的是(
)
A.
加热前,将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中
B.
先将导管口移入集气瓶,再开始加热
C.
收集O2后,将集气瓶移出水槽,然后盖上玻璃片
D.
停止加热时,先熄灭酒精灯,再移出导气管
14.
FeCl3溶液常用于蚀刻印刷电路,反应原理为aFeCl3+bCucCuCl2+dX。向含溶质32.5g的FeCl3溶液中慢慢加入一定量的Cu粉,反应过程中FeCl3、CuCl2的质量随Cu粉质量变化如图。下列说法不正确的是
……………………………………………………(
)
A.
X为FeCl2
B.
化学计量数c=1
C.
方程式中a和b的比为1∶2
D.
完全反应后,生成X的质量为25.4g
15.
如图是同学们利用大可乐瓶设计的储气装置(铁架台未画出),以下说法不正确的是(
)
A.
打开止水夹a、b,气体从d管导入储存在下面的瓶子里,水被压入上瓶
B.
取用气体时,可通过控制止水夹a、b,靠水的重力方便地将气体排出
C.
气体被储存在装置中,c导管也必须安装止水夹
D.
该装置也可用于实验室制取某些气体的发生装置
二、填空题(除注明外,每空2分,共30分)
16.
(4分)配平下列化学方程式。
(1)___________C+___________CuO___________Cu+___________CO2↑
(2)___________H2+___________Fe2O3___________Fe+___________H2O
17.
(4分)最近我国留美化学家参与合成了一种新型炸药C8N8O16,它抗打击、抗震,但一经引爆就会发生剧烈爆炸。
(1)该炸药由___________种元素组成,一个分子中含___________个原子。
(2)此炸药在爆炸时会分解出两种无毒气体,一种是空气中含量最多的气体,写出此炸药爆炸时的化学方程式:_______________________________________________________
。
18.
(衢州中考)某品牌新能源电动汽车使用磷酸铁锂电池,其反应原理为:LiFePO4FePO4+Li。该电池具有容量大、续航能力强的特点。
(1)LiFePO4中铁元素与氧元素的质量比为___________。
(2)该电池充电时发生的化学反应属于___________(填基本反应类型)。
19.
在历届奥运会开幕式上都要举行隆重的“火炬接力”仪式,火炬中装的可燃物是丁烷,它燃烧时,火苗高且明亮,生成的产物只有二氧化碳和水。由此可知:丁烷中必有___________元素。
20.
如图是氢气在氯气中燃烧生成氯化氢的微观模拟图。请回答下列问题:
(1)在图乙中将相关粒子图形补充完整。
(2)该反应属于基本化学反应类型中的___________。
21.
碱式碳酸铜[Cu2(OH)2CO3]受热分解生成氧化铜、水和二氧化碳,反应的化学方程式为_____________________
;充分加热24g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3∶4,则该反应生成水和二氧化碳的质量之和为___________g。
22.
如图为某化学反应的微观示意图,请回答:
(1)在上述反应中不变的粒子是___________(填“分子”或“原子”)。
(2)在A、B、C、D中属于单质的是___________(填字母)。
(3)一个D分子是由______________________构成的。
(4)写出该反应的化学方程式:___________________________________________________。
三、实验探究题(第23题14分,第24题10分,共24分)
23.
初三某化学兴趣小组同学依据教材实验对化学反应前后质量变化进行了探究。
【查阅资料】碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳气体。
【实验装置设计】甲、乙、丙小组同学分别设计如图装置:
【讨论与探究】(1)甲小组实验中,白磷燃烧时,在锥形瓶底部加入少量水,其目的是
_____________________________________________________________________________
。
(2)请根据乙组和丙组设计的“质量守恒定律”的实验装置进行探究,并按要求完成乙组和丙组。
①乙组实验结束后可观察到天平是否平衡?___________(填“是”或“否”),此反应___________(填“遵守”或“不遵守”)质量守恒定律。
②由丙组过氧化氢溶液分解反应前后各物质质量总和的测定,得出参加化学反应的各物质的质量总和___________(填“大于”“等于”或“小于”)反应后生成的各物质的质量总和。该反应中二氧化锰起___________作用。
【实验结论】通过甲、乙、丙组实验探究,你得到的结论是______________________________________________________________________________
。
【实验分析】化学反应的过程是___________
重新组合的过程,即在一切化学反应中,反应前后原子的___________没有改变,原子的___________没有增减,原子的___________也没有变化,所以化学反应遵守质量守恒定律。
【反思与交流】通过甲、乙、丙小组实验的探究,你得到的启示是_____________________________________________________________________________
。
24.
实验室制取气体时所需的一些装置如图所示,请回答下列问题。
(1)实验室里用过氧化氢溶液和二氧化锰混合制取氧气的化学方程式为_____________________
。可选择的发生装置有___________
(填字母);选择气体收集方式时,气体的下列性质:①颜色、②密度、③溶解性、④可燃性,必须考虑的是___________
(填序号)。
(2)MnO2在该反应中可以重复使用,理由是________________________________________。
(3)若装置F中装有浓硫酸,可干燥气体,要制备干燥的氧气,所选择装置的连接顺序为___________(填字母)。
四、分析计算题(第25题4分,第26题6分,第27题6分,共16分)
25.
我国南方地区抗击暴风雪中,融雪剂发挥了一定的作用。其中一种融雪效果好、无污染的融雪剂的主要成分是醋酸钾(CH3COOK)。请回答:
(1)醋酸钾中C、K元素的质量比为___________
。
(2)醋酸钾的相对分子质量为___________。
26.
硅钢是变压器、充电器中的核心材料,其主要成分是Fe和Si。某学生用硅钢样品做了如下实验:取5.0g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其他杂质不反应),充分反应后过滤、洗涤、干燥、称重,得到的实验数据如表:
实验次数
一
二
三
四
五
六
稀硫酸的用量/g
10
10
10
10
10
10
剩余固体的质量/g
4.2
M
2.6
1.8
1.0
0.8
(1)表格中M=___________。
(2)硅钢样品中铁的质量分数是___________。
(3)计算所用稀硫酸中溶质的质量分数。
27.
氯化钠是一种重要的化工原料,已知电解氯化钠溶液可制得氯气、氢氧化钠等物质,反应的化学方程式为2NaCl+2H2OCl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2g溶液,生成氯气的质量与时间的关系如图所示。请计算:
(1)氯化钠完全反应时,溶液中剩余水的质量。
(2)原氯化钠溶液中的溶质的质量分数。
(3)若把这些氯化钠溶液稀释成溶质的质量分数为0.9%的生理盐水,需要加水的质量。
参考答案
第1章
化学反应检测卷
一、选择题
1—5.
BBDBC
6—10.
ACDAD
11—15.
ACACC
二、填空题
16.
(1)1
2
2
1
(2)3
1
2
3
17.
(1)3
32
(2)C8N8O164N2↑+8CO2↑
18.
(1)7∶8
(2)分解反应
19.
碳、氢(C、H)
20.
(1)
(2)化合反应
21.
Cu2(OH)2CO32CuO+H2O+CO2↑
6
22.
(1)原子
(2)B
(3)2个氢原子和1个氧原子
(4)2CO+4H2C2H5OH+H2O
三、实验探究题
23.
【讨论与探究】(1)吸收白磷燃烧时放出的热量,让装置快速冷却,同时防止锥形瓶局部骤热而炸裂
(2)①否
遵守
②等于
催化
【实验结论】参加化学反应的各物质质量总和等于生成的各物质质量总和
【实验分析】原子
种类
数目
质量
【反思与交流】有气体参加或生成的反应,应该在密闭容器中进行实验
24.
(1)2H2O22H2O+O2↑
A或B
②③
(2)MnO2是该反应的催化剂,反应前后化学性质不变、质量不变
(3)AFC(BFC)
四、分析计算题
25.
(1)8∶13
(2)98
26.
(1)3.4
(2)84%
(3)分析表中数据可知,10g稀硫酸与5.0g-4.2g=0.8g铁完全反应,设稀硫酸中溶质的质量分数为x,
Fe+H2SO4FeSO4+H2↑
56
98
0.8g
10g×x
则,解得x=14%。
27.
(1)43.2g
(2)20%
(3)1241.5g
化学反应检测卷
一、选择题(每小题2分,共30分)
1.
化学上常对物质进行分类和研究,以下物质中属于金属氧化物的是(
)
A.
HNO3
B.
MgO
C.
O2
D.
NaCl
2.
(台州中考)下列化学反应中,属于化合反应的是(
)
A.
CaCO3CaO+CO2↑
B.
H2O+CO2H2CO3
C.
H2+CuOH2O+Cu
D.
BaCl2+H2SO4BaSO4↓+2HCl
3.
我国载人航天技术达到了世界先进水平。其中“神舟号”系列火箭使用的一种燃料是偏二甲肼,其化学式为C2H8N2,燃烧时发生如下反应:C2H8N2+2X2CO2+4H2O+3N2,则X的化学式是
……………(
)
A.
NO
B.
NO2
C.
N2O
D.
N2O4
4.
氢能是公认的清洁能源,作为低碳和零碳能源正在脱颖而出。21世纪,我国被国际公认为最有可能率先实现氢燃料电池和氢能汽车产业化的国家。氢燃料电池反应的化学方程式为:2H2+O22H2O,从方程式中获取的信息错误的是(
)
A.
反应前后,元素的种类没有变化
B.
在常温下氢气与氧气混合就可以发生反应
C.
4g氢气与32g氧气完全反应,可以生成36g水
D.
反应前后,氢原子和氧原子的数目都没有改变
5.
为了保证长时间潜航,潜水艇中要装备氧气再生装置,有以下几种制氧的方法:①加热高锰酸钾;②电解水(水氧气+氢气);③常温下过氧化钠固体与二氧化碳反应生成碳酸钠和氧气。你认为最适合潜水艇内制氧气的方法是
(
)
A.
①
B.
②
C.
③
D.
全部可以
6.
一氧化氮在常温下是一种无色气体,密度比空气稍大,难溶于水,它能跟空气中的氧气反应生成红棕色的二氧化氮。现要收集一瓶一氧化氮气体,宜采用的方法是(
)
A.
排水法
B.
向上排空气法
C.
排水法或向下排空气法
D.
向下排空气法
7.
实验室制取氧气,下列说法错误的是(
)
A.
装置①可用于高锰酸钾制取氧气
B.
装置②可用于过氧化氢溶液制取氧气
C.
装置③可用于收集氧气
D.
装置④可用于收集氧气
8.
(湖州中考)如图是一定量的B2和AB在一定条件下混合以及混合结果的模型,则(
)
A.
反应得到的生成物有两种
B.
反应前后元素化合价不变
C.
参加反应的两种分子个数比为3∶2
D.
该反应为化合反应
9.
(绍兴中考)与图示微观变化相符的化学反应是(
)
A.
2CO+O22CO2
___________
B.
H2+CuOH2O+Cu
C.
2H2+O22H2O
___________
D.
H2CO3H2O+CO2↑
10.
(宁波中考)某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示。
物质
甲
乙
丙
丁
微观示意图
反应前质量/g
32
200
1
0
反应后质量/g
0
x
y
z
下列有关该反应的说法正确的是(
)
A.
甲物质由碳原子和氢原子直接构成
B.
该反应属于置换反应
C.
参加反应的反应物分子个数比为1∶1
D.
x+y+z=233
11.
乙醇(俗名酒精)是一种“绿色能源”,推广使用乙醇汽油有利于保护环境。乙醇完全燃烧的反应可表示为C2HxO+yO22CO2+3H2O,其中x、y的数值分别是
(
)
A.
6、3
B.
6、6
C.
5、7
D.
3、3
12.
某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示。下列关于该过程的说法正确的是(
)
A.
c代表氧气
B.
t2时刻,O2开始产生
C.
t1时刻,KMnO4开始分解
D.
起催化作用物质的质量一直保持不变
13.
实验室用如图所示装置制取氧气,下列实验操作正确的是(
)
A.
加热前,将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中
B.
先将导管口移入集气瓶,再开始加热
C.
收集O2后,将集气瓶移出水槽,然后盖上玻璃片
D.
停止加热时,先熄灭酒精灯,再移出导气管
14.
FeCl3溶液常用于蚀刻印刷电路,反应原理为aFeCl3+bCucCuCl2+dX。向含溶质32.5g的FeCl3溶液中慢慢加入一定量的Cu粉,反应过程中FeCl3、CuCl2的质量随Cu粉质量变化如图。下列说法不正确的是
……………………………………………………(
)
A.
X为FeCl2
B.
化学计量数c=1
C.
方程式中a和b的比为1∶2
D.
完全反应后,生成X的质量为25.4g
15.
如图是同学们利用大可乐瓶设计的储气装置(铁架台未画出),以下说法不正确的是(
)
A.
打开止水夹a、b,气体从d管导入储存在下面的瓶子里,水被压入上瓶
B.
取用气体时,可通过控制止水夹a、b,靠水的重力方便地将气体排出
C.
气体被储存在装置中,c导管也必须安装止水夹
D.
该装置也可用于实验室制取某些气体的发生装置
二、填空题(除注明外,每空2分,共30分)
16.
(4分)配平下列化学方程式。
(1)___________C+___________CuO___________Cu+___________CO2↑
(2)___________H2+___________Fe2O3___________Fe+___________H2O
17.
(4分)最近我国留美化学家参与合成了一种新型炸药C8N8O16,它抗打击、抗震,但一经引爆就会发生剧烈爆炸。
(1)该炸药由___________种元素组成,一个分子中含___________个原子。
(2)此炸药在爆炸时会分解出两种无毒气体,一种是空气中含量最多的气体,写出此炸药爆炸时的化学方程式:_______________________________________________________
。
18.
(衢州中考)某品牌新能源电动汽车使用磷酸铁锂电池,其反应原理为:LiFePO4FePO4+Li。该电池具有容量大、续航能力强的特点。
(1)LiFePO4中铁元素与氧元素的质量比为___________。
(2)该电池充电时发生的化学反应属于___________(填基本反应类型)。
19.
在历届奥运会开幕式上都要举行隆重的“火炬接力”仪式,火炬中装的可燃物是丁烷,它燃烧时,火苗高且明亮,生成的产物只有二氧化碳和水。由此可知:丁烷中必有___________元素。
20.
如图是氢气在氯气中燃烧生成氯化氢的微观模拟图。请回答下列问题:
(1)在图乙中将相关粒子图形补充完整。
(2)该反应属于基本化学反应类型中的___________。
21.
碱式碳酸铜[Cu2(OH)2CO3]受热分解生成氧化铜、水和二氧化碳,反应的化学方程式为_____________________
;充分加热24g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3∶4,则该反应生成水和二氧化碳的质量之和为___________g。
22.
如图为某化学反应的微观示意图,请回答:
(1)在上述反应中不变的粒子是___________(填“分子”或“原子”)。
(2)在A、B、C、D中属于单质的是___________(填字母)。
(3)一个D分子是由______________________构成的。
(4)写出该反应的化学方程式:___________________________________________________。
三、实验探究题(第23题14分,第24题10分,共24分)
23.
初三某化学兴趣小组同学依据教材实验对化学反应前后质量变化进行了探究。
【查阅资料】碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳气体。
【实验装置设计】甲、乙、丙小组同学分别设计如图装置:
【讨论与探究】(1)甲小组实验中,白磷燃烧时,在锥形瓶底部加入少量水,其目的是
_____________________________________________________________________________
。
(2)请根据乙组和丙组设计的“质量守恒定律”的实验装置进行探究,并按要求完成乙组和丙组。
①乙组实验结束后可观察到天平是否平衡?___________(填“是”或“否”),此反应___________(填“遵守”或“不遵守”)质量守恒定律。
②由丙组过氧化氢溶液分解反应前后各物质质量总和的测定,得出参加化学反应的各物质的质量总和___________(填“大于”“等于”或“小于”)反应后生成的各物质的质量总和。该反应中二氧化锰起___________作用。
【实验结论】通过甲、乙、丙组实验探究,你得到的结论是______________________________________________________________________________
。
【实验分析】化学反应的过程是___________
重新组合的过程,即在一切化学反应中,反应前后原子的___________没有改变,原子的___________没有增减,原子的___________也没有变化,所以化学反应遵守质量守恒定律。
【反思与交流】通过甲、乙、丙小组实验的探究,你得到的启示是_____________________________________________________________________________
。
24.
实验室制取气体时所需的一些装置如图所示,请回答下列问题。
(1)实验室里用过氧化氢溶液和二氧化锰混合制取氧气的化学方程式为_____________________
。可选择的发生装置有___________
(填字母);选择气体收集方式时,气体的下列性质:①颜色、②密度、③溶解性、④可燃性,必须考虑的是___________
(填序号)。
(2)MnO2在该反应中可以重复使用,理由是________________________________________。
(3)若装置F中装有浓硫酸,可干燥气体,要制备干燥的氧气,所选择装置的连接顺序为___________(填字母)。
四、分析计算题(第25题4分,第26题6分,第27题6分,共16分)
25.
我国南方地区抗击暴风雪中,融雪剂发挥了一定的作用。其中一种融雪效果好、无污染的融雪剂的主要成分是醋酸钾(CH3COOK)。请回答:
(1)醋酸钾中C、K元素的质量比为___________
。
(2)醋酸钾的相对分子质量为___________。
26.
硅钢是变压器、充电器中的核心材料,其主要成分是Fe和Si。某学生用硅钢样品做了如下实验:取5.0g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其他杂质不反应),充分反应后过滤、洗涤、干燥、称重,得到的实验数据如表:
实验次数
一
二
三
四
五
六
稀硫酸的用量/g
10
10
10
10
10
10
剩余固体的质量/g
4.2
M
2.6
1.8
1.0
0.8
(1)表格中M=___________。
(2)硅钢样品中铁的质量分数是___________。
(3)计算所用稀硫酸中溶质的质量分数。
27.
氯化钠是一种重要的化工原料,已知电解氯化钠溶液可制得氯气、氢氧化钠等物质,反应的化学方程式为2NaCl+2H2OCl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2g溶液,生成氯气的质量与时间的关系如图所示。请计算:
(1)氯化钠完全反应时,溶液中剩余水的质量。
(2)原氯化钠溶液中的溶质的质量分数。
(3)若把这些氯化钠溶液稀释成溶质的质量分数为0.9%的生理盐水,需要加水的质量。
参考答案
第1章
化学反应检测卷
一、选择题
1—5.
BBDBC
6—10.
ACDAD
11—15.
ACACC
二、填空题
16.
(1)1
2
2
1
(2)3
1
2
3
17.
(1)3
32
(2)C8N8O164N2↑+8CO2↑
18.
(1)7∶8
(2)分解反应
19.
碳、氢(C、H)
20.
(1)
(2)化合反应
21.
Cu2(OH)2CO32CuO+H2O+CO2↑
6
22.
(1)原子
(2)B
(3)2个氢原子和1个氧原子
(4)2CO+4H2C2H5OH+H2O
三、实验探究题
23.
【讨论与探究】(1)吸收白磷燃烧时放出的热量,让装置快速冷却,同时防止锥形瓶局部骤热而炸裂
(2)①否
遵守
②等于
催化
【实验结论】参加化学反应的各物质质量总和等于生成的各物质质量总和
【实验分析】原子
种类
数目
质量
【反思与交流】有气体参加或生成的反应,应该在密闭容器中进行实验
24.
(1)2H2O22H2O+O2↑
A或B
②③
(2)MnO2是该反应的催化剂,反应前后化学性质不变、质量不变
(3)AFC(BFC)
四、分析计算题
25.
(1)8∶13
(2)98
26.
(1)3.4
(2)84%
(3)分析表中数据可知,10g稀硫酸与5.0g-4.2g=0.8g铁完全反应,设稀硫酸中溶质的质量分数为x,
Fe+H2SO4FeSO4+H2↑
56
98
0.8g
10g×x
则,解得x=14%。
27.
(1)43.2g
(2)20%
(3)1241.5g
