1.3 用分解反应制取氧气 同步练习(含答案)
文档属性
| 名称 | 1.3 用分解反应制取氧气 同步练习(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 190.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-07-27 21:30:02 | ||
图片预览

文档简介
第3节
用分解反应制取氧气
课堂笔记
一、工业制取氧气
由于液态氧和氮的____________
是不同的,所以可以用空气冷冻分离法分离空气中的氧气和氮气。
二、在实验室中获得氧气
1.
人们分解某些物质如____________、
、____________等在实验室中制取氧气。
2.
实验室中用过氧化氢分解产生氧气和水,有关化学方程式为________________________。
3.
二氧化锰和猪肝是____________
,它们都能___________(改变)过氧化氢的分解速度。
4.
排水法是一种常用的收集方法,适合于收集____________或____________于水的气体。
5.
用二氧化锰作催化剂,加热分解氯酸钾制取氧气,有关化学方程式为________________________。
课时训练
A组
基础训练
1.
下列物质不能用于实验室制取氧气的是(
)
A.
KMnO4
B.
KClO3
C.
KCl
D.
H2O2
2.
“神舟七号”太空舱利用NiFe2O4将航天员呼出的废气转化为航天员需要的气体,而NiFe2O4的质量和化学性质都不变,在该过程中NiFe2O4是(
)
A.
反应物
B.
生成物
C.
催化剂
D.
消毒剂
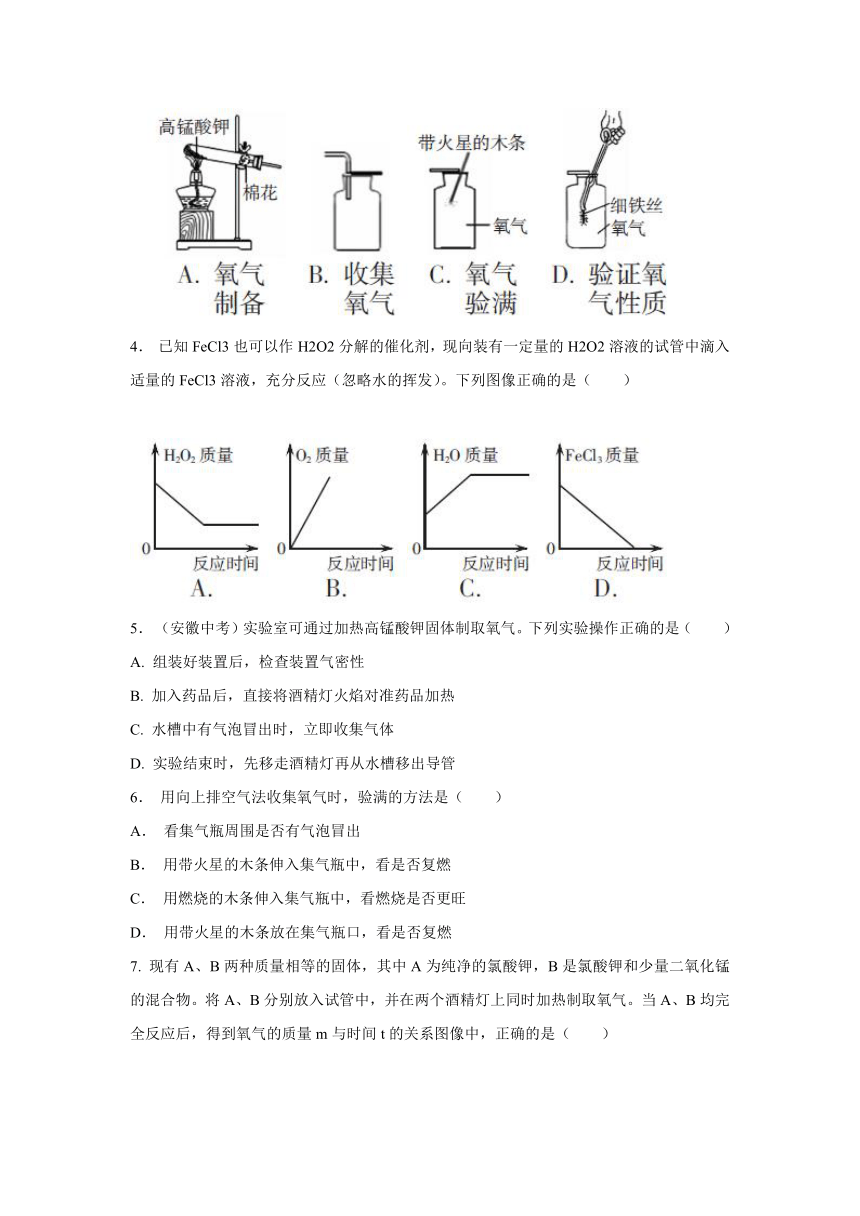
3.
如图,A、B、C、D分别是实验室里氧气制备、收集、验满、验证性质的操作,其中正确的是(
)
4.
已知FeCl3也可以作H2O2分解的催化剂,现向装有一定量的H2O2溶液的试管中滴入适量的FeCl3溶液,充分反应(忽略水的挥发)。下列图像正确的是(
)
5.
(安徽中考)实验室可通过加热高锰酸钾固体制取氧气。下列实验操作正确的是(
)
A.
组装好装置后,检查装置气密性
B.
加入药品后,直接将酒精灯火焰对准药品加热
C.
水槽中有气泡冒出时,立即收集气体
D.
实验结束时,先移走酒精灯再从水槽移出导管
6.
用向上排空气法收集氧气时,验满的方法是(
)
A.
看集气瓶周围是否有气泡冒出
B.
用带火星的木条伸入集气瓶中,看是否复燃
C.
用燃烧的木条伸入集气瓶中,看燃烧是否更旺
D.
用带火星的木条放在集气瓶口,看是否复燃
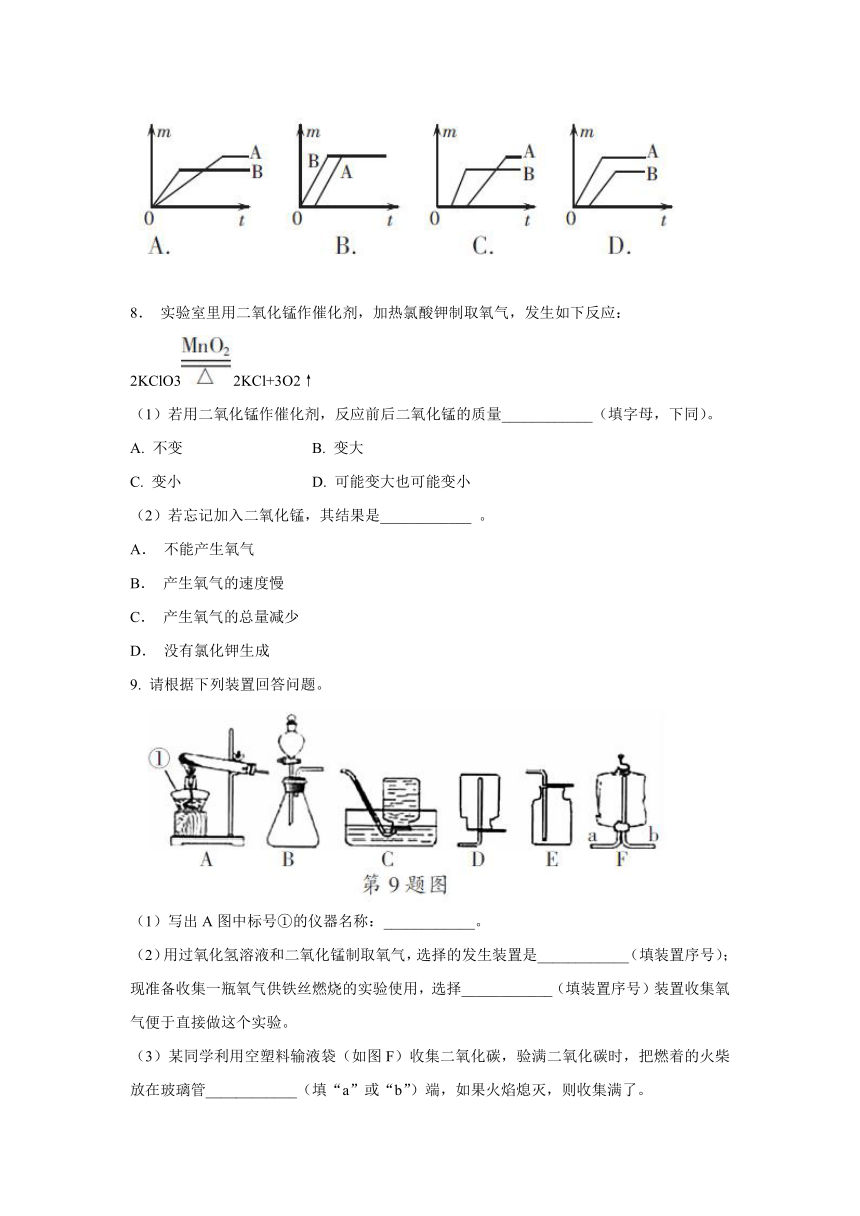
7.
现有A、B两种质量相等的固体,其中A为纯净的氯酸钾,B是氯酸钾和少量二氧化锰的混合物。将A、B分别放入试管中,并在两个酒精灯上同时加热制取氧气。当A、B均完全反应后,得到氧气的质量m与时间t的关系图像中,正确的是(
)
8.
实验室里用二氧化锰作催化剂,加热氯酸钾制取氧气,发生如下反应:
2KClO32KCl+3O2↑
(1)若用二氧化锰作催化剂,反应前后二氧化锰的质量____________(填字母,下同)。
A.
不变
B.
变大
C.
变小
D.
可能变大也可能变小
(2)若忘记加入二氧化锰,其结果是____________
。
A.
不能产生氧气
B.
产生氧气的速度慢
C.
产生氧气的总量减少
D.
没有氯化钾生成
9.
请根据下列装置回答问题。
(1)写出A图中标号①的仪器名称:____________。
(2)用过氧化氢溶液和二氧化锰制取氧气,选择的发生装置是____________(填装置序号);现准备收集一瓶氧气供铁丝燃烧的实验使用,选择____________(填装置序号)装置收集氧气便于直接做这个实验。
(3)某同学利用空塑料输液袋(如图F)收集二氧化碳,验满二氧化碳时,把燃着的火柴放在玻璃管____________(填“a”或“b”)端,如果火焰熄灭,则收集满了。
B组
自主提高
10.
(绍兴中考)进行氧气制取与性质检验的实验。
(1)以过氧化氢溶液为原料制取并收集氧气,应选用的装置是____________(填字母)。
(2)实验中,用装有一定量水的集气瓶进行排水法收集氧气,能使带火星的木条复燃。那么使带火星的木条复燃的氧气体积分数的最低值是多少呢?进一步展开探究。
第一组实验:5只容积均为100毫升的集气瓶,分别装入一定体积的水,再用排水法收集氧气,恰好把5只集气瓶中的水排去。将带火星的木条依次伸入5只集气瓶中,记录实验现象。
以相同方法完成第二组实验。两组实验的数据和现象见下表。(已知空气中氧气的体积分数为21%)
第一组
第二组
集气瓶编号
A
B
C
D
E
A
B
C
D
E
集气前装入集气瓶内水的体积(毫升)
10
20
30
40
50
31
33
35
37
39
带火星的木条的状况
微亮
亮
很亮
复燃
复燃
很亮
很亮
复燃
复燃
复燃
①第一组实验D瓶,集气结束时氧气的体积分数为____________%。
②经计算,第二组实验C瓶的氧气体积分数为48.65%,由此得出“使带火星的木条复燃的氧气体积分数的最低值只能是48.65%”的结论。对此结论和过程进行评价:____________
_______________________________________________________________________
。
11.
(衢州中考)利用加热高锰酸钾的方法,验证化学反应中质量守恒定律。如图,小科将适量高锰酸钾装入试管,塞入一团棉花并测出试管、棉花与药品的总质量为m。加热使之充分反应后,测得量筒中气体体积为V,再次测得反应装置与物质总质量为m2,已知常温常压下氧气的密度为ρ。据此请回答:
(1)实验中用量筒收集气体的好处是___________。
(2)实验中,试管口内壁附着紫红色小液滴,请解释产生该现象的原因:____________。
(3)根据实验数据计算发现:m1-m2≠ρV,与质量守恒定律不符。造成这一实验结果的原因分析正确的是____________。
A.
试管中高锰酸钾没有完全分解
B.
导管口连续均匀冒气泡时才收集气体
C.
未调节量筒内外液面相平就读数
D.
停止加热时,先将导管移出水面,再熄灭酒精灯
参考答案
第3节
用分解反应制取氧气
【课堂笔记】
一、沸点
二、1.
氯酸钾
高锰酸钾
过氧化氢
2.
2H2O2O2↑+2H2O
3.
催化剂
加快
4.
难溶
微溶
5.
2KClO32KCl+3O2↑
【课时训练】
1—5.
CCACA
6—7.
DC
8.
(1)A
(2)B
9.
(1)酒精灯
(2)B
C
(3)b
10.
(1)AE
(2)①52.6
②该结论不严谨。实验过程可省去A、D、E,补充一组水的体积为34毫升的实验
11.
(1)便于直接读出氧气的体积
(2)高锰酸钾粉末溶于冷凝水形成溶液
(3)BCD
用分解反应制取氧气
课堂笔记
一、工业制取氧气
由于液态氧和氮的____________
是不同的,所以可以用空气冷冻分离法分离空气中的氧气和氮气。
二、在实验室中获得氧气
1.
人们分解某些物质如____________、
、____________等在实验室中制取氧气。
2.
实验室中用过氧化氢分解产生氧气和水,有关化学方程式为________________________。
3.
二氧化锰和猪肝是____________
,它们都能___________(改变)过氧化氢的分解速度。
4.
排水法是一种常用的收集方法,适合于收集____________或____________于水的气体。
5.
用二氧化锰作催化剂,加热分解氯酸钾制取氧气,有关化学方程式为________________________。
课时训练
A组
基础训练
1.
下列物质不能用于实验室制取氧气的是(
)
A.
KMnO4
B.
KClO3
C.
KCl
D.
H2O2
2.
“神舟七号”太空舱利用NiFe2O4将航天员呼出的废气转化为航天员需要的气体,而NiFe2O4的质量和化学性质都不变,在该过程中NiFe2O4是(
)
A.
反应物
B.
生成物
C.
催化剂
D.
消毒剂
3.
如图,A、B、C、D分别是实验室里氧气制备、收集、验满、验证性质的操作,其中正确的是(
)
4.
已知FeCl3也可以作H2O2分解的催化剂,现向装有一定量的H2O2溶液的试管中滴入适量的FeCl3溶液,充分反应(忽略水的挥发)。下列图像正确的是(
)
5.
(安徽中考)实验室可通过加热高锰酸钾固体制取氧气。下列实验操作正确的是(
)
A.
组装好装置后,检查装置气密性
B.
加入药品后,直接将酒精灯火焰对准药品加热
C.
水槽中有气泡冒出时,立即收集气体
D.
实验结束时,先移走酒精灯再从水槽移出导管
6.
用向上排空气法收集氧气时,验满的方法是(
)
A.
看集气瓶周围是否有气泡冒出
B.
用带火星的木条伸入集气瓶中,看是否复燃
C.
用燃烧的木条伸入集气瓶中,看燃烧是否更旺
D.
用带火星的木条放在集气瓶口,看是否复燃
7.
现有A、B两种质量相等的固体,其中A为纯净的氯酸钾,B是氯酸钾和少量二氧化锰的混合物。将A、B分别放入试管中,并在两个酒精灯上同时加热制取氧气。当A、B均完全反应后,得到氧气的质量m与时间t的关系图像中,正确的是(
)
8.
实验室里用二氧化锰作催化剂,加热氯酸钾制取氧气,发生如下反应:
2KClO32KCl+3O2↑
(1)若用二氧化锰作催化剂,反应前后二氧化锰的质量____________(填字母,下同)。
A.
不变
B.
变大
C.
变小
D.
可能变大也可能变小
(2)若忘记加入二氧化锰,其结果是____________
。
A.
不能产生氧气
B.
产生氧气的速度慢
C.
产生氧气的总量减少
D.
没有氯化钾生成
9.
请根据下列装置回答问题。
(1)写出A图中标号①的仪器名称:____________。
(2)用过氧化氢溶液和二氧化锰制取氧气,选择的发生装置是____________(填装置序号);现准备收集一瓶氧气供铁丝燃烧的实验使用,选择____________(填装置序号)装置收集氧气便于直接做这个实验。
(3)某同学利用空塑料输液袋(如图F)收集二氧化碳,验满二氧化碳时,把燃着的火柴放在玻璃管____________(填“a”或“b”)端,如果火焰熄灭,则收集满了。
B组
自主提高
10.
(绍兴中考)进行氧气制取与性质检验的实验。
(1)以过氧化氢溶液为原料制取并收集氧气,应选用的装置是____________(填字母)。
(2)实验中,用装有一定量水的集气瓶进行排水法收集氧气,能使带火星的木条复燃。那么使带火星的木条复燃的氧气体积分数的最低值是多少呢?进一步展开探究。
第一组实验:5只容积均为100毫升的集气瓶,分别装入一定体积的水,再用排水法收集氧气,恰好把5只集气瓶中的水排去。将带火星的木条依次伸入5只集气瓶中,记录实验现象。
以相同方法完成第二组实验。两组实验的数据和现象见下表。(已知空气中氧气的体积分数为21%)
第一组
第二组
集气瓶编号
A
B
C
D
E
A
B
C
D
E
集气前装入集气瓶内水的体积(毫升)
10
20
30
40
50
31
33
35
37
39
带火星的木条的状况
微亮
亮
很亮
复燃
复燃
很亮
很亮
复燃
复燃
复燃
①第一组实验D瓶,集气结束时氧气的体积分数为____________%。
②经计算,第二组实验C瓶的氧气体积分数为48.65%,由此得出“使带火星的木条复燃的氧气体积分数的最低值只能是48.65%”的结论。对此结论和过程进行评价:____________
_______________________________________________________________________
。
11.
(衢州中考)利用加热高锰酸钾的方法,验证化学反应中质量守恒定律。如图,小科将适量高锰酸钾装入试管,塞入一团棉花并测出试管、棉花与药品的总质量为m。加热使之充分反应后,测得量筒中气体体积为V,再次测得反应装置与物质总质量为m2,已知常温常压下氧气的密度为ρ。据此请回答:
(1)实验中用量筒收集气体的好处是___________。
(2)实验中,试管口内壁附着紫红色小液滴,请解释产生该现象的原因:____________。
(3)根据实验数据计算发现:m1-m2≠ρV,与质量守恒定律不符。造成这一实验结果的原因分析正确的是____________。
A.
试管中高锰酸钾没有完全分解
B.
导管口连续均匀冒气泡时才收集气体
C.
未调节量筒内外液面相平就读数
D.
停止加热时,先将导管移出水面,再熄灭酒精灯
参考答案
第3节
用分解反应制取氧气
【课堂笔记】
一、沸点
二、1.
氯酸钾
高锰酸钾
过氧化氢
2.
2H2O2O2↑+2H2O
3.
催化剂
加快
4.
难溶
微溶
5.
2KClO32KCl+3O2↑
【课时训练】
1—5.
CCACA
6—7.
DC
8.
(1)A
(2)B
9.
(1)酒精灯
(2)B
C
(3)b
10.
(1)AE
(2)①52.6
②该结论不严谨。实验过程可省去A、D、E,补充一组水的体积为34毫升的实验
11.
(1)便于直接读出氧气的体积
(2)高锰酸钾粉末溶于冷凝水形成溶液
(3)BCD
