人教版必修一 同步课件 以物质的量为中心的计算(14张ppt)
文档属性
| 名称 | 人教版必修一 同步课件 以物质的量为中心的计算(14张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-27 00:00:00 | ||
图片预览





文档简介
(共16张PPT)
人教版
高一上
知识清单
一、物质的量
1.物质的量(n)
(1)概念:表示含有一定数目粒子的集合体,单位为
mol。
(2)数值:1
mol
粒子集合体所含的粒子数与
0.012
kg-12
C
中所含的碳原子数相同。
(3)描述对象:微观粒子或微观粒子的特定组合。
如电子、质子、中子、分子、原子、离子等
如原子团、官能团等
物质的量的单位后面应为确切的微粒名称;如
1
mol
氢(不确切)和
1
mol
小麦(宏观物质)的说法都不对。
注意
2.阿伏加德罗常数(NA)
(1)概念:1
mol
任何粒子所含的微粒数,通常用
6.02×1023
mol-1
表示。
(2)数值:与0.012
kg
12
C中所含的碳原子数相同,均为
6.02×1023
。
(3)物质的量、微粒数(N)与阿伏加德罗常数的关系为
。
知识清单
3.摩尔质量(M)
(1)概念:单位物质的量的物质所具有的质量,常用单位为
g/mol。
(2)数值:与对应微粒的相对分子(原子)质量相同。
(3)物质的量、物质的质量与摩尔质量的关系为
。
摩尔质量(单位为g·mol-1)、相对分子(或原子)质量(单位为1)、1
mol物质的质量
(单位为g)在数值上是相同的,但单位不同。如H2,其摩尔质量为2
g·mol-1,相对分子质量为2,1
mol该物质的质量为2
g。
注意
二、气体摩尔体积(Vm)
1.概念:一定温度和压强下,单位物质的量的气体所占有的体积,常用单位为
L·mol-1。
2.影响因素:气体摩尔体积的数值取决于温度和压强。
知识清单
3.
特例:标准状况(0
℃,101
kPa)下,Vm
为
22.4
L·mol-1。
4.
气体摩尔体积与物质的量、气体体积之间的关系为
。
使用对象必须是气体,单一或混合气体都可以。如水、酒精、SO3、CCl4等在标准状况下不是气体,不能用气体摩尔体积计算。
注意
三、物质的量浓度(c)
1.
概念:表示单位体积溶液里所含溶质的物质的量,常用单位为mol/L。
2.
表达式:
。
①表达式中的“V”指溶液的体积。②对于一定浓度的溶液,其浓度、密度、质量分数与所取溶液体积无关,但溶质的质量、物质的量与所取溶液体积有关。
注意
知识清单
3.
判断某些溶液中的溶质
(1)含结晶水的物质:如CuSO4·5H2O溶于水溶质为CuSO4。
(2)与水反应的物质:如Na、Na2O、Na2O2与水反应溶质为NaOH,SO3与水反应溶质为H2SO4,NO2与水反应溶质为HNO3。
(3)特殊物质:如NH3溶于水溶质为NH3·H2O,但计算物质的量浓度时还是以NH3作为溶质来计算。
4.物质的量浓度的相关计算
(1)简单计算:
。
(2)溶液稀释的计算:①稀释前后溶质的物质的量保持不变,即
c1V1=c2V2
;②溶液质量守恒,即m(稀)=m(浓)+m(水)。(体积一般不守恒)
(3)溶液混合的计算:混合前后溶质的物质的量保持不变,即c1·V1+c2·V2=c(混)·V(混)
知识清单
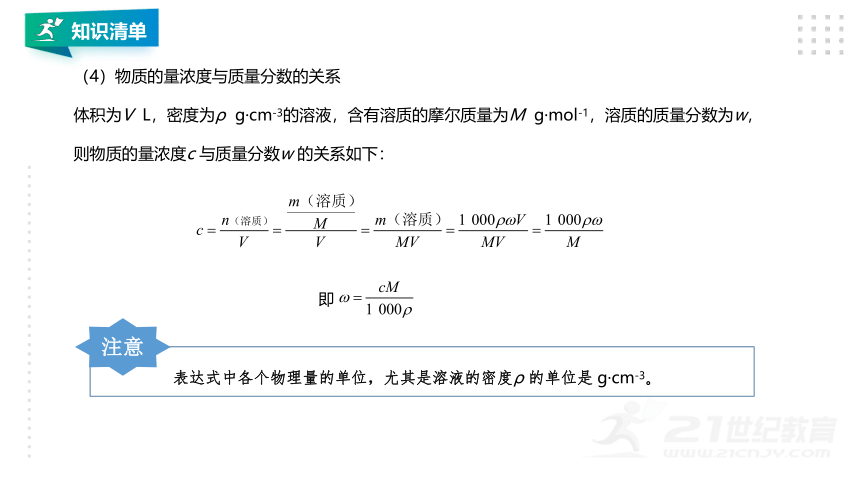
(4)物质的量浓度与质量分数的关系
体积为V
L,密度为ρ
g·cm-3的溶液,含有溶质的摩尔质量为M
g·mol-1,溶质的质量分数为w,则物质的量浓度c
与质量分数w
的关系如下:
表达式中各个物理量的单位,尤其是溶液的密度ρ
的单位是
g·cm-3。
注意
即
知识清单
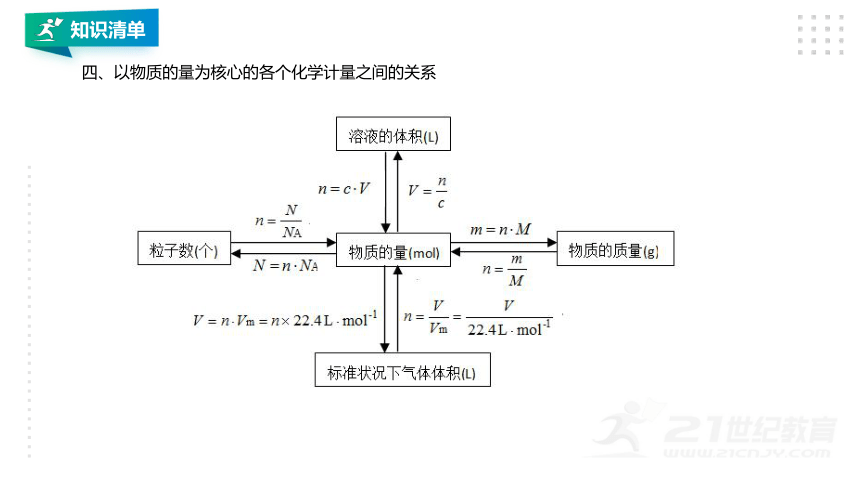
四、以物质的量为核心的各个化学计量之间的关系
知识清单
五、在关于物质的量计算中的几类“陷阱”
1.物质的组成和结构
(1)特殊物质中所含的微粒数目。如He、Ne等稀有气体,D2O,OH-
与—OH等。
(2)物质所含化学键的数目。如白磷(P4)、
CnH2n+2中分别
含有6、(3n+1)个化学键。
(3)常见最简式相同的物质。如NO2和N2O4、乙烯和丙烯、O2和O3等
(4)摩尔质量相同的物质。如N2、CO、C2H4等。
2.物质的状态和条件
(1)标准状况(0
℃,101
KPa)下,非气态物质有H2O、SO3、戊烷、CHCl3、HF、苯等。
(2)物质的质量、摩尔质量、微粒个数不受温度、压强的影响。
知识清单
3.电解质溶液中的粒子数目
是否存在弱电解质的电离或盐类的水解;已知浓度,是否指明体积,用好公式
n=cV;在判断溶液中微粒总数时,是否忽视溶剂水。
5.氧化还原反应中电子转移数目
如
Cl2
和
NaOH
反应中,Cl2既作氧化剂,又作还原剂;Fe和
HNO3反应,Fe不足,生成Fe3+,Fe过量,生成Fe2+;向FeI2溶液中通入Cl2,Cl2首先氧化I-,再氧化Fe2+。
4.可逆反应和特殊反应
(1)常见可逆反应:N2+3H2
2NH3
,NH3+H2O
NH3·H2O
NH4++OH-
,2SO2+O2
2SO3
,Cl2+H2O
HCl+HClO,
2NO2
N2O4
,H2+I2
2HI
(2)特殊反应:如常温下,铁、铝遇浓硫酸、浓硝酸发生“钝化”。
例题讲解
【答案】C
A项,标准状况下,22.4
L氟气(F2)的物质的量为1
mol,因为1个氟原子中含有7个质子,所以1
mol氟气中含有的质子数为1
mol×9×2×NA=18NA,错误;
B项,该反应为H2+I2
2HI,为可逆反应,充分反应后生成的碘化氢的物质的量小于2
mol,即分子数小于2NA,正确;
C项,该反应为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,阴阳两极产生的气体的物质的量相等,若气体总质量为73
g,则产生的H2和Cl2的无质量均为1
mol,根据2Cl--2e-=Cl2,转移的电子数为2NA,错误;D项,溴化铵水溶液中存在电荷守恒,即n(NH4+)+n(H+)=n(Br-)+n(OH-),由于溶液中的NH4+能水解,Br-不水解,而n(Br-)=1
L×1
mol·L-1=1
mol,所以该溶液中NH4+与H+离子数之和大于NA,正确。
(2021·河北)NA是阿伏加德罗常数的值,下列说法错误的是(
)
A.
22.4
L(标准状况)氟气所含的质子数为18NA
B.
1mol碘蒸气和1mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA
C.
电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为NA
D.1
L
1mol·L-1溴化铵水溶液中NH4+
与H+离子数之和大于NA
1
例题讲解
【答案】CD
A项,由
可知,氮气的数目为
,1个氮气分子中含有14个中子,所以共有14NA个中子,错误;
B项,1个重水(D2O)分子和1个水(H2O)分子含有的质子数都为10,所以1
mol重水和1
mol水含有的质子数均为10NA,错误;
C项,根据
,12
g石墨烯(C60)和12
g金刚石中碳原子的数目均为
NA
,正确;D项
,该溶液中NaCl的物质的量为1
L×1
mol·L?1=1
mol,1个
NaCl中含有的电子数为11+17=28,则共含有28NA个电子,正确。
(2020
·全国卷Ⅲ)NA是阿伏加德罗常数的值。下列说法正确的是(
)
A.22.4
L(标准状况)氮气中含有7NA个中子
B.1
mol
重水比1
mol
水多NA个质子
C.12
g
石墨烯和12
g金刚石均含有NA个碳原子
D.1
L
1
mol·L?1
NaCl溶液含有28NA个电子
2
例题讲解
【答案】B
A项,1个3He分子中含有1个中子,3
g
3He的物质的量为
,即含有NA个中子,
正确;B项,根据题干数据,n(Na3PO3)=1
L×0.1
mol·L-1=0.1
mol,由于溶液中的PO33-会发生水解,所以该溶液含有的PO43-数目小于0.1NA
,错误;C项,反应中Cr元素的化合价变化为6-3=3,1
mol
K2Cr2O7含有2
mol
Cr,所以转移电子的物质的量为6
mol,即电子数为6NA,正确;D项,正丁烷和异丁烷的化学式均为C4H10,则58
g该混合物的物质的量为
,而每个正丁烷分子或异丁烷分子的总键数为13,所以该混合物中共价键的物质的量为13
mol,即数目为13NA
,正确。
(2019·全国卷Ⅱ)已知NA是阿伏加德罗常数的值,下列说法错误的是(
)
A.3
g
3He含有的中子数为1NA
B.1
L
0.1
mol·L-1磷酸钠溶液含有的PO43-数目为0.1NA
C.1
mol
K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.48
g正丁烷和10
g异丁烷的混合物中共价键数目为13NA
3
例题讲解
【答案】B
A项,24
g
Mg、27
g
Al的物质的量均为1
mol,1个Mg原子和1个Al原子所含的质子数分别为12、13,故24
g镁与27
g
铝中含有的质子数分别为12
mol和13
mol,错误;
B项,等质量的氧气和臭氧,所含氧原子数相等,故电子数相同,正确;
C项,1个D2O分子含有10个中子,1个H2O分子含有8个中子,1
mol重水与1
mol水中含有的中子数之比为10∶8(5∶4),错误;
D项,1个乙烷分子中含有7个共价键,而1个乙烯分子中含有6个共价键,故1
mol乙烷与1
mol乙烯中,含有的化学键数之比为7∶6,错误。
(2018·全国卷Ⅲ)下列叙述正确的是(
)
A.24
g
镁与27
g
铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1
mol
重水与1
mol
水中,中子数比为2∶1
D.1
mol
乙烷和1
mol
乙烯中,化学键数相同
4
例题讲解
【答案】B
A项,根据信息,n[Fe(OH)3]=n(FeCl3)=
,由于Fe(OH)3胶体粒子是若干个Fe(OH)3的集合体,所以最终得到的Fe(OH)3胶体粒子数小于0.1NA
,错误;B项,标准状况下,22.4
L氩气(Ar)的物质的量为
,含有的质子数为18NA
,正确;C项,92.0
g甘油的物质的量为
,每个甘油分子含有3个羟基,所以1
mol甘油含有的羟基数为3.0NA,错误;D项,CH4与Cl2发生取代反应生成的有机物除了CH3Cl以外,还有CH2Cl2、CHCl3和CCl4,生成的CH3Cl分子数小于1.0NA,错误。
(2018·全国卷Ⅰ)NA是阿伏加德罗常数的值。下列说法正确的是(
)
A.16.25
g
FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.22.4
L(标准状况)氩气含有的质子数为18NA
C.92.0
g甘油(丙三醇)中含有羟基数为1.0NA
D.1.0
mol
CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
5
https://www.21cnjy.com/help/help_extract.php
人教版
高一上
知识清单
一、物质的量
1.物质的量(n)
(1)概念:表示含有一定数目粒子的集合体,单位为
mol。
(2)数值:1
mol
粒子集合体所含的粒子数与
0.012
kg-12
C
中所含的碳原子数相同。
(3)描述对象:微观粒子或微观粒子的特定组合。
如电子、质子、中子、分子、原子、离子等
如原子团、官能团等
物质的量的单位后面应为确切的微粒名称;如
1
mol
氢(不确切)和
1
mol
小麦(宏观物质)的说法都不对。
注意
2.阿伏加德罗常数(NA)
(1)概念:1
mol
任何粒子所含的微粒数,通常用
6.02×1023
mol-1
表示。
(2)数值:与0.012
kg
12
C中所含的碳原子数相同,均为
6.02×1023
。
(3)物质的量、微粒数(N)与阿伏加德罗常数的关系为
。
知识清单
3.摩尔质量(M)
(1)概念:单位物质的量的物质所具有的质量,常用单位为
g/mol。
(2)数值:与对应微粒的相对分子(原子)质量相同。
(3)物质的量、物质的质量与摩尔质量的关系为
。
摩尔质量(单位为g·mol-1)、相对分子(或原子)质量(单位为1)、1
mol物质的质量
(单位为g)在数值上是相同的,但单位不同。如H2,其摩尔质量为2
g·mol-1,相对分子质量为2,1
mol该物质的质量为2
g。
注意
二、气体摩尔体积(Vm)
1.概念:一定温度和压强下,单位物质的量的气体所占有的体积,常用单位为
L·mol-1。
2.影响因素:气体摩尔体积的数值取决于温度和压强。
知识清单
3.
特例:标准状况(0
℃,101
kPa)下,Vm
为
22.4
L·mol-1。
4.
气体摩尔体积与物质的量、气体体积之间的关系为
。
使用对象必须是气体,单一或混合气体都可以。如水、酒精、SO3、CCl4等在标准状况下不是气体,不能用气体摩尔体积计算。
注意
三、物质的量浓度(c)
1.
概念:表示单位体积溶液里所含溶质的物质的量,常用单位为mol/L。
2.
表达式:
。
①表达式中的“V”指溶液的体积。②对于一定浓度的溶液,其浓度、密度、质量分数与所取溶液体积无关,但溶质的质量、物质的量与所取溶液体积有关。
注意
知识清单
3.
判断某些溶液中的溶质
(1)含结晶水的物质:如CuSO4·5H2O溶于水溶质为CuSO4。
(2)与水反应的物质:如Na、Na2O、Na2O2与水反应溶质为NaOH,SO3与水反应溶质为H2SO4,NO2与水反应溶质为HNO3。
(3)特殊物质:如NH3溶于水溶质为NH3·H2O,但计算物质的量浓度时还是以NH3作为溶质来计算。
4.物质的量浓度的相关计算
(1)简单计算:
。
(2)溶液稀释的计算:①稀释前后溶质的物质的量保持不变,即
c1V1=c2V2
;②溶液质量守恒,即m(稀)=m(浓)+m(水)。(体积一般不守恒)
(3)溶液混合的计算:混合前后溶质的物质的量保持不变,即c1·V1+c2·V2=c(混)·V(混)
知识清单
(4)物质的量浓度与质量分数的关系
体积为V
L,密度为ρ
g·cm-3的溶液,含有溶质的摩尔质量为M
g·mol-1,溶质的质量分数为w,则物质的量浓度c
与质量分数w
的关系如下:
表达式中各个物理量的单位,尤其是溶液的密度ρ
的单位是
g·cm-3。
注意
即
知识清单
四、以物质的量为核心的各个化学计量之间的关系
知识清单
五、在关于物质的量计算中的几类“陷阱”
1.物质的组成和结构
(1)特殊物质中所含的微粒数目。如He、Ne等稀有气体,D2O,OH-
与—OH等。
(2)物质所含化学键的数目。如白磷(P4)、
CnH2n+2中分别
含有6、(3n+1)个化学键。
(3)常见最简式相同的物质。如NO2和N2O4、乙烯和丙烯、O2和O3等
(4)摩尔质量相同的物质。如N2、CO、C2H4等。
2.物质的状态和条件
(1)标准状况(0
℃,101
KPa)下,非气态物质有H2O、SO3、戊烷、CHCl3、HF、苯等。
(2)物质的质量、摩尔质量、微粒个数不受温度、压强的影响。
知识清单
3.电解质溶液中的粒子数目
是否存在弱电解质的电离或盐类的水解;已知浓度,是否指明体积,用好公式
n=cV;在判断溶液中微粒总数时,是否忽视溶剂水。
5.氧化还原反应中电子转移数目
如
Cl2
和
NaOH
反应中,Cl2既作氧化剂,又作还原剂;Fe和
HNO3反应,Fe不足,生成Fe3+,Fe过量,生成Fe2+;向FeI2溶液中通入Cl2,Cl2首先氧化I-,再氧化Fe2+。
4.可逆反应和特殊反应
(1)常见可逆反应:N2+3H2
2NH3
,NH3+H2O
NH3·H2O
NH4++OH-
,2SO2+O2
2SO3
,Cl2+H2O
HCl+HClO,
2NO2
N2O4
,H2+I2
2HI
(2)特殊反应:如常温下,铁、铝遇浓硫酸、浓硝酸发生“钝化”。
例题讲解
【答案】C
A项,标准状况下,22.4
L氟气(F2)的物质的量为1
mol,因为1个氟原子中含有7个质子,所以1
mol氟气中含有的质子数为1
mol×9×2×NA=18NA,错误;
B项,该反应为H2+I2
2HI,为可逆反应,充分反应后生成的碘化氢的物质的量小于2
mol,即分子数小于2NA,正确;
C项,该反应为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,阴阳两极产生的气体的物质的量相等,若气体总质量为73
g,则产生的H2和Cl2的无质量均为1
mol,根据2Cl--2e-=Cl2,转移的电子数为2NA,错误;D项,溴化铵水溶液中存在电荷守恒,即n(NH4+)+n(H+)=n(Br-)+n(OH-),由于溶液中的NH4+能水解,Br-不水解,而n(Br-)=1
L×1
mol·L-1=1
mol,所以该溶液中NH4+与H+离子数之和大于NA,正确。
(2021·河北)NA是阿伏加德罗常数的值,下列说法错误的是(
)
A.
22.4
L(标准状况)氟气所含的质子数为18NA
B.
1mol碘蒸气和1mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA
C.
电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为NA
D.1
L
1mol·L-1溴化铵水溶液中NH4+
与H+离子数之和大于NA
1
例题讲解
【答案】CD
A项,由
可知,氮气的数目为
,1个氮气分子中含有14个中子,所以共有14NA个中子,错误;
B项,1个重水(D2O)分子和1个水(H2O)分子含有的质子数都为10,所以1
mol重水和1
mol水含有的质子数均为10NA,错误;
C项,根据
,12
g石墨烯(C60)和12
g金刚石中碳原子的数目均为
NA
,正确;D项
,该溶液中NaCl的物质的量为1
L×1
mol·L?1=1
mol,1个
NaCl中含有的电子数为11+17=28,则共含有28NA个电子,正确。
(2020
·全国卷Ⅲ)NA是阿伏加德罗常数的值。下列说法正确的是(
)
A.22.4
L(标准状况)氮气中含有7NA个中子
B.1
mol
重水比1
mol
水多NA个质子
C.12
g
石墨烯和12
g金刚石均含有NA个碳原子
D.1
L
1
mol·L?1
NaCl溶液含有28NA个电子
2
例题讲解
【答案】B
A项,1个3He分子中含有1个中子,3
g
3He的物质的量为
,即含有NA个中子,
正确;B项,根据题干数据,n(Na3PO3)=1
L×0.1
mol·L-1=0.1
mol,由于溶液中的PO33-会发生水解,所以该溶液含有的PO43-数目小于0.1NA
,错误;C项,反应中Cr元素的化合价变化为6-3=3,1
mol
K2Cr2O7含有2
mol
Cr,所以转移电子的物质的量为6
mol,即电子数为6NA,正确;D项,正丁烷和异丁烷的化学式均为C4H10,则58
g该混合物的物质的量为
,而每个正丁烷分子或异丁烷分子的总键数为13,所以该混合物中共价键的物质的量为13
mol,即数目为13NA
,正确。
(2019·全国卷Ⅱ)已知NA是阿伏加德罗常数的值,下列说法错误的是(
)
A.3
g
3He含有的中子数为1NA
B.1
L
0.1
mol·L-1磷酸钠溶液含有的PO43-数目为0.1NA
C.1
mol
K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.48
g正丁烷和10
g异丁烷的混合物中共价键数目为13NA
3
例题讲解
【答案】B
A项,24
g
Mg、27
g
Al的物质的量均为1
mol,1个Mg原子和1个Al原子所含的质子数分别为12、13,故24
g镁与27
g
铝中含有的质子数分别为12
mol和13
mol,错误;
B项,等质量的氧气和臭氧,所含氧原子数相等,故电子数相同,正确;
C项,1个D2O分子含有10个中子,1个H2O分子含有8个中子,1
mol重水与1
mol水中含有的中子数之比为10∶8(5∶4),错误;
D项,1个乙烷分子中含有7个共价键,而1个乙烯分子中含有6个共价键,故1
mol乙烷与1
mol乙烯中,含有的化学键数之比为7∶6,错误。
(2018·全国卷Ⅲ)下列叙述正确的是(
)
A.24
g
镁与27
g
铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1
mol
重水与1
mol
水中,中子数比为2∶1
D.1
mol
乙烷和1
mol
乙烯中,化学键数相同
4
例题讲解
【答案】B
A项,根据信息,n[Fe(OH)3]=n(FeCl3)=
,由于Fe(OH)3胶体粒子是若干个Fe(OH)3的集合体,所以最终得到的Fe(OH)3胶体粒子数小于0.1NA
,错误;B项,标准状况下,22.4
L氩气(Ar)的物质的量为
,含有的质子数为18NA
,正确;C项,92.0
g甘油的物质的量为
,每个甘油分子含有3个羟基,所以1
mol甘油含有的羟基数为3.0NA,错误;D项,CH4与Cl2发生取代反应生成的有机物除了CH3Cl以外,还有CH2Cl2、CHCl3和CCl4,生成的CH3Cl分子数小于1.0NA,错误。
(2018·全国卷Ⅰ)NA是阿伏加德罗常数的值。下列说法正确的是(
)
A.16.25
g
FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.22.4
L(标准状况)氩气含有的质子数为18NA
C.92.0
g甘油(丙三醇)中含有羟基数为1.0NA
D.1.0
mol
CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
5
https://www.21cnjy.com/help/help_extract.php
