化学 必修1 1.2 第3课时 物质的量在化学实验中的应用
文档属性
| 名称 | 化学 必修1 1.2 第3课时 物质的量在化学实验中的应用 |
|
|
| 格式 | zip | ||
| 文件大小 | 1023.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-22 00:00:00 | ||
图片预览










文档简介
(共45张PPT)
预习全程设计
名师全程导学
案例全程导航
训练全程跟踪
第三
课时
物质
的量
在化
学实
验中
的应
用
第三课时
物质的量在化学实验中的应用
一、物质的量浓度
1.定义
里所含溶质B的 .
2.符号及单位
符号为 ,常用的单位为 (或 ).
单位体积溶液
物质的量
cB
mol/L
mol·L-1
3.公式: .
4.意义
若某溶质的物质的量浓度为1 mol/L,则表示1 L 中含有 溶质.
溶液
1 mol
表示溶液组成的方法除物质的量浓度外,还有哪些
方法?
提示:还有溶质的质量分数、体积比浓度等.
二、一定物质的量浓度溶液的配制
以配制100 mL 1.00 mol/L NaCl溶液为例:
1.主要仪器
电子天平或托盘天平、 、烧杯、
、 、 等.
100 mL容量瓶
玻璃棒
量筒
胶头滴管
2.配制步骤
(1)计算:根据nB=cB·V可知n(NaCl)= mol,则m(NaCl)
= g.
(2)称量:若用托盘天平可准确称取NaCl固体 g.
(3)溶解:将称好的NaCl固体放入 中,用适量蒸馏水溶
解,用 搅拌,并冷却至室温.
(4)移液:将烧杯中的溶液用 引流转移到 中.
玻璃棒
0.1
5.85
5.9
烧杯
容量瓶
玻璃棒
(5)洗涤:用蒸馏水洗涤烧杯内壁 次,并将洗涤液都注
入 中,轻轻摇动 ,使溶液混合均匀.
(6)定容:将蒸馏水注入容量瓶,当液面
时,改用 滴加蒸馏水至
.
1~2 cm
2~3
容量瓶
容量瓶
离容量瓶颈刻度线
胶头滴管
液面与刻
度线相切
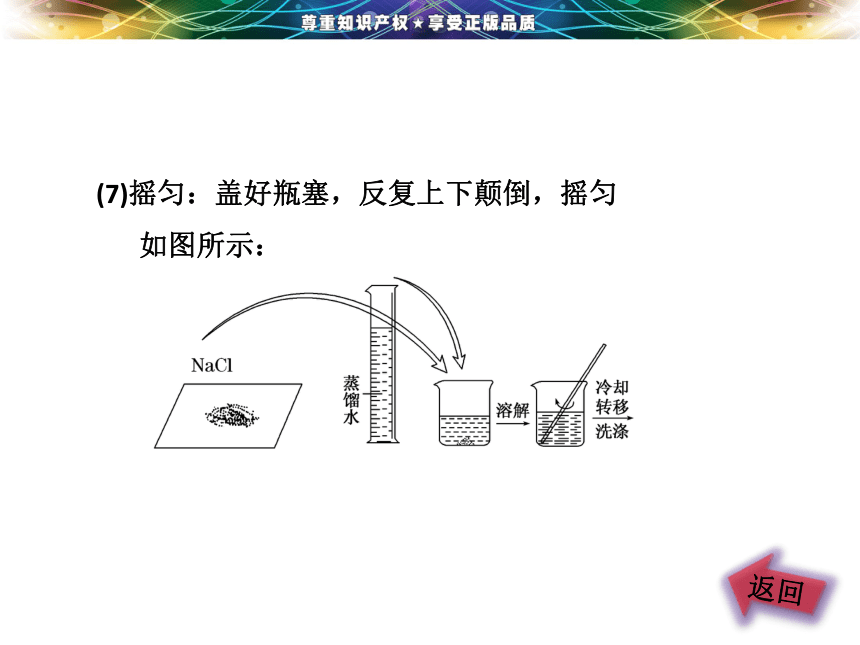
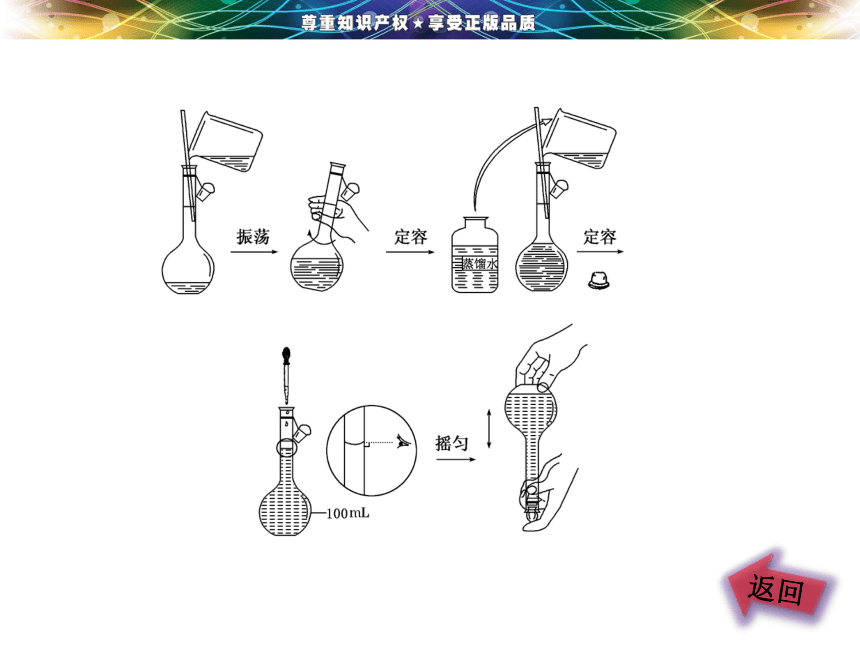
(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀
如图所示:
(1)用普通的托盘天平能否准确称出5.85 g的NaCl固体?
(2)在配制溶液时,若有溶液洒到容量瓶外或定容时加水过多,应如何处理?
提示:(1)不能,因一般托盘天平的精确度为0.1 g,所以不能测出0.01 g的物品来.
(2)只能重新配制.
1.58.5 g NaCl固体溶于1 L水中形成的溶液浓度为1
mol/L. ( )
提示:错误,因为溶液的体积不一定是1 L.
2.1 L溶液中含1 mol NaCl和1 mol KCl,则溶液的物质的
量浓度为2 mol/L. ( )
提示:错误,因为在描述物质的量浓度时必须指明何种物质或粒子,可以说c(NaCl)=1 mol/L或c(Na+)=1 mol/L等.
3.50 mL 1 mol/L的NaCl溶液和50 mL 2mol/L的NaCl溶液相
混合,所得混合溶液的体积一定等于100 mL. ( )
提示:错误,因为两溶液(不同溶质或同一溶质但不同浓度)混合时,体积一般不等于混合前两溶液的体积和.
4.容量瓶上标注的内容有使用温度、容积及刻度线.( )
提示:正确.
5.配制溶液时所需的烧杯,容量瓶等必须是内壁干燥的.
( )
提示:错误,因为在烧杯中溶解固体或稀释浓溶液以及在容量瓶中配制溶液时都需要加水.
6.两溶液混合前后,溶质的总质量一定保持不变.( )
提示:错误,因为两溶液混合时可能发生化学反应,若生成沉淀或放出气体都会使溶质质量减小.
一、容量瓶的使用
1.容量瓶的标注内容
温度、容积、刻度线.只有在指定温度下,容量瓶的容积才是标准的.常用规格有100 mL、250 mL、500 mL及1000 mL.
2.使用容量瓶的注意事项
(1)容量瓶瓶口配有磨口玻璃塞或塑料塞.使用前,除洗涤
外,还应检查容量瓶是否完好,检验容量瓶是否漏液.检漏方法:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出.如果不漏水,将瓶正立并将瓶塞旋转180°后塞紧,仍把瓶倒立过来,再检查是否漏水.
(2)只用于配制溶液,不能直接在容量瓶中溶解或稀释,容量
瓶也不能作为反应容器,且不能长期贮存溶液.
(3)向容量瓶中注入液体时,应沿玻璃棒注入,且玻璃棒下端
应靠在容量瓶刻度线以下的内壁上,以防注入操作时液体流出,造成溶质损失.
(4)溶液注入容量瓶前需恢复到常温,因为溶质在烧杯内稀释
或溶解时会吸热或放热,而容量瓶必须在常温下使用.
(5)用容量瓶不能配制任意体积的一定物质的量浓度的溶液,
这是因为容量瓶的规格是固定的,配制溶液时要根据所需溶液的体积选择合适的容量瓶.
(6)读数时,要使视线与瓶内凹液面的最低处相切.
(7)洗涤容量瓶后留在瓶内的少量水不必烘干除去,因为最后
定容时也要加水.
使用容量瓶时其规格应与所配溶液的体积相等,如果不等,应选择略大于这种规格的容量瓶,如配制480 mL某浓度的溶液应选取500 mL的容量瓶,配制相应浓度的500 mL的溶液.
2.误差分析
配制一定浓度的NaOH溶液,可能出现的误差,如下表:
能引起误差的一些操作 因变量 c(mol/L)
m V
称量前小烧杯内有水 - - 不变
称量时间过长 减小 - 偏低
用滤纸称NaOH 减小 - 偏低
能引起误差的一些操作 因变量 c(mol/L)
m V
向容量瓶注液时少量流出 减小 - 偏低
未洗烧杯和玻璃棒 减小 - 偏低
未冷至室温就注入定容 - 减小 偏高
定容时水多用滴管吸出 减小 - 偏低
定容摇匀时液面下降再加水 - 增大 偏低
定容后经振荡、摇匀、
静置液面下降 - - 不变
定容时俯视读数(读刻度) - 减小 偏高
定容时仰视读刻度 - 增大 偏低
(1)仰视刻度线(图1).由于操作时是以刻度线为基准加水,从下向上看,最先看见的是刻度线,刻度线低于液面的实际刻度,故加水量偏多,导致溶液体积偏大,结果偏低.
(2)俯视刻度线(图2).恰好相反,刻度线高于液面的实际读数,使得加水量偏小,结果偏高.
3.稀释定律
(1)稀释前后溶质的物质的量不变,即c(浓溶液)×V(浓溶
液)=c(稀溶液)×V(稀溶液)或c1×V1+c2×V2=c(总)×V(总)——c1、c2和V1、V2分别是混合前溶液的物质的量浓度和体积,c(总)、V(总)是混合溶液的物质的量浓度和体积——(用稀溶液稀释).
(2)稀释前后溶质的质量不变,故m(浓)·w(浓)
=m(稀)·w(稀)或m1+m2=m(总)·w(总).
考查点一 有关物质的量浓度的计算———————
[例1] 下列溶液中物质的量浓度为1 mol/L的是 ( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1的浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液
体积为250 mL
[答案] D
下列溶液中的c(Cl-)与50 mL 1 mol/L氯化铝溶液中的
c(Cl-)相等的是 ( )
A.150 mL 1 mol/L氯化钠溶液
B.75 mL 2 mol/L氯化铵溶液
C.150 mL 1 mol/L氯化钾溶液
D.75 mL 1 mol/L氯化铁溶液
答案:D
解析:溶液中离子浓度的大小取决于溶质的组成和溶质的浓度.与溶液的体积大小无关.1 mol/L氯化铝溶液中c(Cl-)为3 mol/L,而选项A和C的溶液中c(Cl-)均为1 mol/L,选项B的溶液中的c(Cl-)为2 mol/L.
考查点二 一定物质的量浓度溶液的配制—————
[例2] 用18 mol/L的硫酸配制100 mL 1.0 mol/L的硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)________.所需浓硫酸的体积为________.
(2)将量筒中浓硫酸转移至烧杯中的操作:________.
(3)配制该溶液中玻璃棒的作用①________________,
②______________.
(4)下列操作,使溶液物质的量浓度偏低的是________.
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后未经干燥处理
C.转移过程中有少量溶液溅出
D.加水时,水的量超过了刻度线
E.摇匀后立即观察,发现溶液未达刻度线,再用滴管加几
滴蒸馏水至刻度线
[解析] (1)用18 mol/L H2SO4配制1.0 mol/L H2SO4,实际是稀释问题的计算及物质的量浓度溶液配制实验操作.根据稀释定律 c1V1=c2V2,可计算所需18 mol/L浓H2SO4的体积V1=c2V2/c1=1.0 mol/L×100 mL÷18 mol/L=5.6 mL.该体积的液体用10 mL量筒量取比用100 mL量筒量取误差要小,故应选E,不能选A.
(2)将浓硫酸沿器壁慢慢流入烧杯中,不断用玻璃棒搅拌及时散发热量.
(3)玻璃棒在该实验中作用:搅拌和引流.
(4)A、C均未将溶质全部移至容量瓶,D、E加水过多等于稀释,均使浓度偏低;B不影响配制结果.
[答案] (1)GECHF或EGCHF 5.6 mL
(2)使浓硫酸沿烧杯慢慢流下,同时用玻璃棒不断搅拌
(3)搅拌 引流 (4)ACDE
下列情况会使所配溶液中溶质的物质的量浓度偏高的是
________(填序号.)
A.某同学观察液面的情况如图所示
B.未用蒸馏水洗涤烧杯内壁和玻璃棒
C.加蒸馏水时,不慎超过了刻度线
D.砝码上沾有杂质
E.容量瓶使用前内壁沾有水珠
解析: A.俯视使V减小,故使浓度偏高; B. 未进行洗涤,使n减小,故使浓度偏低;C.使V增大,故浓度偏小;D.使m增大,故使浓度偏大;E.无影响.
答案: AD
预习全程设计
名师全程导学
案例全程导航
训练全程跟踪
第三
课时
物质
的量
在化
学实
验中
的应
用
第三课时
物质的量在化学实验中的应用
一、物质的量浓度
1.定义
里所含溶质B的 .
2.符号及单位
符号为 ,常用的单位为 (或 ).
单位体积溶液
物质的量
cB
mol/L
mol·L-1
3.公式: .
4.意义
若某溶质的物质的量浓度为1 mol/L,则表示1 L 中含有 溶质.
溶液
1 mol
表示溶液组成的方法除物质的量浓度外,还有哪些
方法?
提示:还有溶质的质量分数、体积比浓度等.
二、一定物质的量浓度溶液的配制
以配制100 mL 1.00 mol/L NaCl溶液为例:
1.主要仪器
电子天平或托盘天平、 、烧杯、
、 、 等.
100 mL容量瓶
玻璃棒
量筒
胶头滴管
2.配制步骤
(1)计算:根据nB=cB·V可知n(NaCl)= mol,则m(NaCl)
= g.
(2)称量:若用托盘天平可准确称取NaCl固体 g.
(3)溶解:将称好的NaCl固体放入 中,用适量蒸馏水溶
解,用 搅拌,并冷却至室温.
(4)移液:将烧杯中的溶液用 引流转移到 中.
玻璃棒
0.1
5.85
5.9
烧杯
容量瓶
玻璃棒
(5)洗涤:用蒸馏水洗涤烧杯内壁 次,并将洗涤液都注
入 中,轻轻摇动 ,使溶液混合均匀.
(6)定容:将蒸馏水注入容量瓶,当液面
时,改用 滴加蒸馏水至
.
1~2 cm
2~3
容量瓶
容量瓶
离容量瓶颈刻度线
胶头滴管
液面与刻
度线相切
(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀
如图所示:
(1)用普通的托盘天平能否准确称出5.85 g的NaCl固体?
(2)在配制溶液时,若有溶液洒到容量瓶外或定容时加水过多,应如何处理?
提示:(1)不能,因一般托盘天平的精确度为0.1 g,所以不能测出0.01 g的物品来.
(2)只能重新配制.
1.58.5 g NaCl固体溶于1 L水中形成的溶液浓度为1
mol/L. ( )
提示:错误,因为溶液的体积不一定是1 L.
2.1 L溶液中含1 mol NaCl和1 mol KCl,则溶液的物质的
量浓度为2 mol/L. ( )
提示:错误,因为在描述物质的量浓度时必须指明何种物质或粒子,可以说c(NaCl)=1 mol/L或c(Na+)=1 mol/L等.
3.50 mL 1 mol/L的NaCl溶液和50 mL 2mol/L的NaCl溶液相
混合,所得混合溶液的体积一定等于100 mL. ( )
提示:错误,因为两溶液(不同溶质或同一溶质但不同浓度)混合时,体积一般不等于混合前两溶液的体积和.
4.容量瓶上标注的内容有使用温度、容积及刻度线.( )
提示:正确.
5.配制溶液时所需的烧杯,容量瓶等必须是内壁干燥的.
( )
提示:错误,因为在烧杯中溶解固体或稀释浓溶液以及在容量瓶中配制溶液时都需要加水.
6.两溶液混合前后,溶质的总质量一定保持不变.( )
提示:错误,因为两溶液混合时可能发生化学反应,若生成沉淀或放出气体都会使溶质质量减小.
一、容量瓶的使用
1.容量瓶的标注内容
温度、容积、刻度线.只有在指定温度下,容量瓶的容积才是标准的.常用规格有100 mL、250 mL、500 mL及1000 mL.
2.使用容量瓶的注意事项
(1)容量瓶瓶口配有磨口玻璃塞或塑料塞.使用前,除洗涤
外,还应检查容量瓶是否完好,检验容量瓶是否漏液.检漏方法:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出.如果不漏水,将瓶正立并将瓶塞旋转180°后塞紧,仍把瓶倒立过来,再检查是否漏水.
(2)只用于配制溶液,不能直接在容量瓶中溶解或稀释,容量
瓶也不能作为反应容器,且不能长期贮存溶液.
(3)向容量瓶中注入液体时,应沿玻璃棒注入,且玻璃棒下端
应靠在容量瓶刻度线以下的内壁上,以防注入操作时液体流出,造成溶质损失.
(4)溶液注入容量瓶前需恢复到常温,因为溶质在烧杯内稀释
或溶解时会吸热或放热,而容量瓶必须在常温下使用.
(5)用容量瓶不能配制任意体积的一定物质的量浓度的溶液,
这是因为容量瓶的规格是固定的,配制溶液时要根据所需溶液的体积选择合适的容量瓶.
(6)读数时,要使视线与瓶内凹液面的最低处相切.
(7)洗涤容量瓶后留在瓶内的少量水不必烘干除去,因为最后
定容时也要加水.
使用容量瓶时其规格应与所配溶液的体积相等,如果不等,应选择略大于这种规格的容量瓶,如配制480 mL某浓度的溶液应选取500 mL的容量瓶,配制相应浓度的500 mL的溶液.
2.误差分析
配制一定浓度的NaOH溶液,可能出现的误差,如下表:
能引起误差的一些操作 因变量 c(mol/L)
m V
称量前小烧杯内有水 - - 不变
称量时间过长 减小 - 偏低
用滤纸称NaOH 减小 - 偏低
能引起误差的一些操作 因变量 c(mol/L)
m V
向容量瓶注液时少量流出 减小 - 偏低
未洗烧杯和玻璃棒 减小 - 偏低
未冷至室温就注入定容 - 减小 偏高
定容时水多用滴管吸出 减小 - 偏低
定容摇匀时液面下降再加水 - 增大 偏低
定容后经振荡、摇匀、
静置液面下降 - - 不变
定容时俯视读数(读刻度) - 减小 偏高
定容时仰视读刻度 - 增大 偏低
(1)仰视刻度线(图1).由于操作时是以刻度线为基准加水,从下向上看,最先看见的是刻度线,刻度线低于液面的实际刻度,故加水量偏多,导致溶液体积偏大,结果偏低.
(2)俯视刻度线(图2).恰好相反,刻度线高于液面的实际读数,使得加水量偏小,结果偏高.
3.稀释定律
(1)稀释前后溶质的物质的量不变,即c(浓溶液)×V(浓溶
液)=c(稀溶液)×V(稀溶液)或c1×V1+c2×V2=c(总)×V(总)——c1、c2和V1、V2分别是混合前溶液的物质的量浓度和体积,c(总)、V(总)是混合溶液的物质的量浓度和体积——(用稀溶液稀释).
(2)稀释前后溶质的质量不变,故m(浓)·w(浓)
=m(稀)·w(稀)或m1+m2=m(总)·w(总).
考查点一 有关物质的量浓度的计算———————
[例1] 下列溶液中物质的量浓度为1 mol/L的是 ( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1的浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液
体积为250 mL
[答案] D
下列溶液中的c(Cl-)与50 mL 1 mol/L氯化铝溶液中的
c(Cl-)相等的是 ( )
A.150 mL 1 mol/L氯化钠溶液
B.75 mL 2 mol/L氯化铵溶液
C.150 mL 1 mol/L氯化钾溶液
D.75 mL 1 mol/L氯化铁溶液
答案:D
解析:溶液中离子浓度的大小取决于溶质的组成和溶质的浓度.与溶液的体积大小无关.1 mol/L氯化铝溶液中c(Cl-)为3 mol/L,而选项A和C的溶液中c(Cl-)均为1 mol/L,选项B的溶液中的c(Cl-)为2 mol/L.
考查点二 一定物质的量浓度溶液的配制—————
[例2] 用18 mol/L的硫酸配制100 mL 1.0 mol/L的硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)________.所需浓硫酸的体积为________.
(2)将量筒中浓硫酸转移至烧杯中的操作:________.
(3)配制该溶液中玻璃棒的作用①________________,
②______________.
(4)下列操作,使溶液物质的量浓度偏低的是________.
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后未经干燥处理
C.转移过程中有少量溶液溅出
D.加水时,水的量超过了刻度线
E.摇匀后立即观察,发现溶液未达刻度线,再用滴管加几
滴蒸馏水至刻度线
[解析] (1)用18 mol/L H2SO4配制1.0 mol/L H2SO4,实际是稀释问题的计算及物质的量浓度溶液配制实验操作.根据稀释定律 c1V1=c2V2,可计算所需18 mol/L浓H2SO4的体积V1=c2V2/c1=1.0 mol/L×100 mL÷18 mol/L=5.6 mL.该体积的液体用10 mL量筒量取比用100 mL量筒量取误差要小,故应选E,不能选A.
(2)将浓硫酸沿器壁慢慢流入烧杯中,不断用玻璃棒搅拌及时散发热量.
(3)玻璃棒在该实验中作用:搅拌和引流.
(4)A、C均未将溶质全部移至容量瓶,D、E加水过多等于稀释,均使浓度偏低;B不影响配制结果.
[答案] (1)GECHF或EGCHF 5.6 mL
(2)使浓硫酸沿烧杯慢慢流下,同时用玻璃棒不断搅拌
(3)搅拌 引流 (4)ACDE
下列情况会使所配溶液中溶质的物质的量浓度偏高的是
________(填序号.)
A.某同学观察液面的情况如图所示
B.未用蒸馏水洗涤烧杯内壁和玻璃棒
C.加蒸馏水时,不慎超过了刻度线
D.砝码上沾有杂质
E.容量瓶使用前内壁沾有水珠
解析: A.俯视使V减小,故使浓度偏高; B. 未进行洗涤,使n减小,故使浓度偏低;C.使V增大,故浓度偏小;D.使m增大,故使浓度偏大;E.无影响.
答案: AD
