化学 必修1 1.1 第2课时 蒸馏和萃取
文档属性
| 名称 | 化学 必修1 1.1 第2课时 蒸馏和萃取 |  | |
| 格式 | zip | ||
| 文件大小 | 996.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-22 20:53:09 | ||
图片预览











文档简介
(共49张PPT)
第二课时 蒸馏和萃取
预习全程设计
名师全程导学
案例全程导航
训练全程跟踪
第二课时
蒸馏和萃取
一、蒸馏
1.依据
利用混合物中各组分的量 不同,从而除去 、
或 的杂质.
2.主要仪器
、 、 、 、 、 .
沸点
易挥发
不挥发
难挥发
锥形瓶
铁架台(铁圈)
石棉网
蒸馏烧瓶
冷凝管
半角管
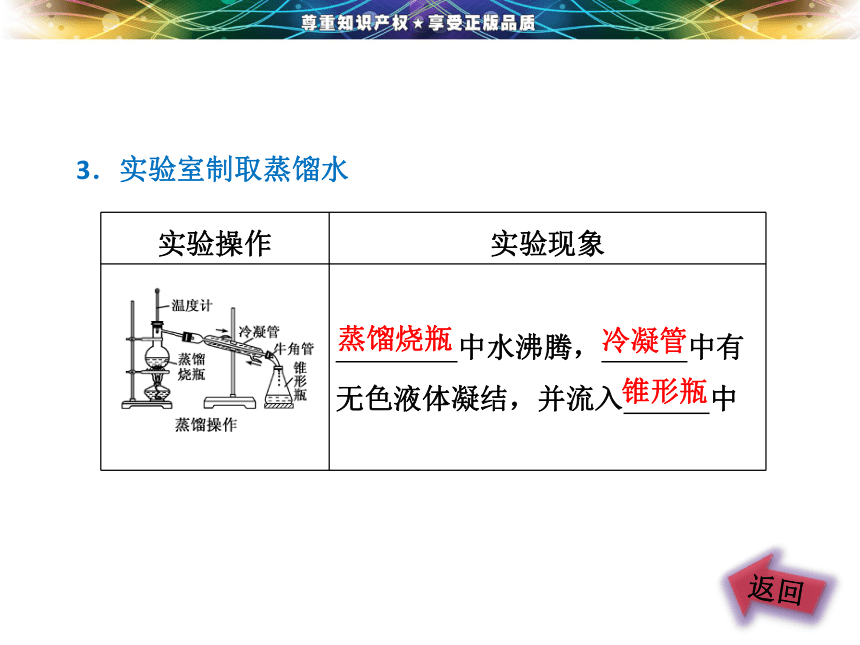
3.实验室制取蒸馏水
实验操作 实验现象
中水沸腾, 中有无色液体凝结,并流入 中
蒸馏烧瓶
冷凝管
锥形瓶
蒸馏装置中,冷凝管里冷却水的方向为何需低进高
出?
提示:若高进低出,冷却水不能充满冷凝管,与蒸气接触面积小,冷凝效果不佳.
4.自来水中Cl-的检验
(1)试剂: ;
(2)现象:生成 ;
(3)化学方程式(如向NaCl溶液中滴加AgNO3溶液):
;
稀HNO3和AgNO3溶液
NaCl+AgNO3===AgCl↓+NaNO3
白色沉淀
(4)结论:某溶液 白色沉淀
沉淀 ,证明原溶液中
有Cl-.
不消失
二、萃取与分液
1.萃取的原理
利用溶质在 的两种溶剂里 的不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液里提取出来的操作.萃取的主要仪器: .
互不相溶
溶解度
分液漏斗
(1)萃取剂必须具备的基本条件有哪些?
(2)从碘水中提取碘时,能否用酒精代替四氯化碳?
提示:(1)萃取剂与原溶剂互不相溶;溶质在萃取剂中的溶解度远大于其在原溶剂中的溶解度.(2)不能,因为酒精与水互溶.
2.分液
把 的两种液体分开的操作.该操作一般都是与 配合使用的.
互不相溶
萃取
3.萃取操作实验(用四氯化碳萃取碘水中的碘)
实验步骤 实验现象及结论
加萃取液 加四氯化碳时,四氯化碳不溶于水,密度比水 ,在 层
振荡萃取
用力振荡的目的是
使水
与四氯化碳充分混合
大
下
实验步骤 实验现象及结论
静止分层
静置后四氯化碳层呈 ,水层黄色变浅或接近无色
分液
下层液体沿烧杯壁流下,上层液体从分液漏斗 倒出
变紫色
上口
1.检验自来水中的Cl-时,可先用稀盐酸酸化,再加
AgNO3溶液. ( )
提示:错误,因盐酸中含Cl-,干扰了自来水中Cl-的检验.
2.蒸发和蒸馏都是利用了混合物各组分沸点的不同.( )
提示:正确.
3.分液时,两层液体可先后从下端流到两容器中. ( )
提示:错误,上层液体应从上口倒出.
4 .分液时,将分液漏斗上口的玻璃塞打开的目的是为了平
衡分液漏斗内外的气压,便于液体流下. ( )
提示:正确.
5.食盐水的蒸发和自来水的蒸馏都能用到的仪器有铁架台、
酒精灯、石棉网等. ( )
提示:错误,因为蒸发食盐水时所用的蒸发皿可直接加热,不用垫石棉网.
6.使用分液漏斗前必须先查漏. ( )
提示:正确.
一、蒸馏与萃取操作的注意事项
1.蒸馏操作注意事项
2.萃取操作注意事项
(1)分液漏斗的使用
分液漏斗使用前必须检查是否漏液,方法是:在分液漏斗中注入少量的水,塞上瓶塞,倒置看是否漏水,若不漏水,正立后把瓶塞旋转180°,再倒置看是否漏水.
(2)萃取剂必须具备的三点性质
①萃取剂和水互不相溶;
②萃取剂和溶质不发生反应;
③溶质在萃取剂中的溶解度远大于在水中的溶解度.
(3)分液操作的注意事项
①振荡时,要不时旋开活塞放气,以防止分液漏斗内压强过大引起危险.
②分液时要将玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,保证漏斗内与外界大气相通,同时漏斗下端管口要紧贴烧杯内壁,从而使液体顺利流下.
③下层液体要从下口放出,上层液体要从上口倒出.
分液既是萃取操作中的一个步骤,也是一个独立的分离混合物的方法,工业生产和实验室中经常利用萃取分液的方法分离提纯物质,如分离水和CCl4的混合物时可用分液的方法.
二、物质的检验
1.物质的检验方法
(1)物理方法
利用物质的颜色、气味、溶解性加以区别,如区分CuSO4溶液和Na2SO4溶液可根据其颜色,区分Na2CO3和CaCO3可根据其溶解性.
(2)化学方法
常用指示剂、点燃、加热、加试剂等方法,如区分盐酸、NaOH溶液和NaCl溶液,可用石蕊试液.
3.常见离子的检验
(1)当试样是固体时,需要先将少量试样配成溶液.
(2)每次应取少量溶液进行检验.
考查点一 蒸 馏———————————————
[例1] 在蒸馏实验中,下列说法不正确的是 ( )
A.温度计的水银球应放在蒸馏烧瓶的支管口处
B.冷凝管中冷却水的流向是从上向下流
C.加入沸石的作用是防止液体暴沸
D.加热时,蒸馏烧瓶下面要垫石棉网
.
[解析] 在蒸馏实验中,要测定的是馏分蒸气的温度,故A正确.冷凝管中冷却水的流向采用“逆流”原理,应从下向上流,所以B错误.C、D正确.
[答案] B
[关键一点]
“蒸馏”中的常考点为温度计水银球的位置及冷却水的流向.
现有一瓶物质甲和乙的混合物,已知甲和乙的某些
性质如下:
物质 分子式 熔点(℃) 沸点(℃) 密度(g/cm3) 水中溶解性
甲 C3H6O2 -98 57.5 0.93 可溶
乙 C4H8O2 -84 77 0.90 可溶
据此,将甲和乙互相分离的最佳方法是 ( )
A.萃取法 B.升华法
C.蒸馏法 D.分液法
解析:升华法显然不行,因甲、乙两物质均溶于水,所以用分液法和萃取法也不行;故只能根据沸点的不同,采用蒸馏的方法最适合.
答案:C
考查点二 萃取与分液—————————————
[例2] 在使用分液漏斗进行分液时,正确的操作是( )
A.上层液体经漏斗下方活塞放出
B.分离液体时,将漏斗拿在手上进行分离
C.分离液体时,分液漏斗上的小孔与大气相通时打开活塞
D.分液漏斗中盛装的是液体,振荡后不必扭开旋塞把气体
放出
[答案] C
[解析] 为确保分离效果,下层液体由漏斗下口放出,上层液体要经漏斗上口倒出.振荡时分液漏斗要拿在手里,分离液体时,分液漏斗要放置在铁架台的铁圈上.分液时,磨口塞上的凹槽与漏斗口颈上的小孔要对准,这时漏斗内外的空气相通,压强相等,漏斗里的液体才能够顺利流出.振荡分液漏斗时可能有气体产生,应及时扭开旋塞放出,以降低漏斗内的压强.
[关键一点]
萃取溴水、碘水中的溴、碘,常用苯、四氯化碳、汽油作萃取剂.
选择萃取剂将碘从碘水中萃取出来,这种萃取剂
应具备的性质是 ( )
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水的密度大
D.不溶于水,且必须比水的密度小
解析:假设要用溶剂A将溶质X从溶剂B中萃取出来,A应具备的基本性质是:①与B互不相溶;②X在A中的溶解度远大于在B中的溶解度;③X与A不发生化学反应.
答案:B
考查点三 物质的检验—————————————
[例3] 有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成.
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生.
③取少量②的溶液滴入稀硫酸,有白色沉淀产生.
④另取少量②的溶液滴入AgNO3溶液,有白色沉淀生成.
(1)根据上述实验现象,判断原白色粉末的组成成分是(写名称)_______________________________________________.
(2)写出实验步骤①和③中有关化学反应的方程式:
____________________________________________________________________________________________________________________________________________________________.
[答案] (1)硝酸钡、氯化钙、碳酸钾
(2)Ba(NO3)2+K2CO3===BaCO3↓+2KNO3
CaCl2+K2CO3===CaCO3↓+2KCl
Ba(NO3)2+H2SO4===BaSO4↓+2HNO3
答案:稀盐酸(或稀HNO3)
BaCl2[或Ba(NO3)2或Ba(OH)2]
第二课时 蒸馏和萃取
预习全程设计
名师全程导学
案例全程导航
训练全程跟踪
第二课时
蒸馏和萃取
一、蒸馏
1.依据
利用混合物中各组分的量 不同,从而除去 、
或 的杂质.
2.主要仪器
、 、 、 、 、 .
沸点
易挥发
不挥发
难挥发
锥形瓶
铁架台(铁圈)
石棉网
蒸馏烧瓶
冷凝管
半角管
3.实验室制取蒸馏水
实验操作 实验现象
中水沸腾, 中有无色液体凝结,并流入 中
蒸馏烧瓶
冷凝管
锥形瓶
蒸馏装置中,冷凝管里冷却水的方向为何需低进高
出?
提示:若高进低出,冷却水不能充满冷凝管,与蒸气接触面积小,冷凝效果不佳.
4.自来水中Cl-的检验
(1)试剂: ;
(2)现象:生成 ;
(3)化学方程式(如向NaCl溶液中滴加AgNO3溶液):
;
稀HNO3和AgNO3溶液
NaCl+AgNO3===AgCl↓+NaNO3
白色沉淀
(4)结论:某溶液 白色沉淀
沉淀 ,证明原溶液中
有Cl-.
不消失
二、萃取与分液
1.萃取的原理
利用溶质在 的两种溶剂里 的不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液里提取出来的操作.萃取的主要仪器: .
互不相溶
溶解度
分液漏斗
(1)萃取剂必须具备的基本条件有哪些?
(2)从碘水中提取碘时,能否用酒精代替四氯化碳?
提示:(1)萃取剂与原溶剂互不相溶;溶质在萃取剂中的溶解度远大于其在原溶剂中的溶解度.(2)不能,因为酒精与水互溶.
2.分液
把 的两种液体分开的操作.该操作一般都是与 配合使用的.
互不相溶
萃取
3.萃取操作实验(用四氯化碳萃取碘水中的碘)
实验步骤 实验现象及结论
加萃取液 加四氯化碳时,四氯化碳不溶于水,密度比水 ,在 层
振荡萃取
用力振荡的目的是
使水
与四氯化碳充分混合
大
下
实验步骤 实验现象及结论
静止分层
静置后四氯化碳层呈 ,水层黄色变浅或接近无色
分液
下层液体沿烧杯壁流下,上层液体从分液漏斗 倒出
变紫色
上口
1.检验自来水中的Cl-时,可先用稀盐酸酸化,再加
AgNO3溶液. ( )
提示:错误,因盐酸中含Cl-,干扰了自来水中Cl-的检验.
2.蒸发和蒸馏都是利用了混合物各组分沸点的不同.( )
提示:正确.
3.分液时,两层液体可先后从下端流到两容器中. ( )
提示:错误,上层液体应从上口倒出.
4 .分液时,将分液漏斗上口的玻璃塞打开的目的是为了平
衡分液漏斗内外的气压,便于液体流下. ( )
提示:正确.
5.食盐水的蒸发和自来水的蒸馏都能用到的仪器有铁架台、
酒精灯、石棉网等. ( )
提示:错误,因为蒸发食盐水时所用的蒸发皿可直接加热,不用垫石棉网.
6.使用分液漏斗前必须先查漏. ( )
提示:正确.
一、蒸馏与萃取操作的注意事项
1.蒸馏操作注意事项
2.萃取操作注意事项
(1)分液漏斗的使用
分液漏斗使用前必须检查是否漏液,方法是:在分液漏斗中注入少量的水,塞上瓶塞,倒置看是否漏水,若不漏水,正立后把瓶塞旋转180°,再倒置看是否漏水.
(2)萃取剂必须具备的三点性质
①萃取剂和水互不相溶;
②萃取剂和溶质不发生反应;
③溶质在萃取剂中的溶解度远大于在水中的溶解度.
(3)分液操作的注意事项
①振荡时,要不时旋开活塞放气,以防止分液漏斗内压强过大引起危险.
②分液时要将玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,保证漏斗内与外界大气相通,同时漏斗下端管口要紧贴烧杯内壁,从而使液体顺利流下.
③下层液体要从下口放出,上层液体要从上口倒出.
分液既是萃取操作中的一个步骤,也是一个独立的分离混合物的方法,工业生产和实验室中经常利用萃取分液的方法分离提纯物质,如分离水和CCl4的混合物时可用分液的方法.
二、物质的检验
1.物质的检验方法
(1)物理方法
利用物质的颜色、气味、溶解性加以区别,如区分CuSO4溶液和Na2SO4溶液可根据其颜色,区分Na2CO3和CaCO3可根据其溶解性.
(2)化学方法
常用指示剂、点燃、加热、加试剂等方法,如区分盐酸、NaOH溶液和NaCl溶液,可用石蕊试液.
3.常见离子的检验
(1)当试样是固体时,需要先将少量试样配成溶液.
(2)每次应取少量溶液进行检验.
考查点一 蒸 馏———————————————
[例1] 在蒸馏实验中,下列说法不正确的是 ( )
A.温度计的水银球应放在蒸馏烧瓶的支管口处
B.冷凝管中冷却水的流向是从上向下流
C.加入沸石的作用是防止液体暴沸
D.加热时,蒸馏烧瓶下面要垫石棉网
.
[解析] 在蒸馏实验中,要测定的是馏分蒸气的温度,故A正确.冷凝管中冷却水的流向采用“逆流”原理,应从下向上流,所以B错误.C、D正确.
[答案] B
[关键一点]
“蒸馏”中的常考点为温度计水银球的位置及冷却水的流向.
现有一瓶物质甲和乙的混合物,已知甲和乙的某些
性质如下:
物质 分子式 熔点(℃) 沸点(℃) 密度(g/cm3) 水中溶解性
甲 C3H6O2 -98 57.5 0.93 可溶
乙 C4H8O2 -84 77 0.90 可溶
据此,将甲和乙互相分离的最佳方法是 ( )
A.萃取法 B.升华法
C.蒸馏法 D.分液法
解析:升华法显然不行,因甲、乙两物质均溶于水,所以用分液法和萃取法也不行;故只能根据沸点的不同,采用蒸馏的方法最适合.
答案:C
考查点二 萃取与分液—————————————
[例2] 在使用分液漏斗进行分液时,正确的操作是( )
A.上层液体经漏斗下方活塞放出
B.分离液体时,将漏斗拿在手上进行分离
C.分离液体时,分液漏斗上的小孔与大气相通时打开活塞
D.分液漏斗中盛装的是液体,振荡后不必扭开旋塞把气体
放出
[答案] C
[解析] 为确保分离效果,下层液体由漏斗下口放出,上层液体要经漏斗上口倒出.振荡时分液漏斗要拿在手里,分离液体时,分液漏斗要放置在铁架台的铁圈上.分液时,磨口塞上的凹槽与漏斗口颈上的小孔要对准,这时漏斗内外的空气相通,压强相等,漏斗里的液体才能够顺利流出.振荡分液漏斗时可能有气体产生,应及时扭开旋塞放出,以降低漏斗内的压强.
[关键一点]
萃取溴水、碘水中的溴、碘,常用苯、四氯化碳、汽油作萃取剂.
选择萃取剂将碘从碘水中萃取出来,这种萃取剂
应具备的性质是 ( )
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水的密度大
D.不溶于水,且必须比水的密度小
解析:假设要用溶剂A将溶质X从溶剂B中萃取出来,A应具备的基本性质是:①与B互不相溶;②X在A中的溶解度远大于在B中的溶解度;③X与A不发生化学反应.
答案:B
考查点三 物质的检验—————————————
[例3] 有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成.
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生.
③取少量②的溶液滴入稀硫酸,有白色沉淀产生.
④另取少量②的溶液滴入AgNO3溶液,有白色沉淀生成.
(1)根据上述实验现象,判断原白色粉末的组成成分是(写名称)_______________________________________________.
(2)写出实验步骤①和③中有关化学反应的方程式:
____________________________________________________________________________________________________________________________________________________________.
[答案] (1)硝酸钡、氯化钙、碳酸钾
(2)Ba(NO3)2+K2CO3===BaCO3↓+2KNO3
CaCl2+K2CO3===CaCO3↓+2KCl
Ba(NO3)2+H2SO4===BaSO4↓+2HNO3
答案:稀盐酸(或稀HNO3)
BaCl2[或Ba(NO3)2或Ba(OH)2]
