化学 必修1 4.4 第2课时 硫酸和硝酸的氧化性
文档属性
| 名称 | 化学 必修1 4.4 第2课时 硫酸和硝酸的氧化性 |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-22 20:53:09 | ||
图片预览











文档简介
(共52张PPT)
第二课时 硫酸和硝酸的氧化性
预习全程设计
名师全程导学
案例全程导航
训练全程跟踪
第二课时
硫酸和硝酸的氧化性
一、硫酸
1.稀硫酸——具有酸的通性
(1)与指示剂作用:能使紫色石蕊试液 .
(2)与活泼金属(如Zn、Fe)反应.
(3)与碱性氧化物(如CuO、Fe2O3)反应.
(4)与碱[如NaOH、Ca(OH)2]反应.
(5)与某些盐(如Na2CO3、BaCl2等)发生复分解反应.
变红
2.浓硫酸
(1)吸水性
将一瓶浓硫酸敞口放置在空气中,其质量将 ,密度将减小,浓度 ,体积增大.这是因为浓硫酸具有 性,在实验室里常用浓硫酸作 剂.
(2)脱水性
浓硫酸可以使有机化合物中的 元素按 的组成从有机物中“脱离”出来,结合成水分子.
减小
增大
氢、氧
吸水
干燥
水
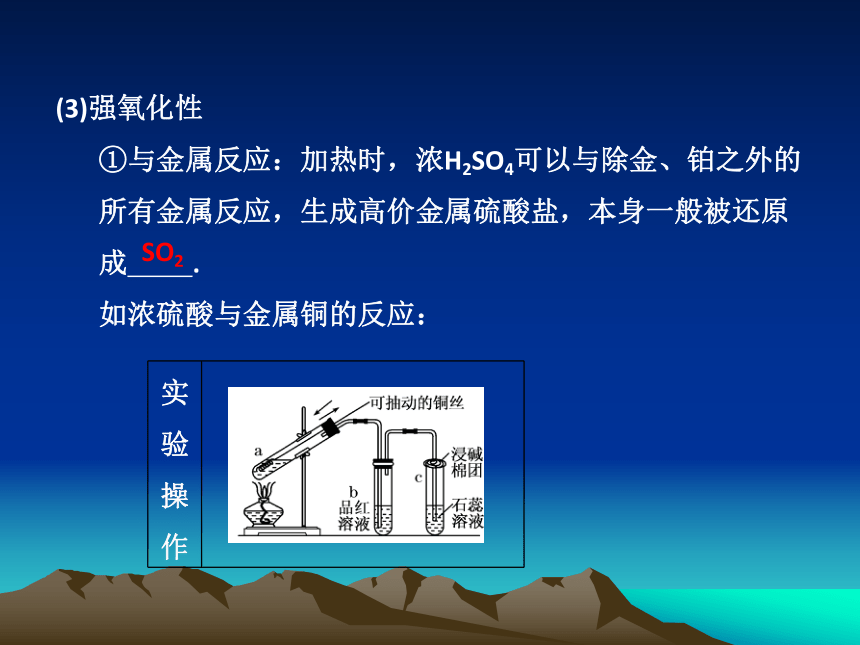
(3)强氧化性
①与金属反应:加热时,浓H2SO4可以与除金、铂之外的所有金属反应,生成高价金属硫酸盐,本身一般被还原成 .
如浓硫酸与金属铜的反应:
SO2
实验操作
实验现象 a试管中铜丝表面 ;
b试管中的品红溶液逐渐变为 ;
c试管中的紫色石蕊溶液逐渐变为 ;
将a试管里的溶液慢慢倒入水中,溶液变为 .
实验结论 Cu和浓H2SO4反应的化学方程式为:
.
有气泡冒出
蓝色
无色
红色
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
②常温下,冷的浓H2SO4能使Fe、Al发生 .
③与非金属反应
加热时与木炭反应的化学方程式为:
.
钝化
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
(1)Fe、Al被浓H2SO4钝化是化学变化吗?(2)浓H2SO4
与金属及非金属的反应中各表现了哪些性质.
提示:(1)是.常温下,Fe、Al的表面能被浓H2SO4氧化生成一层致密的氧化物薄膜,阻止了酸与内部金属的进一步反应,属于化学变化.
(2)与金属反应时,浓硫酸既表现氧化性也表现酸性;与非金属反应时,浓硫酸仅表现氧化性.
二、硝酸
1.与铜的反应
(1)铜与浓硝酸
化学方程式:
.
(2)铜与稀硝酸
化学方程式:
.
2.使铁、铝发生钝化
常温下,冷的浓硝酸能使 发生钝化.
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑
+2H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑
+4H2O
铁、铝
3.王水
王水是 和 按体积比 的混合物,能使一些不溶于硝酸的金属如 、 等溶解.
浓硝酸
浓盐酸
1∶3
金
铂
实验室中应如何保存浓HNO3
三、硫酸和硝酸的用途
1.硫酸和硝酸都是重要的 ,也是化学实验室里
必备的重要试剂,工业上可用于制化肥、农药、炸药、染料、盐类等.
2.硫酸还用于精炼 、金属加工前的酸洗及制取各种
酸,做干燥剂等.
化工原料
石油
挥发性
1.浓H2SO4、浓HNO3敞口放置于空气中,浓度都会变小,原
理相同. ( )
提示:错误,原理不同,浓H2SO4因其吸水性浓度变小,而浓HNO3是因其挥发性浓度变小.
2.浓H2SO4的脱水性与吸水性类似,都是将物质中的H2O吸
出来. ( )
提示:错误,因浓H2SO4的脱水性是将某些有机物中的H、O按H2O的组成脱去,这些H、O在原物质中并不是以H2O的形式存在.
5.在Cu与浓H2SO4的反应中,浓H2SO4体现了强氧化性和
酸性. ( )
提示:正确.
6.王水的氧化性比HNO3还强,它由浓盐酸和浓硝酸以体
积比1∶3混合而成. ( )
提示:错误,因王水是浓盐酸和浓硝酸按体积比3∶1混合而成的.
一、浓H2SO4的性质
1.浓H2SO4与稀H2SO4性质的比较
2.浓H2SO4的强氧化性
(1)Fe、Al的钝化
常温下,当Fe、Al等较活泼金属遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象.
(2)与不活泼金属和非金属的反应
由于浓硫酸具有强氧化性,故能够与不活泼金属或非金属发生反应,反应过程中有如下规律:
①反应要加热,否则不反应;
②还原产物一般是SO2.一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态氧化物或含氧酸.
③浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性.
④随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应就停止.
2.硝酸强氧化性的表现
硝酸具有强氧化性是由于HNO3中的+5价氮元素有很强的得电子能力,在硝酸参与的氧化还原反应中,几乎全部是+5价氮被还原.
(1)金属与HNO3反应不生成H2
①浓HNO3一般被还原为NO2.
②稀HNO3一般被还原为NO.
(2)在利用HNO3的酸性时,要注意它的强氧化性
如FeO与稀硝酸反应的方程式应是3FeO+10HNO3(稀)===3Fe(NO3)3+NO↑+5H2O,而不是FeO+2HNO3(稀)===Fe(NO3)2+H2O.
考查点一 浓硫酸的强氧化性——————————
[例1] 向50 mL 18 mol/L的H2SO4溶液中加入适量的铜片并加热.充分反应后,被还原的H2SO4的物质的量为 ( )
A.小于0.45 mol B.等于0.45 mol
C.在0.45~0.90 mol之间 D.大于0.45 mol
[答案] A
[关键一点]
解答本题的主要失误在于一是没有理解题意,没有按“被还原的H2SO4的物质的量”这一关键性的指导语去考虑问题,二是没有理解随着反应进行,浓硫酸逐渐变稀,稀硫酸不和铜反应.
在一定体积的18 mol/L的硫酸中加入过量铜片,加热,被
还原的硫酸为0.9 mol,则浓硫酸的实际体积为 ( )
A.等于50 mL B.大于50 mL
C.等于100 mL D.大于100 mL
解析:实际参加反应的硫酸为2×0.9 mol=1.8 mol,即100 mL,但Cu与稀硫酸不反应,故浓硫酸的实际体积大于100 mL.
答案:D
考查点二 硝酸的强氧化性———————————
[例2] 将0.1 mol 铜与40 mL 10 mol/L HNO3充分反应后,溶液中含a mol H+,由此可知 ( )
A.生成的气体在标准状况下的体积为4.48 L
B.生成的气体在标准状况下的体积为1.49 L
C.被还原的硝酸的物质的量为(0.2-a) mol
D.反应后溶液中所含NO的物质的量为0.2 mol
[答案] C
[关键一点]
解题的关键在于:(1)掌握铜与浓HNO3反应的特点:“先浓后稀”,(2)掌握金属与硝酸反应的计算规律:参加反应的硝酸等于起酸性作用的硝酸加上起氧化剂作用的硝酸.
铜粉放入稀硫酸溶液中,加热后无明显现象发生.当加
入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是 ( )
A.Fe2(SO4)3 B.Na2CO3
C.KNO3 D.FeSO4
答案:C
考查点三 有关硝酸的计算———————————
[例3] 将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L.请回答:
(1)NO的体积为________L,NO2的体积为________L.
(2)待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol/L.
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g.
[解析] 解答本题应从以下三点考虑:
①生成NO、NO2得到的电子与Cu失去的电子守恒.
②HNO3所含氮原子与反应后生成的NaNO3、NO、NO2所含氮原子守恒.
③NO、NO2全部转化为HNO3,与氧化剂H2O2应符合电子守恒.
6.4 g铜与过量的硝酸(8 mol/L 60 mL)充分反应后,硝酸的
还原产物有NO、NO2,反应后溶液中所含H+为n mol,此时溶液中所含NO的物质的量为 ( )
A.0.28 mol B.0.31 mol
C.(n+0.2)mol D.(n+0.4)mol
答案:C
第二课时 硫酸和硝酸的氧化性
预习全程设计
名师全程导学
案例全程导航
训练全程跟踪
第二课时
硫酸和硝酸的氧化性
一、硫酸
1.稀硫酸——具有酸的通性
(1)与指示剂作用:能使紫色石蕊试液 .
(2)与活泼金属(如Zn、Fe)反应.
(3)与碱性氧化物(如CuO、Fe2O3)反应.
(4)与碱[如NaOH、Ca(OH)2]反应.
(5)与某些盐(如Na2CO3、BaCl2等)发生复分解反应.
变红
2.浓硫酸
(1)吸水性
将一瓶浓硫酸敞口放置在空气中,其质量将 ,密度将减小,浓度 ,体积增大.这是因为浓硫酸具有 性,在实验室里常用浓硫酸作 剂.
(2)脱水性
浓硫酸可以使有机化合物中的 元素按 的组成从有机物中“脱离”出来,结合成水分子.
减小
增大
氢、氧
吸水
干燥
水
(3)强氧化性
①与金属反应:加热时,浓H2SO4可以与除金、铂之外的所有金属反应,生成高价金属硫酸盐,本身一般被还原成 .
如浓硫酸与金属铜的反应:
SO2
实验操作
实验现象 a试管中铜丝表面 ;
b试管中的品红溶液逐渐变为 ;
c试管中的紫色石蕊溶液逐渐变为 ;
将a试管里的溶液慢慢倒入水中,溶液变为 .
实验结论 Cu和浓H2SO4反应的化学方程式为:
.
有气泡冒出
蓝色
无色
红色
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
②常温下,冷的浓H2SO4能使Fe、Al发生 .
③与非金属反应
加热时与木炭反应的化学方程式为:
.
钝化
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
(1)Fe、Al被浓H2SO4钝化是化学变化吗?(2)浓H2SO4
与金属及非金属的反应中各表现了哪些性质.
提示:(1)是.常温下,Fe、Al的表面能被浓H2SO4氧化生成一层致密的氧化物薄膜,阻止了酸与内部金属的进一步反应,属于化学变化.
(2)与金属反应时,浓硫酸既表现氧化性也表现酸性;与非金属反应时,浓硫酸仅表现氧化性.
二、硝酸
1.与铜的反应
(1)铜与浓硝酸
化学方程式:
.
(2)铜与稀硝酸
化学方程式:
.
2.使铁、铝发生钝化
常温下,冷的浓硝酸能使 发生钝化.
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑
+2H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑
+4H2O
铁、铝
3.王水
王水是 和 按体积比 的混合物,能使一些不溶于硝酸的金属如 、 等溶解.
浓硝酸
浓盐酸
1∶3
金
铂
实验室中应如何保存浓HNO3
三、硫酸和硝酸的用途
1.硫酸和硝酸都是重要的 ,也是化学实验室里
必备的重要试剂,工业上可用于制化肥、农药、炸药、染料、盐类等.
2.硫酸还用于精炼 、金属加工前的酸洗及制取各种
酸,做干燥剂等.
化工原料
石油
挥发性
1.浓H2SO4、浓HNO3敞口放置于空气中,浓度都会变小,原
理相同. ( )
提示:错误,原理不同,浓H2SO4因其吸水性浓度变小,而浓HNO3是因其挥发性浓度变小.
2.浓H2SO4的脱水性与吸水性类似,都是将物质中的H2O吸
出来. ( )
提示:错误,因浓H2SO4的脱水性是将某些有机物中的H、O按H2O的组成脱去,这些H、O在原物质中并不是以H2O的形式存在.
5.在Cu与浓H2SO4的反应中,浓H2SO4体现了强氧化性和
酸性. ( )
提示:正确.
6.王水的氧化性比HNO3还强,它由浓盐酸和浓硝酸以体
积比1∶3混合而成. ( )
提示:错误,因王水是浓盐酸和浓硝酸按体积比3∶1混合而成的.
一、浓H2SO4的性质
1.浓H2SO4与稀H2SO4性质的比较
2.浓H2SO4的强氧化性
(1)Fe、Al的钝化
常温下,当Fe、Al等较活泼金属遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象.
(2)与不活泼金属和非金属的反应
由于浓硫酸具有强氧化性,故能够与不活泼金属或非金属发生反应,反应过程中有如下规律:
①反应要加热,否则不反应;
②还原产物一般是SO2.一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态氧化物或含氧酸.
③浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性.
④随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应就停止.
2.硝酸强氧化性的表现
硝酸具有强氧化性是由于HNO3中的+5价氮元素有很强的得电子能力,在硝酸参与的氧化还原反应中,几乎全部是+5价氮被还原.
(1)金属与HNO3反应不生成H2
①浓HNO3一般被还原为NO2.
②稀HNO3一般被还原为NO.
(2)在利用HNO3的酸性时,要注意它的强氧化性
如FeO与稀硝酸反应的方程式应是3FeO+10HNO3(稀)===3Fe(NO3)3+NO↑+5H2O,而不是FeO+2HNO3(稀)===Fe(NO3)2+H2O.
考查点一 浓硫酸的强氧化性——————————
[例1] 向50 mL 18 mol/L的H2SO4溶液中加入适量的铜片并加热.充分反应后,被还原的H2SO4的物质的量为 ( )
A.小于0.45 mol B.等于0.45 mol
C.在0.45~0.90 mol之间 D.大于0.45 mol
[答案] A
[关键一点]
解答本题的主要失误在于一是没有理解题意,没有按“被还原的H2SO4的物质的量”这一关键性的指导语去考虑问题,二是没有理解随着反应进行,浓硫酸逐渐变稀,稀硫酸不和铜反应.
在一定体积的18 mol/L的硫酸中加入过量铜片,加热,被
还原的硫酸为0.9 mol,则浓硫酸的实际体积为 ( )
A.等于50 mL B.大于50 mL
C.等于100 mL D.大于100 mL
解析:实际参加反应的硫酸为2×0.9 mol=1.8 mol,即100 mL,但Cu与稀硫酸不反应,故浓硫酸的实际体积大于100 mL.
答案:D
考查点二 硝酸的强氧化性———————————
[例2] 将0.1 mol 铜与40 mL 10 mol/L HNO3充分反应后,溶液中含a mol H+,由此可知 ( )
A.生成的气体在标准状况下的体积为4.48 L
B.生成的气体在标准状况下的体积为1.49 L
C.被还原的硝酸的物质的量为(0.2-a) mol
D.反应后溶液中所含NO的物质的量为0.2 mol
[答案] C
[关键一点]
解题的关键在于:(1)掌握铜与浓HNO3反应的特点:“先浓后稀”,(2)掌握金属与硝酸反应的计算规律:参加反应的硝酸等于起酸性作用的硝酸加上起氧化剂作用的硝酸.
铜粉放入稀硫酸溶液中,加热后无明显现象发生.当加
入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是 ( )
A.Fe2(SO4)3 B.Na2CO3
C.KNO3 D.FeSO4
答案:C
考查点三 有关硝酸的计算———————————
[例3] 将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L.请回答:
(1)NO的体积为________L,NO2的体积为________L.
(2)待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol/L.
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g.
[解析] 解答本题应从以下三点考虑:
①生成NO、NO2得到的电子与Cu失去的电子守恒.
②HNO3所含氮原子与反应后生成的NaNO3、NO、NO2所含氮原子守恒.
③NO、NO2全部转化为HNO3,与氧化剂H2O2应符合电子守恒.
6.4 g铜与过量的硝酸(8 mol/L 60 mL)充分反应后,硝酸的
还原产物有NO、NO2,反应后溶液中所含H+为n mol,此时溶液中所含NO的物质的量为 ( )
A.0.28 mol B.0.31 mol
C.(n+0.2)mol D.(n+0.4)mol
答案:C
