化学 必修1 4.1 第2课时 硅酸盐和硅单质
文档属性
| 名称 | 化学 必修1 4.1 第2课时 硅酸盐和硅单质 |  | |
| 格式 | zip | ||
| 文件大小 | 1020.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-22 20:53:09 | ||
图片预览











文档简介
(共41张PPT)
第二课时 硅酸
盐和
硅单质
预习全程设计
名师全程导学
案例全程导航
训练全程跟踪
第二课时
硅酸盐和硅单质
一、硅酸盐
1.概念
硅酸盐是由 组成的化合物的总称.
2.硅酸盐的性质
硅酸盐是一类结构复杂的固态物质,大多 于水,化学性质很 .
硅、氧和金属
不溶
稳定
3.硅酸盐的表示方法
通常用 和 的组合形式来表示硅酸盐,如硅酸钠(Na2SiO3)写成: 、石棉写成: 、长石写成: .
二氧化硅
金属氧化物
Na2O·SiO2
CaO·3MgO·4SiO2
K2O·Al2O3·6SiO2
4.最简单的硅酸盐——硅酸钠(Na2SiO3)
(1)物理性质:可溶于水,其水溶液俗称 .
(2)化学性质
①与比硅酸酸性强的一些酸反应,生成难溶于水的硅酸.如:Na2SiO3+2HCl=== .
②不能燃烧,不易腐蚀,热稳定性良好.
水玻璃
2NaCl+H2SiO3↓
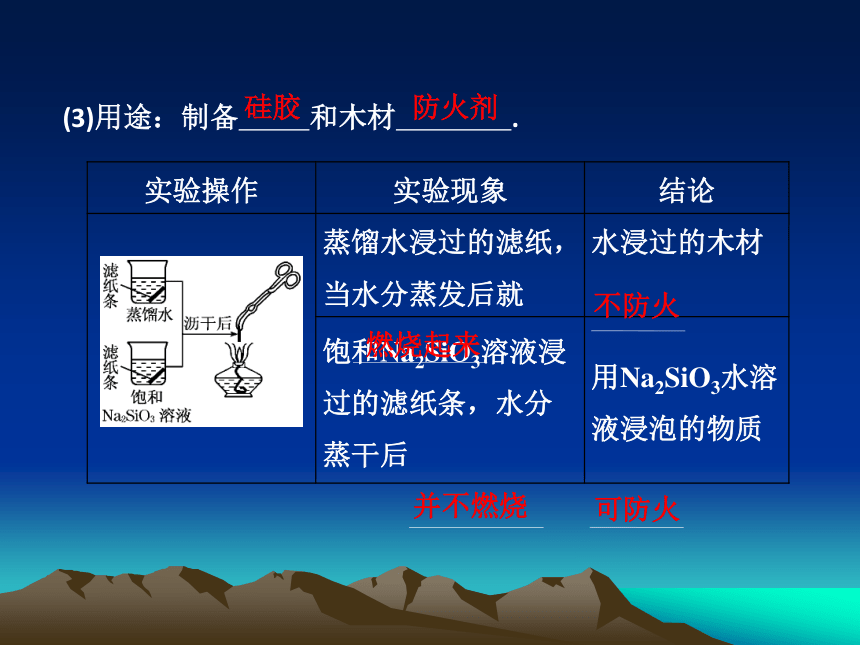
(3)用途:制备 和木材 .
硅胶
防火剂
实验操作 实验现象 结论
蒸馏水浸过的滤纸,当水分蒸发后就 水浸过的木材
饱和Na2SiO3溶液浸过的滤纸条,水分蒸干后 用Na2SiO3水溶液浸泡的物质
燃烧起来
不防火
并不燃烧
可防火
5.常见的无机非金属材料
在生产和生活中,使用量最大的无机非金属材料是:陶瓷、玻璃和水泥
产品名称 生产原料 主要设备
陶瓷 —
玻璃
水泥
黏土
纯碱、石灰石、石英
玻璃窑
黏土、石灰石
水泥回转窑
6.其他含硅的物质
物质 性质 用途
SiC 俗称 ,具有 结构,硬度很大 砂纸、砂轮的磨料
含4%硅的硅钢 很高的 变压器铁芯
硅橡胶 既耐 ,又耐 ,在-60℃~250℃保持良好的弹性 制火箭、导弹、飞机的零件和绝缘材料
人工制造分子筛
(铝硅酸盐) 有均匀微孔结构 作吸附剂和催化剂
金刚砂
金刚石
导磁性
高温
低温
二、硅单质
1.分类
晶体和无定形两种.
2.晶体硅的物理性质
晶体硅是有金属光泽的灰黑色固体,熔点高、硬度 、有脆性.晶体硅的导电性介于导体和绝缘体之间,是良好的 材料.
3.硅的用途
(1)用作半导体材料,做 ,促进信息技术革命的发展.
(2)制造 ,将光能转换为电能,极有发展前景.
大
半导体
硅芯片
光电池
在半导体工业中有一句行话:“从沙滩到用户”,你能理解这句话的涵义吗?
1.硅酸盐结构复杂,化学性质稳定,都不溶于水. ( )
提示:错误,因为有的硅酸盐可溶于水,如Na2SiO3等.
2.硅酸钠可写成Na2O·SiO2,则其属于混合物. ( )
提示:错误,因硅酸盐都是化合物.
3.玻璃和水玻璃都为固态硅酸盐产品. ( )
提示:错误,因水玻璃是Na2SiO3溶液的俗名,呈液态.
4.制备水泥和玻璃的原料中都有石灰石. ( )
提示:正确.
5.晶体硅、碳化硅、金刚石三者结构类似,硬度都较
大. ( )
提示:正确,因它们都具有空间网状结构.
6.计算机芯片、水晶镜片主要成分都是硅晶体.( )
提示:错误,因水晶镜片的主要成分为SiO2.
一、硅单质
1.碳和硅的比较
碳 硅
氧化物化学式的意义 CO2可表示二氧化碳的分子组成 SiO2不能表示二氧化硅的分子组成,仅表示二氧化硅中硅原子和氧原子的个数比为1∶2
硅原子和碳原子的结构相似,但其单质的化学性质相差较大.
由于硅酸盐的组成与结构很复杂,为了简化对硅酸盐组成的表示方法,采用了氧化物法,实际上硅酸盐不是以简单氧化物形成存在的,而是以结构复杂的盐的形式存在的.
考查点一 硅材料的制备与应用—————————
[例1] 硅单质及其化合物应用范围很广.请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯SiHCl3制备高纯硅的化学反应方程式________________________________.
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式____________________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是________________.
(2)下列有关硅材料的说法正确的是________(填字母).
A.碳化硅化学性质稳定,可用于生产砂纸、砂轮等
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导
纤维
D.普通玻璃是由烧碱、石灰石和石英制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
[关键一点]
解答本题时要特别注意以下三点:
(1)化学反应发生的条件;
(2)题目中的重要信息:无水无氧;
(3)依据物质的性质分析其相应用途.
下面关于硅的叙述中,正确的是 ( )
A.硅的氧化性比碳强,只有在高温下才能跟氢气起化合
反应
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量
在所有的元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是重要的半导体材料
解析:硅的氧化性比碳弱,A项错;硅在地壳中的含量在所有的元素中居第二位,排名前四位的是O、Si、Al、Fe,所以B项错;硅在自然界中是以化合态存在的,所以C项也错.
答案:D
考查点二 用氧化物表示硅酸盐的组成——————
[答案] D
[关键一点]
硅酸盐的化学式中一般就已给出了改写后各氧化物的书写前后顺序,如A项中,钙沸石的化学式为Ca(Al2Si3O10)·3H2O,则写成氧化物形式时各氧化物的顺序为:CaO→Al2O3→SiO2→H2O.
硅酸镁晶体被用来治疗胃溃疡病患者的胃酸过多症,是
因为该物质不溶于水,服用后能中和胃酸,作用持久.三硅酸镁晶体的化学式为Mg2Si3O8·nH2O.
(1)用氧化物形式表示三硅酸镁的化学式为____________
_____________________________________________;
(2)写出该药物中和胃酸的化学方程式________________
_________________________________________________
解析:解题时要注意只有碱性氧化物MgO才能与酸反应生成盐和水.第(2)问若直接写三硅酸镁与盐酸反应,较困难.应从氧化物形式书写,只有碱性氧化物MgO能够与水反应.
答案:(1)2MgO·3SiO2·nH2O.
(2)2MgO·3SiO2·nH2O+4HCl===2MgCl2+3SiO2+(n+2)H2O.
第二课时 硅酸
盐和
硅单质
预习全程设计
名师全程导学
案例全程导航
训练全程跟踪
第二课时
硅酸盐和硅单质
一、硅酸盐
1.概念
硅酸盐是由 组成的化合物的总称.
2.硅酸盐的性质
硅酸盐是一类结构复杂的固态物质,大多 于水,化学性质很 .
硅、氧和金属
不溶
稳定
3.硅酸盐的表示方法
通常用 和 的组合形式来表示硅酸盐,如硅酸钠(Na2SiO3)写成: 、石棉写成: 、长石写成: .
二氧化硅
金属氧化物
Na2O·SiO2
CaO·3MgO·4SiO2
K2O·Al2O3·6SiO2
4.最简单的硅酸盐——硅酸钠(Na2SiO3)
(1)物理性质:可溶于水,其水溶液俗称 .
(2)化学性质
①与比硅酸酸性强的一些酸反应,生成难溶于水的硅酸.如:Na2SiO3+2HCl=== .
②不能燃烧,不易腐蚀,热稳定性良好.
水玻璃
2NaCl+H2SiO3↓
(3)用途:制备 和木材 .
硅胶
防火剂
实验操作 实验现象 结论
蒸馏水浸过的滤纸,当水分蒸发后就 水浸过的木材
饱和Na2SiO3溶液浸过的滤纸条,水分蒸干后 用Na2SiO3水溶液浸泡的物质
燃烧起来
不防火
并不燃烧
可防火
5.常见的无机非金属材料
在生产和生活中,使用量最大的无机非金属材料是:陶瓷、玻璃和水泥
产品名称 生产原料 主要设备
陶瓷 —
玻璃
水泥
黏土
纯碱、石灰石、石英
玻璃窑
黏土、石灰石
水泥回转窑
6.其他含硅的物质
物质 性质 用途
SiC 俗称 ,具有 结构,硬度很大 砂纸、砂轮的磨料
含4%硅的硅钢 很高的 变压器铁芯
硅橡胶 既耐 ,又耐 ,在-60℃~250℃保持良好的弹性 制火箭、导弹、飞机的零件和绝缘材料
人工制造分子筛
(铝硅酸盐) 有均匀微孔结构 作吸附剂和催化剂
金刚砂
金刚石
导磁性
高温
低温
二、硅单质
1.分类
晶体和无定形两种.
2.晶体硅的物理性质
晶体硅是有金属光泽的灰黑色固体,熔点高、硬度 、有脆性.晶体硅的导电性介于导体和绝缘体之间,是良好的 材料.
3.硅的用途
(1)用作半导体材料,做 ,促进信息技术革命的发展.
(2)制造 ,将光能转换为电能,极有发展前景.
大
半导体
硅芯片
光电池
在半导体工业中有一句行话:“从沙滩到用户”,你能理解这句话的涵义吗?
1.硅酸盐结构复杂,化学性质稳定,都不溶于水. ( )
提示:错误,因为有的硅酸盐可溶于水,如Na2SiO3等.
2.硅酸钠可写成Na2O·SiO2,则其属于混合物. ( )
提示:错误,因硅酸盐都是化合物.
3.玻璃和水玻璃都为固态硅酸盐产品. ( )
提示:错误,因水玻璃是Na2SiO3溶液的俗名,呈液态.
4.制备水泥和玻璃的原料中都有石灰石. ( )
提示:正确.
5.晶体硅、碳化硅、金刚石三者结构类似,硬度都较
大. ( )
提示:正确,因它们都具有空间网状结构.
6.计算机芯片、水晶镜片主要成分都是硅晶体.( )
提示:错误,因水晶镜片的主要成分为SiO2.
一、硅单质
1.碳和硅的比较
碳 硅
氧化物化学式的意义 CO2可表示二氧化碳的分子组成 SiO2不能表示二氧化硅的分子组成,仅表示二氧化硅中硅原子和氧原子的个数比为1∶2
硅原子和碳原子的结构相似,但其单质的化学性质相差较大.
由于硅酸盐的组成与结构很复杂,为了简化对硅酸盐组成的表示方法,采用了氧化物法,实际上硅酸盐不是以简单氧化物形成存在的,而是以结构复杂的盐的形式存在的.
考查点一 硅材料的制备与应用—————————
[例1] 硅单质及其化合物应用范围很广.请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯SiHCl3制备高纯硅的化学反应方程式________________________________.
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式____________________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是________________.
(2)下列有关硅材料的说法正确的是________(填字母).
A.碳化硅化学性质稳定,可用于生产砂纸、砂轮等
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导
纤维
D.普通玻璃是由烧碱、石灰石和石英制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
[关键一点]
解答本题时要特别注意以下三点:
(1)化学反应发生的条件;
(2)题目中的重要信息:无水无氧;
(3)依据物质的性质分析其相应用途.
下面关于硅的叙述中,正确的是 ( )
A.硅的氧化性比碳强,只有在高温下才能跟氢气起化合
反应
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量
在所有的元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是重要的半导体材料
解析:硅的氧化性比碳弱,A项错;硅在地壳中的含量在所有的元素中居第二位,排名前四位的是O、Si、Al、Fe,所以B项错;硅在自然界中是以化合态存在的,所以C项也错.
答案:D
考查点二 用氧化物表示硅酸盐的组成——————
[答案] D
[关键一点]
硅酸盐的化学式中一般就已给出了改写后各氧化物的书写前后顺序,如A项中,钙沸石的化学式为Ca(Al2Si3O10)·3H2O,则写成氧化物形式时各氧化物的顺序为:CaO→Al2O3→SiO2→H2O.
硅酸镁晶体被用来治疗胃溃疡病患者的胃酸过多症,是
因为该物质不溶于水,服用后能中和胃酸,作用持久.三硅酸镁晶体的化学式为Mg2Si3O8·nH2O.
(1)用氧化物形式表示三硅酸镁的化学式为____________
_____________________________________________;
(2)写出该药物中和胃酸的化学方程式________________
_________________________________________________
解析:解题时要注意只有碱性氧化物MgO才能与酸反应生成盐和水.第(2)问若直接写三硅酸镁与盐酸反应,较困难.应从氧化物形式书写,只有碱性氧化物MgO能够与水反应.
答案:(1)2MgO·3SiO2·nH2O.
(2)2MgO·3SiO2·nH2O+4HCl===2MgCl2+3SiO2+(n+2)H2O.
