盐的精制
图片预览











文档简介
(共44张PPT)
课题1 盐的精制
学习目标
1.熟悉盐的精制实验方法、原理和除杂原则。
2.了解盐的精制实验仪器和基本操作。
3.掌握物质分离提纯的常用方法。
一、粗食盐水的精制
1.实验目的
除去粗食盐水中的______________,及________、_________、_________、_______等杂质离子。
2.实验方法
在进行溶液纯化时,选择合适的试剂将溶液中的____________转化为________除去,这种方法叫做__________________。
课前自主学案
不溶性杂质
Mg2+
Ca2+
Fe3+
SO
杂质离子
沉淀
化学沉淀法
自主学习
BaCl2
Na2CO3
NaOH
OH-
思考感悟
1.物质分离和提纯的原则是什么?应注意哪些问题?
【提示】 (1)基本原则:①不增(不引入新杂质);②不减(不减少被提纯物质);③易分离(被提纯物与杂质易分离);④易复原(被提纯物易复原)。
(2)注意事项:①除杂试剂须过量;②过量试剂须除尽;③去除多种杂质时要考虑加入试剂的先后顺序;④选择最佳的除杂途径。
二、硝酸钾粗品的提纯
1.实验目的
用__________法除去硝酸钾粗品中的___________等可溶性杂质,得到较纯的硝酸钾。
2.硝酸钾粗品提纯的实验原理
硝酸钾的溶解度受________影响较大,将硝酸钾粗品配成热的浓溶液,将其冷却时,由于硝酸钾在水中的溶解度随温度的降低而_______,溶液中的硝酸
重结晶
氯化钠
温度
减小
钾会______________从而析出晶体。由于杂质含量很低,不会达到饱和,仍留在溶液中,通过过滤冷却后的混合液即可将硝酸钾与杂质分离,达到提纯的目的。这种方法称为______________。
达到饱和
重结晶法
2.影响晶粒生成的条件如何?
【提示】 晶粒析出的大小与结晶条件有关,溶质的溶解度越小或溶液的浓度越高,或溶剂的蒸发速率越快,或溶液冷却的越快,析出的晶粒就越细小;反之可得到较大的晶体颗粒。在实际操作中常根据需要,控制适宜的结晶条件,以得到大小合适的晶体颗粒。另外,当溶液发生过饱和现象时,振荡容器,用玻璃棒搅动或轻轻地摩擦器壁或投入几粒晶体,都可促使晶体析出。
自主体验
1.下列仪器:①漏斗;②试剂瓶;③蒸馏烧瓶;④坩埚;⑤分液漏斗;⑥托盘天平;⑦燃烧匙,常用于物质分离的是( )
A.①③④ B.①②⑥
C.①③⑤ D.③⑤⑦
解析:选C。普通漏斗通常用于过滤,蒸馏烧瓶常用于蒸馏,分液漏斗常用于分液。仪器的使用方法和用途需记忆。
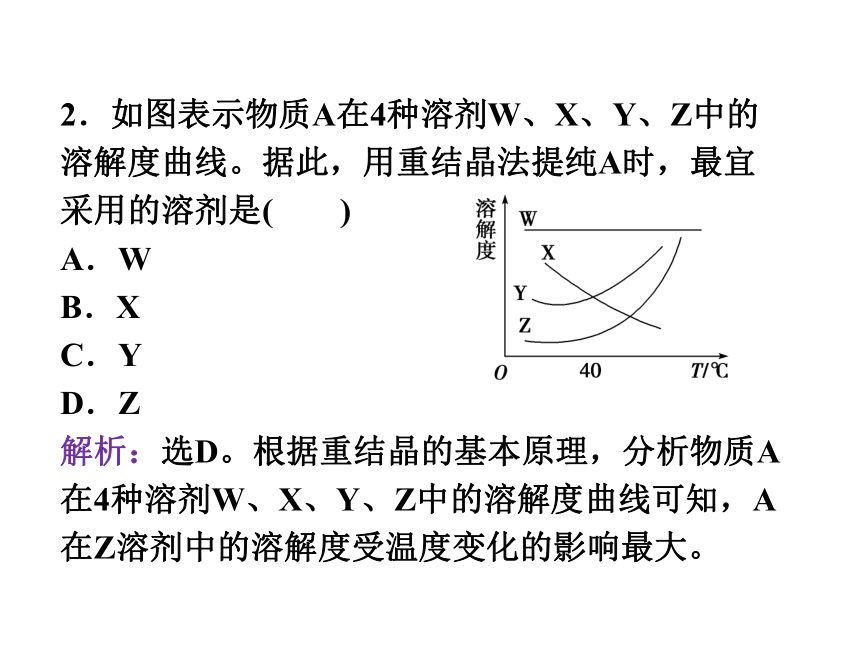
2.如图表示物质A在4种溶剂W、X、Y、Z中的溶解度曲线。据此,用重结晶法提纯A时,最宜采用的溶剂是( )
A.W
B.X
C.Y
D.Z
解析:选D。根据重结晶的基本原理,分析物质A在4种溶剂W、X、Y、Z中的溶解度曲线可知,A在Z溶剂中的溶解度受温度变化的影响最大。
3.(2011年济南高二检测)下列除去杂质的方法正确的是( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤,洗涤
解析:选C。本题考查除杂的常用方法。做题基础是熟练掌握相关物质的物理、化学性质,并注意二者的不同点,尤其注意除杂的一个基本原则:在除杂的同时不能引入新的杂质。当然,更不能将要保留的组分损失掉。A项中澄清石灰水能吸收CO2。B项中BaCO3+2HCl=== BaCl2+CO2↑+H2O,杂质BaSO4不溶于酸。D项中Cu与稀硝酸也能反应。C项正确。
课堂互动讲练
1.化学沉淀法的概念
在进行溶液的纯化时,选择合适的试剂将溶液中的杂质离子转化为沉淀除去,这种方法叫化学沉淀法。如NaCl溶液里混有少量的MgCl2,可加入过量的NaOH溶液,使Mg2+转化为Mg(OH)2沉淀(但引入了新的杂质OH-),过滤除去Mg(OH)2,然后加入适量盐酸,调节pH为中性。
化学沉淀法
2.利用化学沉淀法进行物质分离的一般思路
分析混合物的组成→根据待提纯物和杂质的化学性质选择合适的沉淀剂→合理安排加入沉淀剂的顺序→考虑过量的沉淀剂应该如何除去→确定实验步骤。
3.粗食盐水的精制实验注意事项
在除杂质时,首先应加入稍过量的沉淀剂,在实验的过程中应注意检测沉淀剂是否过量,以保证沉淀完全;其次,过量的沉淀剂引入的新的杂质应该在后续操作中除去;再次,如果过量的沉淀剂不易除去,应避免使用,如使用NaOH溶液除去Mg2+而不选择KOH溶液。
例1
(1)判断BaCl2已过量的方法是_______________________________。
(2)第④步中,相关的离子方程式是________________________________________________________________________
________________________________________________________________________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是_________________________________________
________________________________________________________________________。
(4)为检验精盐纯度,需要配制150 mL 0.2 mol/L NaCl(精盐)溶液,如图所示是该同学转移溶液的示意图,图中的错误是______________________________
______________________________
______________________________
______________________________
____________。
【思路点拨】 解决本题注意以下两点:
(1)除去杂质的原则;
(2)配制一定物质的量浓度的溶液的基本操作及所需仪器。
【解析】 加入BaCl2、NaOH、Na2CO3等沉淀剂后,产生BaSO4、Mg(OH)2、Fe(OH)3、BaCO3、CaCO3沉淀,还有过量的Na2CO3,需加入盐酸使Na2CO3转变成NaCl。但如果加HCl再过滤,Mg(OH)2、Fe(OH)3、BaCO3、CaCO3都有可能与盐酸反应而溶解,造成产品纯度不高。配制一定物质的量浓度的食盐水,所需的仪器主要有150 mL的容量瓶、烧杯、玻璃棒和胶头滴管等。
【规律方法】 物质除杂往往是综合利用化学方法和物理方法。即先通过离子间的化学反应,将杂质(离子)形成沉淀或气体,再通过实验的基本操作如蒸发结晶、过滤等方法除去杂质。
变式训练1 (2010年高考上海卷)除去下列括号内杂质的试剂或方法错误的是( )
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
解析:选A。A中又引入了Cl-,故A错;B中SO2可被KMnO4(H+)氧化为H2SO4而除去;KNO3的溶解度随温度的变化大,而NaCl的几乎不变,可以用结晶法提纯;D中的CH3COOH转化为高沸点的(CH3COO)2Ca,蒸馏可得到C2H5OH。
1.重结晶:利用重结晶法提纯物质,不受杂质种类的影响,只要杂质是少量的、可溶的,溶液冷却后杂质在溶液中尚未饱和皆可用此法提纯。被提纯物在该溶剂中的溶解度随温度改变有明显变化时,收率较高。有些盐(如氯化钠)的溶解度随温度的改变变化不大,在溶液冷却过程中析出晶体的量很少,对这些晶体进行提纯时不宜采用重结晶法。
硝酸钾粗品的提纯——重结晶
2.配制热的浓溶液时,溶剂用量与洗涤用水多少与收率和纯度的关系
溶剂用量 收率 纯度 洗涤用水 收率 纯度
多 低 高 多 低 高
少 高 低 少 高 低
3.提高纯度和收率可以采取以下措施
(1)减慢降温速度,降低结晶速度,使晶体中包裹的杂质离子减少;(2)充分过滤,使母液和晶体尽可能分离,可采用抽滤;(3)正确操作,减少实验过程中药品的损失;(4)母液的回收再利用。
4.重结晶与蒸发结晶的比较
结晶是使固体物质从溶液中以晶体状态析出的过程,是提纯、分离固体物质的重要方法之一。常用的方法有两种:一种是通过蒸发,减少一部分溶剂而使溶液浓缩达到过饱和而析出晶体,此法主要用于溶解度随温度改变而变化不大的物质(如氯化钠);另一种是通过降低温度使溶液冷却达到过饱和而析出晶体,这种方法主要用于溶解度随温度下降而明显减少的物质(如硝酸钾),有时需要将两种方法结合使用。
假如第一次得到的晶体纯度不符合要求,可将所得到的晶体溶于少量溶剂中。然后进行蒸发(或冷却)、结晶、分离,如此反复的操作称为重结晶。有些物质的纯化,需要经过几次重结晶才能使产品合乎要求。由于每次的母液中都含有一些溶质,所以应收集起来加以适当处理,以提高产率。
晶体颗粒的大小与结晶条件有关。如果溶质溶解度小,或溶液浓度高,或溶剂的蒸发速度快,或溶液冷却速度快,析出的晶体就细小;反之,就可以得到较大的晶体颗粒。当溶液发生过饱和现象时,可以振荡容器,用玻璃棒搅动或轻轻地摩擦器壁。或投入几小粒晶体(晶种),促使晶体析出。
5.硝酸钾粗品的提纯实验注意事项
(1)配制合适的一定浓度的热溶液。KNO3在40 ℃的溶解度为66 g,故所配制的溶液一般不低于35%,用酒精灯加热使固体完全溶解。
(2)要注意正确地进行过滤操作,过滤后应用适量蒸馏水洗涤沉淀。
下面是四种盐在不同温度下的溶解度(g/100 g H2O):
(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)
例2
温度 NaNO3 KNO3 NaCl KCl
10 ℃ 80.5 20.9 35.7 31.0
100 ℃ 175 246 39.1 56.6
某同学设计用质量比为85∶74.5的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾晶体,其流程如下:
回答下列问题:
(1)在①和③的实验过程中,关键的实验条件是____________________________。
(2)分离出晶体②和④的操作是________(填“蒸发”、“结晶”或“过滤”)。硝酸钾晶体是________(填“A”或“C”)。
(3)粗产品中可能含有的杂质离子是________________________________________________________________________。
(4)欲将粗产品提纯,可采取的方法是________________________________________________________________________。
【解析】 本题实验操作的目的是制取硝酸钾晶体,从所给四种物质的溶解度可知,硝酸钾的溶解度受温度变化影响最大,适于用冷却结晶的方法得到。而和硝酸钾相对应的物质是氯化钠,其溶解度受温度变化的影响最小,所以其分离应先通过蒸发结晶分离出氯化钠,再用冷却结晶的方法分离出硝酸钾。与其先加水完全溶解再蒸发结晶,不如控制温度加少量(适量)的水进行溶解,直接达到蒸发结晶的效果,还能节约能量。其分离流程中正是应用了这一特点,这也正是题目的难点所在。
【答案】 (1)控制温度 (2)过滤 C
(3)Na+、Cl- (4)重结晶
【规律方法】 一般地,混合物中某组分的溶解度随温度变化明显,方可采用重结晶法。重结晶法分离混合物的根本理论依据是:当溶于水中的各种离子可组成多种物质时,在降温结晶过程中,先达到饱和的物质先析出。
变式训练2 下表是几种物质在指定温度下的溶解度(g/100 g H2O)。现将相同物质的量的NaCl、CO2、NH3在30 ℃时制成溶液,此时溶液中无晶体,当降温至某温度时,开始析出晶体,此晶体是( )
0 ℃ 10 ℃ 20 ℃ 30 ℃
NH4Cl 29.4 33.3 37.2 41.1
NH4HCO3 11.9 15.9 21.0 27.0
NaHCO3 6.9 8.15 9.6 11.1
NaCl 35.7 35.8 36.0 36.4
A.NH4Cl B.NH4HCO3
C.NaHCO3 D.NaCl
玻璃棒的作用
1.搅拌
探究整合应用
图1
(1)蒸发结晶
用玻璃棒搅拌,以免液体局部过热,致使液滴飞溅出来(如图1)。
(2)固体溶解
进行固体溶解的实验时,用玻璃棒进行搅拌,以加快固体物质的溶解速度,如粗盐的溶解。
2.引流
使液体沿玻璃棒注入容器中。
(1)过滤(见图2)。
(2)溶液的配制(见图3)。
3.测定性质
(1)点测pH
测定溶液pH时,玻璃棒的作用是蘸取待测液体。
(2)检测气体性质
检验气体性质时,先用蒸馏水将试纸湿润,粘在玻璃棒的一端,用玻璃棒将试纸靠近盛有待测气体的试管口(注意不要接触)观察试纸的颜色变化。
课题1 盐的精制
学习目标
1.熟悉盐的精制实验方法、原理和除杂原则。
2.了解盐的精制实验仪器和基本操作。
3.掌握物质分离提纯的常用方法。
一、粗食盐水的精制
1.实验目的
除去粗食盐水中的______________,及________、_________、_________、_______等杂质离子。
2.实验方法
在进行溶液纯化时,选择合适的试剂将溶液中的____________转化为________除去,这种方法叫做__________________。
课前自主学案
不溶性杂质
Mg2+
Ca2+
Fe3+
SO
杂质离子
沉淀
化学沉淀法
自主学习
BaCl2
Na2CO3
NaOH
OH-
思考感悟
1.物质分离和提纯的原则是什么?应注意哪些问题?
【提示】 (1)基本原则:①不增(不引入新杂质);②不减(不减少被提纯物质);③易分离(被提纯物与杂质易分离);④易复原(被提纯物易复原)。
(2)注意事项:①除杂试剂须过量;②过量试剂须除尽;③去除多种杂质时要考虑加入试剂的先后顺序;④选择最佳的除杂途径。
二、硝酸钾粗品的提纯
1.实验目的
用__________法除去硝酸钾粗品中的___________等可溶性杂质,得到较纯的硝酸钾。
2.硝酸钾粗品提纯的实验原理
硝酸钾的溶解度受________影响较大,将硝酸钾粗品配成热的浓溶液,将其冷却时,由于硝酸钾在水中的溶解度随温度的降低而_______,溶液中的硝酸
重结晶
氯化钠
温度
减小
钾会______________从而析出晶体。由于杂质含量很低,不会达到饱和,仍留在溶液中,通过过滤冷却后的混合液即可将硝酸钾与杂质分离,达到提纯的目的。这种方法称为______________。
达到饱和
重结晶法
2.影响晶粒生成的条件如何?
【提示】 晶粒析出的大小与结晶条件有关,溶质的溶解度越小或溶液的浓度越高,或溶剂的蒸发速率越快,或溶液冷却的越快,析出的晶粒就越细小;反之可得到较大的晶体颗粒。在实际操作中常根据需要,控制适宜的结晶条件,以得到大小合适的晶体颗粒。另外,当溶液发生过饱和现象时,振荡容器,用玻璃棒搅动或轻轻地摩擦器壁或投入几粒晶体,都可促使晶体析出。
自主体验
1.下列仪器:①漏斗;②试剂瓶;③蒸馏烧瓶;④坩埚;⑤分液漏斗;⑥托盘天平;⑦燃烧匙,常用于物质分离的是( )
A.①③④ B.①②⑥
C.①③⑤ D.③⑤⑦
解析:选C。普通漏斗通常用于过滤,蒸馏烧瓶常用于蒸馏,分液漏斗常用于分液。仪器的使用方法和用途需记忆。
2.如图表示物质A在4种溶剂W、X、Y、Z中的溶解度曲线。据此,用重结晶法提纯A时,最宜采用的溶剂是( )
A.W
B.X
C.Y
D.Z
解析:选D。根据重结晶的基本原理,分析物质A在4种溶剂W、X、Y、Z中的溶解度曲线可知,A在Z溶剂中的溶解度受温度变化的影响最大。
3.(2011年济南高二检测)下列除去杂质的方法正确的是( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤,洗涤
解析:选C。本题考查除杂的常用方法。做题基础是熟练掌握相关物质的物理、化学性质,并注意二者的不同点,尤其注意除杂的一个基本原则:在除杂的同时不能引入新的杂质。当然,更不能将要保留的组分损失掉。A项中澄清石灰水能吸收CO2。B项中BaCO3+2HCl=== BaCl2+CO2↑+H2O,杂质BaSO4不溶于酸。D项中Cu与稀硝酸也能反应。C项正确。
课堂互动讲练
1.化学沉淀法的概念
在进行溶液的纯化时,选择合适的试剂将溶液中的杂质离子转化为沉淀除去,这种方法叫化学沉淀法。如NaCl溶液里混有少量的MgCl2,可加入过量的NaOH溶液,使Mg2+转化为Mg(OH)2沉淀(但引入了新的杂质OH-),过滤除去Mg(OH)2,然后加入适量盐酸,调节pH为中性。
化学沉淀法
2.利用化学沉淀法进行物质分离的一般思路
分析混合物的组成→根据待提纯物和杂质的化学性质选择合适的沉淀剂→合理安排加入沉淀剂的顺序→考虑过量的沉淀剂应该如何除去→确定实验步骤。
3.粗食盐水的精制实验注意事项
在除杂质时,首先应加入稍过量的沉淀剂,在实验的过程中应注意检测沉淀剂是否过量,以保证沉淀完全;其次,过量的沉淀剂引入的新的杂质应该在后续操作中除去;再次,如果过量的沉淀剂不易除去,应避免使用,如使用NaOH溶液除去Mg2+而不选择KOH溶液。
例1
(1)判断BaCl2已过量的方法是_______________________________。
(2)第④步中,相关的离子方程式是________________________________________________________________________
________________________________________________________________________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是_________________________________________
________________________________________________________________________。
(4)为检验精盐纯度,需要配制150 mL 0.2 mol/L NaCl(精盐)溶液,如图所示是该同学转移溶液的示意图,图中的错误是______________________________
______________________________
______________________________
______________________________
____________。
【思路点拨】 解决本题注意以下两点:
(1)除去杂质的原则;
(2)配制一定物质的量浓度的溶液的基本操作及所需仪器。
【解析】 加入BaCl2、NaOH、Na2CO3等沉淀剂后,产生BaSO4、Mg(OH)2、Fe(OH)3、BaCO3、CaCO3沉淀,还有过量的Na2CO3,需加入盐酸使Na2CO3转变成NaCl。但如果加HCl再过滤,Mg(OH)2、Fe(OH)3、BaCO3、CaCO3都有可能与盐酸反应而溶解,造成产品纯度不高。配制一定物质的量浓度的食盐水,所需的仪器主要有150 mL的容量瓶、烧杯、玻璃棒和胶头滴管等。
【规律方法】 物质除杂往往是综合利用化学方法和物理方法。即先通过离子间的化学反应,将杂质(离子)形成沉淀或气体,再通过实验的基本操作如蒸发结晶、过滤等方法除去杂质。
变式训练1 (2010年高考上海卷)除去下列括号内杂质的试剂或方法错误的是( )
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
解析:选A。A中又引入了Cl-,故A错;B中SO2可被KMnO4(H+)氧化为H2SO4而除去;KNO3的溶解度随温度的变化大,而NaCl的几乎不变,可以用结晶法提纯;D中的CH3COOH转化为高沸点的(CH3COO)2Ca,蒸馏可得到C2H5OH。
1.重结晶:利用重结晶法提纯物质,不受杂质种类的影响,只要杂质是少量的、可溶的,溶液冷却后杂质在溶液中尚未饱和皆可用此法提纯。被提纯物在该溶剂中的溶解度随温度改变有明显变化时,收率较高。有些盐(如氯化钠)的溶解度随温度的改变变化不大,在溶液冷却过程中析出晶体的量很少,对这些晶体进行提纯时不宜采用重结晶法。
硝酸钾粗品的提纯——重结晶
2.配制热的浓溶液时,溶剂用量与洗涤用水多少与收率和纯度的关系
溶剂用量 收率 纯度 洗涤用水 收率 纯度
多 低 高 多 低 高
少 高 低 少 高 低
3.提高纯度和收率可以采取以下措施
(1)减慢降温速度,降低结晶速度,使晶体中包裹的杂质离子减少;(2)充分过滤,使母液和晶体尽可能分离,可采用抽滤;(3)正确操作,减少实验过程中药品的损失;(4)母液的回收再利用。
4.重结晶与蒸发结晶的比较
结晶是使固体物质从溶液中以晶体状态析出的过程,是提纯、分离固体物质的重要方法之一。常用的方法有两种:一种是通过蒸发,减少一部分溶剂而使溶液浓缩达到过饱和而析出晶体,此法主要用于溶解度随温度改变而变化不大的物质(如氯化钠);另一种是通过降低温度使溶液冷却达到过饱和而析出晶体,这种方法主要用于溶解度随温度下降而明显减少的物质(如硝酸钾),有时需要将两种方法结合使用。
假如第一次得到的晶体纯度不符合要求,可将所得到的晶体溶于少量溶剂中。然后进行蒸发(或冷却)、结晶、分离,如此反复的操作称为重结晶。有些物质的纯化,需要经过几次重结晶才能使产品合乎要求。由于每次的母液中都含有一些溶质,所以应收集起来加以适当处理,以提高产率。
晶体颗粒的大小与结晶条件有关。如果溶质溶解度小,或溶液浓度高,或溶剂的蒸发速度快,或溶液冷却速度快,析出的晶体就细小;反之,就可以得到较大的晶体颗粒。当溶液发生过饱和现象时,可以振荡容器,用玻璃棒搅动或轻轻地摩擦器壁。或投入几小粒晶体(晶种),促使晶体析出。
5.硝酸钾粗品的提纯实验注意事项
(1)配制合适的一定浓度的热溶液。KNO3在40 ℃的溶解度为66 g,故所配制的溶液一般不低于35%,用酒精灯加热使固体完全溶解。
(2)要注意正确地进行过滤操作,过滤后应用适量蒸馏水洗涤沉淀。
下面是四种盐在不同温度下的溶解度(g/100 g H2O):
(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)
例2
温度 NaNO3 KNO3 NaCl KCl
10 ℃ 80.5 20.9 35.7 31.0
100 ℃ 175 246 39.1 56.6
某同学设计用质量比为85∶74.5的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾晶体,其流程如下:
回答下列问题:
(1)在①和③的实验过程中,关键的实验条件是____________________________。
(2)分离出晶体②和④的操作是________(填“蒸发”、“结晶”或“过滤”)。硝酸钾晶体是________(填“A”或“C”)。
(3)粗产品中可能含有的杂质离子是________________________________________________________________________。
(4)欲将粗产品提纯,可采取的方法是________________________________________________________________________。
【解析】 本题实验操作的目的是制取硝酸钾晶体,从所给四种物质的溶解度可知,硝酸钾的溶解度受温度变化影响最大,适于用冷却结晶的方法得到。而和硝酸钾相对应的物质是氯化钠,其溶解度受温度变化的影响最小,所以其分离应先通过蒸发结晶分离出氯化钠,再用冷却结晶的方法分离出硝酸钾。与其先加水完全溶解再蒸发结晶,不如控制温度加少量(适量)的水进行溶解,直接达到蒸发结晶的效果,还能节约能量。其分离流程中正是应用了这一特点,这也正是题目的难点所在。
【答案】 (1)控制温度 (2)过滤 C
(3)Na+、Cl- (4)重结晶
【规律方法】 一般地,混合物中某组分的溶解度随温度变化明显,方可采用重结晶法。重结晶法分离混合物的根本理论依据是:当溶于水中的各种离子可组成多种物质时,在降温结晶过程中,先达到饱和的物质先析出。
变式训练2 下表是几种物质在指定温度下的溶解度(g/100 g H2O)。现将相同物质的量的NaCl、CO2、NH3在30 ℃时制成溶液,此时溶液中无晶体,当降温至某温度时,开始析出晶体,此晶体是( )
0 ℃ 10 ℃ 20 ℃ 30 ℃
NH4Cl 29.4 33.3 37.2 41.1
NH4HCO3 11.9 15.9 21.0 27.0
NaHCO3 6.9 8.15 9.6 11.1
NaCl 35.7 35.8 36.0 36.4
A.NH4Cl B.NH4HCO3
C.NaHCO3 D.NaCl
玻璃棒的作用
1.搅拌
探究整合应用
图1
(1)蒸发结晶
用玻璃棒搅拌,以免液体局部过热,致使液滴飞溅出来(如图1)。
(2)固体溶解
进行固体溶解的实验时,用玻璃棒进行搅拌,以加快固体物质的溶解速度,如粗盐的溶解。
2.引流
使液体沿玻璃棒注入容器中。
(1)过滤(见图2)。
(2)溶液的配制(见图3)。
3.测定性质
(1)点测pH
测定溶液pH时,玻璃棒的作用是蘸取待测液体。
(2)检测气体性质
检验气体性质时,先用蒸馏水将试纸湿润,粘在玻璃棒的一端,用玻璃棒将试纸靠近盛有待测气体的试管口(注意不要接触)观察试纸的颜色变化。
