2.3构成物质的微粒(II)原子和离子课件-2021-2022学年九年级化学粤教版上册(39张PPT)
文档属性
| 名称 | 2.3构成物质的微粒(II)原子和离子课件-2021-2022学年九年级化学粤教版上册(39张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-29 08:23:02 | ||
图片预览






文档简介
空气、物质的组成
2.3构成物质的微粒(II)
--原子和离子
本课主要内容
原子是什么
原子内部有何奥秘
离子怎样形成
原子的质量有多大
1
3
4
2
一、原子是什么
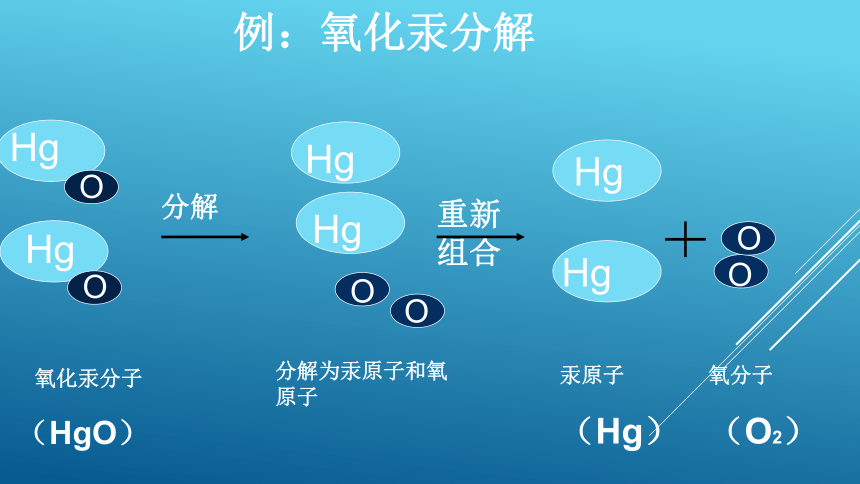
分子可以构成物质,那么分子是怎样构成的呢?
分子能不能分割?
重新组合
O
Hg
氧化汞分子
(HgO)
氧分子
(O2)
汞原子
(Hg)
分解
分解为汞原子和氧原子
例:氧化汞分解
Hg
O
Hg
O
Hg
Hg
O
O
Hg
O
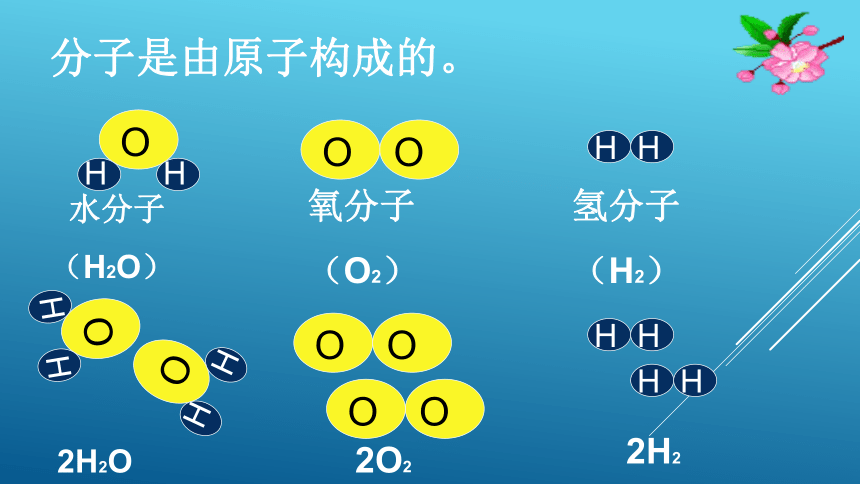
分子是由原子构成的。
H
H
O
H
水分子
(H2O)
O
O
氧分子
(O2)
氢分子
(H2)
O
O
O
O
O
H
H
O
H
H
H
H
H
H
H
2H2O
2O2
2H2
归纳总结
1、原子构成分子,原子也可直接构成某些物质
2、在化学变化中,分子本身发生变化,而原子本身没有根本变化,只是重新组成新分子,构成物质,所以,原子是化学变化中的最小微粒。
思考:原子可不可分呢?
19世纪前半叶,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。(他被称为化学之父)
原子发现史
原子并不是构成物质的最小微粒
——汤姆森发现原子中还有电子(1897年)
汤姆森认为:
电子是一种带负电、有一定质量的微粒,普遍存在于各种原子之中。
提出了新的问题:
原子的内部究竟是什么样呢?
电子就像西瓜子一样
镶嵌在原子中。
原子发现史
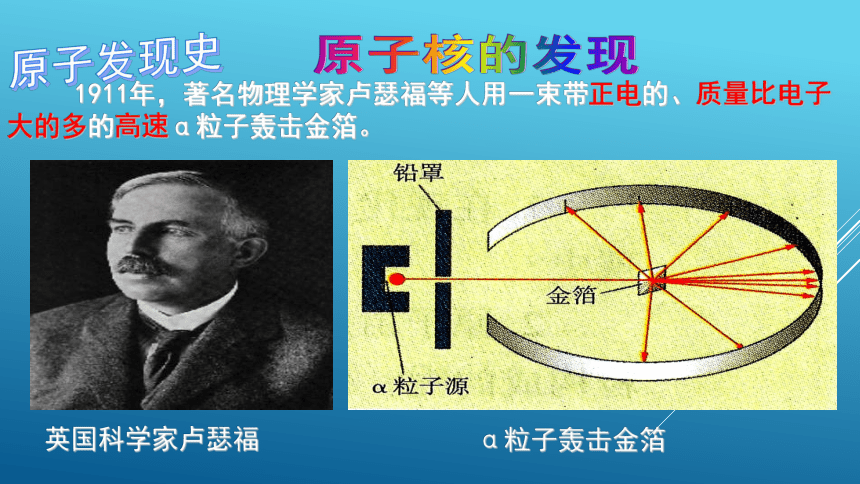
英国科学家卢瑟福
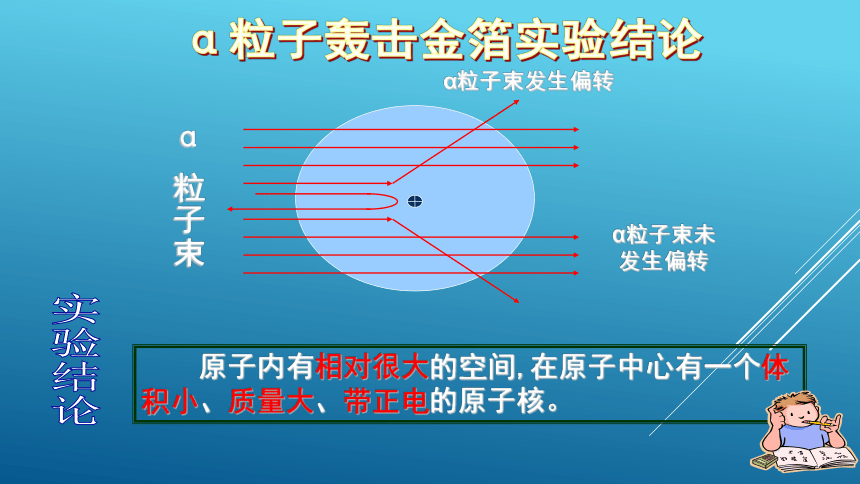
1911年,著名物理学家卢瑟福等人用一束带正电的、质量比电子大的多的高速α粒子轰击金箔。
α粒子轰击金箔
原子发现史
原子核的发现
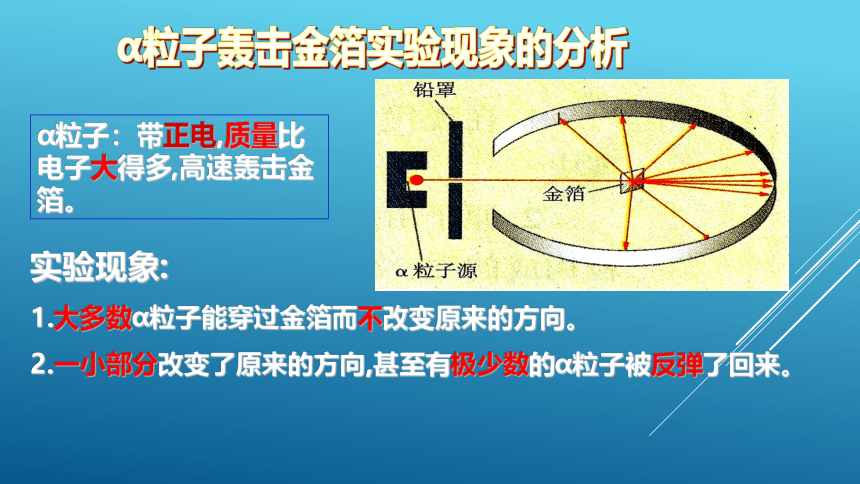
α粒子:带正电,质量比电子大得多,高速轰击金箔。
实验现象:
1.大多数α粒子能穿过金箔而不改变原来的方向。
2.一小部分改变了原来的方向,甚至有极少数的α粒子被反弹了回来。
α粒子轰击金箔实验现象的分析
原子内有相对很大的空间,在原子中心有一个体积小、质量大、带正电的原子核。
α粒子束发生偏转
α粒子束未
发生偏转
实验结论
α 粒子束
α粒子轰击金箔实验结论
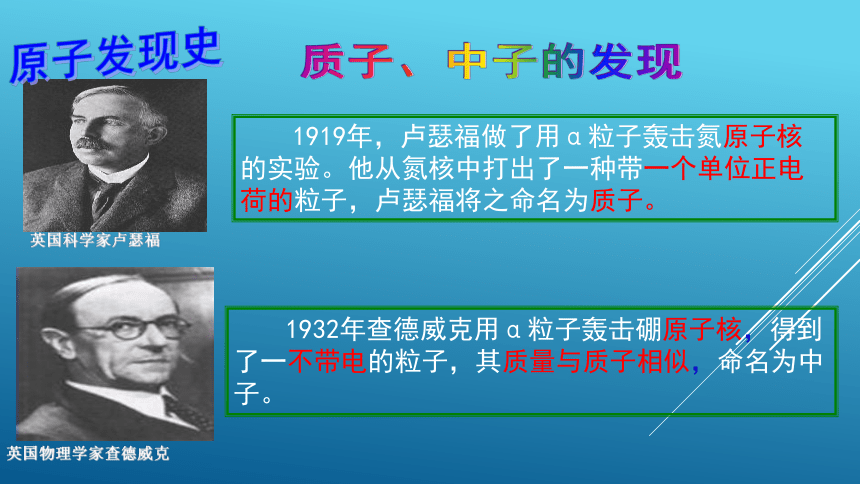
1919年,卢瑟福做了用α粒子轰击氮原子核的实验。他从氮核中打出了一种带一个单位正电荷的粒子,卢瑟福将之命名为质子。
英国物理学家查德威克
1932年查德威克用α粒子轰击硼原子核,得到了一不带电的粒子,其质量与质子相似,命名为中子。
英国科学家卢瑟福
原子发现史
质子、中子的发现
每个质子带一个单位的正电荷
不带电
每个电子带一个单位的负电荷
(带正电)
质子:
原子
中子:
核外电子:
原子核
(不显电性)
交流共享:
原子中存在着带正电的原子核与带负电的电子,为什么整个原子不显电性?
活动一
深入认识原子的结构
每个质子带一个单位的正电荷
不带电
每个电子带一个单位的负电荷
(带正电)
质子:
原子
中子:
核外电子:
原子核
(不显电性)
原子中:一个质子和一个电子所带的电量相等,电性相反。
核电荷数 = 质子数 = 电子数
活动一
深入认识原子的结构
原子种类
原 子 核
核外电子数
质子数
中子数
氢
1
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
铁
26
30
26
活动二
深入认识原子的结构
仔细观察表格中的内容,你能获得哪些信息?
原子种类
原 子 核
核外电子数
质子数
中子数
氢
1
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
铁
26
30
26
质子数 = 电子数
不是所有的原子都有中子
不同类原子,原子核内质子数不同
活动二
深入认识原子的结构
原子结构发现历程
道尔顿原子论 汤姆森原子论 卢瑟福原子论 原子结构
原子不显电性
质子数=核电荷数=核外电子数=原子序数
结论
质子
原子
中子
核外电子
原子核
质子数不一定等于中子数
原子中不一定有中子,氢原子没有中子
原子种类由质子数决定
二、1.原子结构
﹣
﹣
﹣
﹣
﹣
﹣
+
+
+
+
+
+
+
+
+
+
+
+
原子奇特的内部结构
2.原子结构示意图 (以氧原子为例)
核外电子分层排布
核电荷数
原子核
电子层
该层上电子数
最外层电子数
氧原子结构示意图
资料介绍:一个镁原子核内有12个质子,它的原子核外有12个电子,其中有2个电子能量相近都较低且离核最近,8个电子能量略高且离核稍远,还有2个电子能量最高且离核最远。这些电子都同时绕镁的原子核运动。
2
2
8
+12
Mg
镁
学以致用
+
﹣
+
+
+
﹣
﹣
﹣
+
+
+
+
+
+
+
+
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
不同原子的内部结构
氧原子
氢原子
锂原子
①第一层最多容纳2个电子,第二层最多容纳8个电子。
②最外层不超过8个电子(只有一层的,电子不超过2个)。
③电子先排满能量低的电子层,然后再排能量稍高的电子层。依此类推。
(2)核外电子排布规律
金属原子
非金属原子
请将以下原子进行分类,并说出分类的依据。
分析各类原子的最外层电子数,分析它们的特点
稀有气体
(2)核外电子排布规律
元 素
最外层电子数
原子结构
化学性质
变 化 趋 势
金 属
非金属
稀有气体
8个(氦为2个 )
稳定结构
稳定
不得不失
一般﹤ 4 个
不稳定结构
易失去电子
活泼
一 般≥4 个
不稳定结构
易得到电子
活泼
三、 原子最外电子数与结构、性质的关系:
最外层电子数 决定 原子的化学性质
带正电
阳离子
带负电
阴离子
提示:原子的最外层电子数等于8的时候最稳定。
故事分析:
有一天,你和你的好朋友一起去买书,当时你有11元钱,而她有9元钱,你们俩都选中了一样的书,如果那本书是10元钱,你会怎么办呢?
氧化镁的形成:
在化学世界里,原子之间也会发扬互帮互助的精神的。
2
2
8
+12
Mg
镁原子
2
6
O
氧原子
+8
氧化镁的形成
Mg2+
O2-
2
2
8
+12
Mg镁
原子
+12
2
8
Mg2+
镁离子
2
6
O 氧
原子
2
8
+8
O2-
氧离子
提示:原子的最外层电子数等于 8 的时候,最稳定。
失去两个电子
得到两个电子
+8
2
7
8
+17
2
1
8
+11
2
8
8
+17
钠原子(Na)
氯原子(Cl )
钠离子( )
氯离子( )
失去一
个电子
得到一
个电子
Na+
Cl-
食盐氯化钠的形成过程
NaCl
2
8
+11
结论:氯化钠由钠离子和氯离子构成
离子:带电的原子或原子团
得电子带负电,形成阴离子
失电子带正电,形成阳离子
三、离子
图3-15 张青莲 (1908-2006)
四、相对原子质量
我国科学院院士张青莲教授为相对原子质量的测定做出了卓越贡献。他主持测定了铟、铱、锑、铕、铈、铒、锗、锌几种元素的相对原子质量新值,被国际原子量委员会采用为国际新标准。
以一种碳原子质量1/12作为标准, 其他原子的质量跟它比较所得的值, 作为这种原子的相对原子质量(Ar)。
2.相对原子质量的数学计算式
相对原子质量 =
(Ar)
某种原子的质量
一种碳原子质量×1/12
1.相对原子质量的概念
粒子种类
质量
质子
1.6726×10-27 kg
中子
1.6749×10-27 kg
电子
质子质量的1/1836
表3-2 构成原子的粒子的质量
发现: 与质子、中子相比,电子质量很小,通常忽略不计,原子的质量主要集中在原子核上。
质子数
中子数
电子数
相对原子质量
氢
1
0
1
碳
6
6
6
氮
7
7
7
镁
12
12
12
相对原子质量=质子数+中子数
1
12
14
24
本节课知识网络
原子
质子(决定元素的种类)
中子
原子结构示意图
原子结构
原子核
核外电子(最外层电子数决定元素的化学性质)
原子核外
电子排布规律
1.原子核外第一层最多排2个电子,第二层最多排8个电子
2.最外层最多不超过8个电子
3.金属原子最外层电子一半少于4个,反应中易失去电子,
非金属原子最外层电子一半多于4个,在反应中易得到电子
相对原子质量= 原子质量 = 质子数 + 中子数
碳12原子质量的1/12
1、一般原子的原子核( )
A.由电子和质子构成 B.由质子和中子构成 C.由电子和中子构成 D.不能再分
2、下列物质由离子构成的是 ( ) A.铜 B.氯化钠 C.氧气 D.金刚石
B
课堂演练
B
2.下图为某粒子的结构示意图,下列说法正确的是( )
A.该粒子有12个质子
B. 该粒子有2个电子层
C. 该粒子属于非金属元素
D. 该粒子已达到相对稳定结构
A
课堂演练
4、某原子的相对原子质量为23,某核内有12个中子,则其核外的电子数为( )
A、12 B、23 C、11 D、10
5、下列粒子结构示意图中,表示阳离子的是( )
A. B. C. D.
C
课堂演练
A
今天作业
1、阅读教材2.3全部内容
2、预习下节课内容
感谢各位聆听!
祝同学们学习进步!
2.3构成物质的微粒(II)
--原子和离子
本课主要内容
原子是什么
原子内部有何奥秘
离子怎样形成
原子的质量有多大
1
3
4
2
一、原子是什么
分子可以构成物质,那么分子是怎样构成的呢?
分子能不能分割?
重新组合
O
Hg
氧化汞分子
(HgO)
氧分子
(O2)
汞原子
(Hg)
分解
分解为汞原子和氧原子
例:氧化汞分解
Hg
O
Hg
O
Hg
Hg
O
O
Hg
O
分子是由原子构成的。
H
H
O
H
水分子
(H2O)
O
O
氧分子
(O2)
氢分子
(H2)
O
O
O
O
O
H
H
O
H
H
H
H
H
H
H
2H2O
2O2
2H2
归纳总结
1、原子构成分子,原子也可直接构成某些物质
2、在化学变化中,分子本身发生变化,而原子本身没有根本变化,只是重新组成新分子,构成物质,所以,原子是化学变化中的最小微粒。
思考:原子可不可分呢?
19世纪前半叶,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。(他被称为化学之父)
原子发现史
原子并不是构成物质的最小微粒
——汤姆森发现原子中还有电子(1897年)
汤姆森认为:
电子是一种带负电、有一定质量的微粒,普遍存在于各种原子之中。
提出了新的问题:
原子的内部究竟是什么样呢?
电子就像西瓜子一样
镶嵌在原子中。
原子发现史
英国科学家卢瑟福
1911年,著名物理学家卢瑟福等人用一束带正电的、质量比电子大的多的高速α粒子轰击金箔。
α粒子轰击金箔
原子发现史
原子核的发现
α粒子:带正电,质量比电子大得多,高速轰击金箔。
实验现象:
1.大多数α粒子能穿过金箔而不改变原来的方向。
2.一小部分改变了原来的方向,甚至有极少数的α粒子被反弹了回来。
α粒子轰击金箔实验现象的分析
原子内有相对很大的空间,在原子中心有一个体积小、质量大、带正电的原子核。
α粒子束发生偏转
α粒子束未
发生偏转
实验结论
α 粒子束
α粒子轰击金箔实验结论
1919年,卢瑟福做了用α粒子轰击氮原子核的实验。他从氮核中打出了一种带一个单位正电荷的粒子,卢瑟福将之命名为质子。
英国物理学家查德威克
1932年查德威克用α粒子轰击硼原子核,得到了一不带电的粒子,其质量与质子相似,命名为中子。
英国科学家卢瑟福
原子发现史
质子、中子的发现
每个质子带一个单位的正电荷
不带电
每个电子带一个单位的负电荷
(带正电)
质子:
原子
中子:
核外电子:
原子核
(不显电性)
交流共享:
原子中存在着带正电的原子核与带负电的电子,为什么整个原子不显电性?
活动一
深入认识原子的结构
每个质子带一个单位的正电荷
不带电
每个电子带一个单位的负电荷
(带正电)
质子:
原子
中子:
核外电子:
原子核
(不显电性)
原子中:一个质子和一个电子所带的电量相等,电性相反。
核电荷数 = 质子数 = 电子数
活动一
深入认识原子的结构
原子种类
原 子 核
核外电子数
质子数
中子数
氢
1
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
铁
26
30
26
活动二
深入认识原子的结构
仔细观察表格中的内容,你能获得哪些信息?
原子种类
原 子 核
核外电子数
质子数
中子数
氢
1
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
铁
26
30
26
质子数 = 电子数
不是所有的原子都有中子
不同类原子,原子核内质子数不同
活动二
深入认识原子的结构
原子结构发现历程
道尔顿原子论 汤姆森原子论 卢瑟福原子论 原子结构
原子不显电性
质子数=核电荷数=核外电子数=原子序数
结论
质子
原子
中子
核外电子
原子核
质子数不一定等于中子数
原子中不一定有中子,氢原子没有中子
原子种类由质子数决定
二、1.原子结构
﹣
﹣
﹣
﹣
﹣
﹣
+
+
+
+
+
+
+
+
+
+
+
+
原子奇特的内部结构
2.原子结构示意图 (以氧原子为例)
核外电子分层排布
核电荷数
原子核
电子层
该层上电子数
最外层电子数
氧原子结构示意图
资料介绍:一个镁原子核内有12个质子,它的原子核外有12个电子,其中有2个电子能量相近都较低且离核最近,8个电子能量略高且离核稍远,还有2个电子能量最高且离核最远。这些电子都同时绕镁的原子核运动。
2
2
8
+12
Mg
镁
学以致用
+
﹣
+
+
+
﹣
﹣
﹣
+
+
+
+
+
+
+
+
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
不同原子的内部结构
氧原子
氢原子
锂原子
①第一层最多容纳2个电子,第二层最多容纳8个电子。
②最外层不超过8个电子(只有一层的,电子不超过2个)。
③电子先排满能量低的电子层,然后再排能量稍高的电子层。依此类推。
(2)核外电子排布规律
金属原子
非金属原子
请将以下原子进行分类,并说出分类的依据。
分析各类原子的最外层电子数,分析它们的特点
稀有气体
(2)核外电子排布规律
元 素
最外层电子数
原子结构
化学性质
变 化 趋 势
金 属
非金属
稀有气体
8个(氦为2个 )
稳定结构
稳定
不得不失
一般﹤ 4 个
不稳定结构
易失去电子
活泼
一 般≥4 个
不稳定结构
易得到电子
活泼
三、 原子最外电子数与结构、性质的关系:
最外层电子数 决定 原子的化学性质
带正电
阳离子
带负电
阴离子
提示:原子的最外层电子数等于8的时候最稳定。
故事分析:
有一天,你和你的好朋友一起去买书,当时你有11元钱,而她有9元钱,你们俩都选中了一样的书,如果那本书是10元钱,你会怎么办呢?
氧化镁的形成:
在化学世界里,原子之间也会发扬互帮互助的精神的。
2
2
8
+12
Mg
镁原子
2
6
O
氧原子
+8
氧化镁的形成
Mg2+
O2-
2
2
8
+12
Mg镁
原子
+12
2
8
Mg2+
镁离子
2
6
O 氧
原子
2
8
+8
O2-
氧离子
提示:原子的最外层电子数等于 8 的时候,最稳定。
失去两个电子
得到两个电子
+8
2
7
8
+17
2
1
8
+11
2
8
8
+17
钠原子(Na)
氯原子(Cl )
钠离子( )
氯离子( )
失去一
个电子
得到一
个电子
Na+
Cl-
食盐氯化钠的形成过程
NaCl
2
8
+11
结论:氯化钠由钠离子和氯离子构成
离子:带电的原子或原子团
得电子带负电,形成阴离子
失电子带正电,形成阳离子
三、离子
图3-15 张青莲 (1908-2006)
四、相对原子质量
我国科学院院士张青莲教授为相对原子质量的测定做出了卓越贡献。他主持测定了铟、铱、锑、铕、铈、铒、锗、锌几种元素的相对原子质量新值,被国际原子量委员会采用为国际新标准。
以一种碳原子质量1/12作为标准, 其他原子的质量跟它比较所得的值, 作为这种原子的相对原子质量(Ar)。
2.相对原子质量的数学计算式
相对原子质量 =
(Ar)
某种原子的质量
一种碳原子质量×1/12
1.相对原子质量的概念
粒子种类
质量
质子
1.6726×10-27 kg
中子
1.6749×10-27 kg
电子
质子质量的1/1836
表3-2 构成原子的粒子的质量
发现: 与质子、中子相比,电子质量很小,通常忽略不计,原子的质量主要集中在原子核上。
质子数
中子数
电子数
相对原子质量
氢
1
0
1
碳
6
6
6
氮
7
7
7
镁
12
12
12
相对原子质量=质子数+中子数
1
12
14
24
本节课知识网络
原子
质子(决定元素的种类)
中子
原子结构示意图
原子结构
原子核
核外电子(最外层电子数决定元素的化学性质)
原子核外
电子排布规律
1.原子核外第一层最多排2个电子,第二层最多排8个电子
2.最外层最多不超过8个电子
3.金属原子最外层电子一半少于4个,反应中易失去电子,
非金属原子最外层电子一半多于4个,在反应中易得到电子
相对原子质量= 原子质量 = 质子数 + 中子数
碳12原子质量的1/12
1、一般原子的原子核( )
A.由电子和质子构成 B.由质子和中子构成 C.由电子和中子构成 D.不能再分
2、下列物质由离子构成的是 ( ) A.铜 B.氯化钠 C.氧气 D.金刚石
B
课堂演练
B
2.下图为某粒子的结构示意图,下列说法正确的是( )
A.该粒子有12个质子
B. 该粒子有2个电子层
C. 该粒子属于非金属元素
D. 该粒子已达到相对稳定结构
A
课堂演练
4、某原子的相对原子质量为23,某核内有12个中子,则其核外的电子数为( )
A、12 B、23 C、11 D、10
5、下列粒子结构示意图中,表示阳离子的是( )
A. B. C. D.
C
课堂演练
A
今天作业
1、阅读教材2.3全部内容
2、预习下节课内容
感谢各位聆听!
祝同学们学习进步!
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
