2021年人教版第三单元物质构成的奥秘考点复习教案(含解析)
文档属性
| 名称 | 2021年人教版第三单元物质构成的奥秘考点复习教案(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 389.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-29 14:52:42 | ||
图片预览




文档简介
第三单元
物质构成的奥秘
【内容概述】
本单元包括三个课题。课题1“分子和原子”说明物质是由分子和原子等微观粒子构成的,分子可以分成原子,原子能够重新组合。课题2“原子的结构”讲解了原子的构成和核外电子排布知识,进一步介绍了相对原子质量。课题3“元素”学习了元素和元素符号,简单介绍了元素周期表。本单元是学习化学微观世界的基础。其中,分子、原子的性质,应用原子、分子的性质解释有关的宏观现象,原子的构成,离子的形成,以及元素概念的理解及元素符号的写法是中考的重点。
【学习目标】
重点:
1.
构成物质的微观粒子有:分子,原子,离子。
2.
微观粒子的基本性质。轻小动距。
3.
原子的结构,核外电子排布及原子结构示意图。
4.
相对原子质量。。
5.
元素及元素符号的概念。
难点:
1.
原子的结构及核外电子排布。
2.
运用分子,原子的性质解释有关的宏观现象。。
3.
相对原子质量概念的理解。
4.
元素符号的理解记忆。
【命题分析】
1.本单元知识中物质与元素、原子、分子以及离子的区别和联系等均是中考的热点,特别是与之相关的高科技信息题是近几年中考的命题方向。命题中形式多样,考查学生的想象力和综合分析能力。将抽象具体化,对比记忆是复习的有效方法。
2.有关元素、分子、原子的概念辨析以及应用这些概念描述物质的组成或结构,在中考中常见题型为选择题或填空题。
3.结构示意图及化学符号周围数字的意义等知识点,常以图片或元素周期表的形式并且会结合热点新闻、新材料为素材考查。考查学生的阅读能力、自学能力、信息提取能力的题目将会成为主流。在备考时要对所给信息进行科学评价、判断正误,进行知识迁移。
【中考解读】
中考常考考点
难度
常考题型
1.
分子和原子的性质区别与联系
★★★
选择题、填空题、简答题
2.
用微粒的观点解释现象
★★★
选择题、填空题、实验探究题
3.
判断构成物质的粒子
★★
选择题
4.原子的构成
★★★
选择题
5.
粒子结构示意图
★★★
选择题、填空题
6.
元素的概念
★★★
选择题、填空题
7.
元素周期表
★★★
选择题、填空题
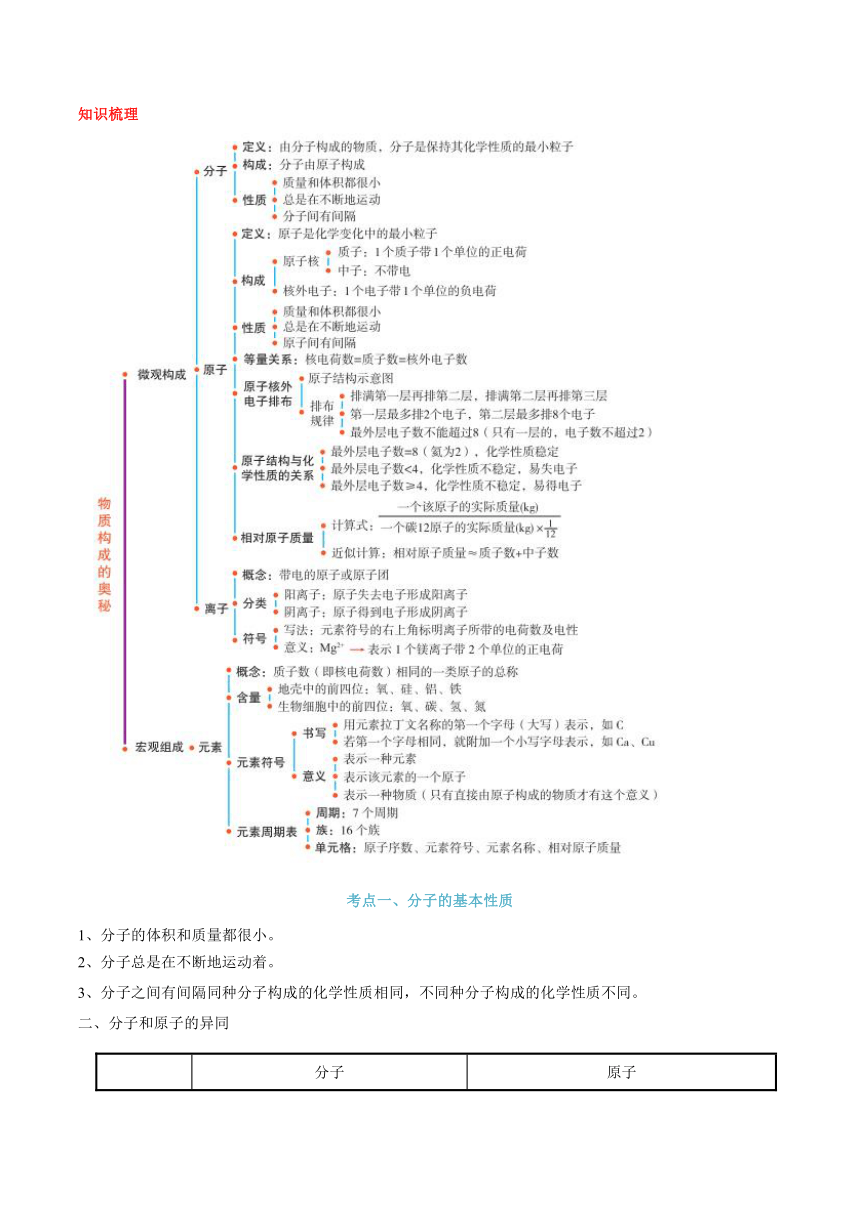
知识梳理
考点一、分子的基本性质
1、分子的体积和质量都很小。
2、分子总是在不断地运动着。
3、分子之间有间隔同种分子构成的化学性质相同,不同种分子构成的化学性质不同。
二、分子和原子的异同
分子
原子
定义
分子是保持物质化学性质的最小粒子。
原子是化学变化中的最小粒子。
性质
质量小、体积小;不断运动;有间隔;同种粒子的化学性质相同。
联系
分子是由原子构成的。分子、原子都是构成物质的微粒。
区别
在化学变化中,分子可以再分,而原子不可以再分。
备注
所有金属、稀有气体、金刚石(石墨)和硅是由原子构成的,其他大多数物质是由分子构成的。
在受热的情况下,粒子能量增大,运动速率加快。
物体的热胀冷缩现象,原因是构成物质的粒子的间隔受热时增大,遇冷时缩小。
气体容易压缩是因为构成气体的粒子的间隔较大。
不同液体混合后总体积小于原体积的和,说明粒子间是有间隔的。
一种物质如果由分子构成,那么保持它化学性质的最小粒子是分子;如果它由原子构成,那么保持它化学性质的最小粒子是原子。
考点二、原子的构成
(
原子
(不带电)
原子核(带正电)
核外电子(每个电子带一个单位负电荷;电子分层排布)
质子(每个质子带
一个单位正电荷)
中子(不带电)
在核外一个相对很大的空间内做着高速运动动
体积很小,约占原子体积的十万分之一
)
原子一般是由质子、中子和电子构成,有的原子不一定有中子,质子数也不一定等于中子数。
※构成原子的各种粒子间的关系:在原子中,原子序数=核电荷数=核内质子数=核外电子数。
原子核外电子排布
原子的核外电子最少的只有一层,最多的有七层;最外层电子数不超过8个(只有一层的,电子数不超过2个)。
原子结构示意图。(以氧原子的结构示意图为例)
离子
概念:带电的原子(或原子团)
表示:在元素符号的右上角用“+”或“-”号表示离子的电性,数字表示离子所带的电荷数,先写数字,后写“+”或“-”号,当数字为1,时省略不写。
种类:阳离子:带正电的原子(或原子团)
阴离子:带负电的原子(或原子团)
符号意义:表示离子(或一个离子)2Mg2+
相对原子质量
相对原子质量≈质子数+中子数
考点三、元素
1)定义:元素是质子数(即核电荷数)相同的一类原子的总称。
元素与原子的区别和联系:
元素
原子
区别
只表示一类原子的总称;只表示种类,不论个数,是宏观概念
既表示种类,又表示数量含义原子
是微观概念
化学变化中元素种类不变,但形态可能变化
化学变化中,原子种类和数量不变,但最外层电子数可能变化
联系
元素是同一类原子的总称,原子是构成元素的基本单元
元素之最:地壳中含量(质量分数)排在前五位的元素:氧、硅、铝、铁、钙
2)元素符号的意义:元素符号不仅表示一种元素,还表示这种元素的一个原子。如果物质由原子构成,元素符号还可以表示一种物质。
如果元素符号前加上系数,就只表示该原子的个数,只具有微观意义。
3)元素周期表
1、原子序数:原子序数=核内质子数=核电荷数=核外电子数
2、横行(周期):每一个横行叫一个周期,共有七个周期。同一周期元素原子的电子层数相等。
纵行(族):每一个纵行叫一个族,共有18个纵行16个族,其中8、9、10三个纵行共同组成一个族。
4、每一格:能够表示该元素的名称、符号、原子序数、相对原子质量。
【考点详览】
考点一
利用分子和原子的性质分析和解决问题
1.下列对有关事实的解释错误的是
A.
干冰升华—一分子的体积变大
B.
冰水共存物属于纯净物一一冰和水都由水分子构成
C.
氧化汞受热分解—一在化学变化中分子可以分为原子
D.
酒精挥发一—分子总是在不断运动着
【答案】A
【解析】A、干冰升华是因为分子之间的间隔变大,分子的体积不变,符合题意;
B、冰和水都由水分子构成,故冰水共存物只由水一种物质组成,属于纯净物,不符合题意;
C、氧化汞受热分解是因为在化学变化中,分子可以分为原子,原子不能再分,不符合题意;
D、酒精挥发,是因为分子在不断运动,不符合题意。
考点二
微粒与元素的关系
2.
世界万物都是由极其微小的粒子构成的,下列说法正确的是( )
A.海水是由海水分子构成的
B.分子、原子、离子都能直接构成物质
C.二氧化碳是由碳原子和氧原子构成的
D.自然界中的物质都是由质子、中子、电子等粒子构成的
【答案】B
【解析】A、海水是混合物,不存在海水分子,错误;
B、分子、原子、离子都能直接构成物质,正确;
C、二氧化碳分子由碳原子和氧原子构成,错误;
D、自然界中的物质是由分子、原子、离子构成的,质子、中子、电子是构成原子的基本微粒,错误
考点三
原子的结构
3.
原子核中一定含有的粒子是( )
A.中子
B.质子
C.电子
D.质子和电子
【答案】B
【解析】原子核是由质子和中子构成的,但是中子不一定存在,例如普通氢原子不含有中子,故原子核中一定含有质子。
考点四
判断构成物质的粒子
4.下列物质中,由分子构成的是(
)
A.
水
B.
汞
C.
氯化钠
D.
金刚石
【答案】A
【解析】A、水是由水分子构成的,故选项正确。
B、汞属于金属单质,是由汞原子直接构成的,故选项错误。
C、氯化钠是由钠离子和氯离子构成的,故选项错误。
D、金刚石属于固态非金属单质,是由碳原子直接构成的,故选项错误。
考点五
元素的概念
5.2020年1月14日,C919大型客机第二架机迎来了进入2020年后的第一次飞行。C919部分机身采用了新型的铝锂合金。铝锂合金中铝(Al)元素与锂(Li)元素的本质区别是( )
A.
相对原于质量不同
B.
原子的中子数不同
C.
原子的电子数不同
D.
原子的质子数不同
【答案】D
【解析】元素是质子数(即核电荷数)相同的一类原子的总称,不同种元素最本质的区别是质子数(即核电荷数)不同,所以铝元素与锂元素的本质区别是质子数(即核电荷数)不同。
考点六
粒子结构示意图
6.如图所示的原子,在化学反应中易得到电子的是( )
A.
B.
C.
D.
【答案】D
【解析】A、最外层的电子数是1,小于4,在化学反应中失去到电子,故A不符合题意;
B、最外层的电子数是8,达到了相对稳定结构,在化学反应中不易得失电子,故B不符合题意;
C、最外层的电子数是2,小于4,在化学反应中失去到电子,故C不符合题意;
D、最外层的电子数是7,大于4,在化学反应中易得到到电子,故D符合题意。
考点七
元素周期表
7.
5G时代已经来临,高纯度单质硅(Si)是制作芯片的材料,如图是硅元素在元素周期表中的信息,下列叙述错误的是
A.
硅属于金属元素
B.
硅原子中的质子数是14
C.
硅的相对原子质量是28.09
D.
硅原子中的核外电子数是14
【答案】A
【解析】A.硅元素属于非金属元素,故符合题意;
B.由图片知:硅原子中的质子数是14,故不符合题意;
C.由图片知:硅的相对原子质量为28.09,故不符合题意;
D.因为在原子中质子数等于核外电子数,所以硅原子的核外电子数也是14,故不符合题意。
【课后作业】
A组
1.水变成水蒸气的过程中,发生变化的是(
)
A.分子质量
B.分子种类
C.分子间隔
D.分子大小
【答案】C
【解析】水变成水蒸气,发生的是物理变化,此变化过程中,分子本身不变,只是水分子间隔发生了改变。
2.为防止师生吸“二手烟”,教育部下发通知:凡进入中小学校的任何人,在任何地方、任何时候不得吸烟。从分子和原子的知识来看,造成非吸烟者在公共场所吸“二手烟”的主要原因是(
)
A.分子质量小
B.分子体积小
C.分子间有间隔
D.分子在不断运动
【答案】D
【解析】二手烟就是因为分子在不断运动,造成别人被动吸烟。
3.湖南省首届芍药花节在邵东县斫曹乡芍药花基地举行,引来无数游客,走近基地,芍药花香扑面而来,用分子观点解释正确的是
(
)
A.分子不断运动
B.分子很小
C.不同分子,性质不同
D.分子间有间隔
【答案】A
【解析】走近芍药基地,芍药花香扑面而来,说明分子是不断运动的。
4.下列关于分子和原子的说法错误的是(
)
A.“墙内开花墙外香”说明分子总在不停运动
B.“热胀冷缩”说明分子的体积随温度的变化而变化
C.在化学变化中,分子可以再分,原子不可分
D.在原子中,质子数一定等于核外电子数,但不一定等于中子数
【答案】B
【解析】墙内开花墙外香是由于构成香气的分子在不断运动,被人闻到,A正确;热胀冷缩说明分子之间的间隔发生变化,分子体积大小不变,B错误;在化学变化中分子分成原子,原子再重新组合成新的分子,所以在化学变化中,分子可以再分,原子不能再分,C正确;在原子中质子数等于核外电子数不一定等于中子数,D正确。
5.科学家最近研发出用铝稼合金制备氧气的新工艺。稼原子的质子数为31,相对原子质量为70。则稼原子的核外电子数为(
)
A.
31
B.39
C.
70
D.101
【答案】A
【解析】原子中,核外电子数=质子数,所以稼原子的核外电子数为31。
6.(2017?云南昆明)某粒子的结构示意图如图所示,该粒子是( )
A.Al
B.Al3+
C.Mg
D.Mg2+
【答案】C
【解析】由粒子的结构示意图可知,该微粒的质子数=电子数=12,是镁原子,符号为:Mg,故选C。
7.右图是元素X的一种粒子结构示意图,下列说法正确的是(
)
A.X是非金属元素
B.X的最外层电子数为8
C.该粒子最外层电子层已达到相对稳定结构
D.该粒子可表示为X-
【答案】C
【解析】结合X粒子的结构示意图可知,X是钠元素,属于金属元素,A错误;该粒子的质子数为11,核外电子数为10,因此X原子的最外层电子数为1,B错误;该粒子最外层有8个电子,达到了相对稳定结构,C正确;该粒子属于阳离子,因此其符号为X+,D错误。
8.已知元素周期表中第三周期各元素原子结构示意图如下,
下列分析错误的是(
)
A.以上原子的核外都有三个电子层
B.Na+和Mg2+的核外电子数不相同
C.Na与S形成化合物的化学式为Na2S
D.在化学反应中氯原子容易得到电子
【答案】B
【解析】从图中看出,以上原子的核外都有三个电子层,A正确;
Na+和Mg2+的核外电子数都为10个,B错误;化合物中钠为+1价,硫可以显示-2价,故Na与S形成化合物的化学式为Na2S
,C正确;氯原子最外层电子数为7>4,故在化学反应中氯原子容易得到1个电子,D正确。
9.地壳中含量最多的元素是(
)
A.氧
B.硅
C.铝
D.钙
【答案】A
【解析】地壳中含量最多元素前五位依次是氧、硅、铝、铁、钙。
10.
“含氟牙膏”中的“氟”指的是(
)
A.分子
B.原子
C.离子
D.元素
【答案】D
【解析】物质都是由元素组成的,故牙膏中的“氟”指的元素。
11.碘是人体必需的微量元素之一,有“智力元素”之称,如图为碘在元素周期表中的相关信息及原子结构示意图,据此判断下列说法正确的是( )
碘是一种金属元素
B.碘原子的核外有7个电子层
C.碘原子的核电荷数为53
D.碘的相对原子质量为126.9g
【答案】C
【解析】碘的汉字名称偏旁是“石”字,属于非金属元素,A错误;由碘原子结构示意图可知,碘原子的核外有5个电子层,B错误;由元素周期表的信息可知,碘元素的原子序数为53,原子序数=核电荷数,所以碘原子的核电荷数为53,C正确;根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,碘元素的相对原子质量为126.9,相对原子质量单位是“1”,不是“克”,D错误。
12.如图1为溴原子(Br)的结构示意图;如图2为A、B、C、D、E5种粒子的结构示意图.请回答下列问题:
(1)图1中第三层电子数与最外层电子数之差为
(注意:不能填代数式);图2中E粒子形成的单质的化学式是
(填用元素符号表示的化学式).
(2)D粒子与溴原子可以结合成化合物,该化合物的化学式为
(填用元素符号表示的化学式)
(3)图2的结构示意图中,
(填字母代号)表示的是非金属元素的粒子.
【答案】(1)11
Cl2
(2)NaBr
(3)CE
【解析】(1)图1中溴原子的核内质子数为35,因而在该原子中2+8+18+x=35,则x=7,因而该原子的第三层电子数与最外层电子数之差为18-7=11;图2中E粒子是17号元素氯元素,因而氯元素形成的单质的化学式为Cl2;(2)D粒子是钠原子,在化合物中显示的化合价为+1价,溴原子的最外层电子数为7,在化学反应中易得1个电子形成阴离子,其化合价为-1价,因而钠原子和溴原子形成的化合物的化学式为NaBr;(3)非金属元素的原子的最外层电子数一般多于或等于4个,因而图2中属于非金属元素的粒子是CE。
13.如图为A、B、C、D四种粒子的结构示意图以及硒元素在元素周期表中的信息,请按要求填空:
(1)A、B、C、D四种粒子中,属于同种元素的是
(填序号),C粒子的符号为 。
(2)由A元素和B元素形成的化合物的化学式为
。
(3)该硒原子的中子数是
。
【答案】(1)AD
O2-(2)Al2S3(3)45
【解析】(1)A、B、C、D中具有相同核电荷数的粒子属于同种元素,即A、D是同种元素的粒子;C粒子的质子数小于核外电子数,属于阴离子,所以x=8,故该粒子是氧离子,其符号为O2-;(2)A元素原子的核电荷数为16,为硫元素,B元素原子的核电荷数为13,属于铝元素,根据两种元素粒子的结构示意图可知,硫元素的化合价为-2,铝元素的化合价为+3,所以两种元素形成化合物的化学式为Al2S3;(3)根据硒元素周期表中的信息可知,硒原子的质子数为34,相对原子质量为79,根据相对原子质量约等于质子数与中子数的和,可知硒原子的中子数为79-34=45。
14.下列是钠元素、氯元素在元素周期表中的信息及有关粒子的结构示意图。请回答下列问题:
(1)D所表示的粒子是______(填写化学符号),氯原子的结构示意图是______(填序号)。
(2)D、F形成化合物的化学式是_________。
(3)与元素的化学性质关系最密切的是______(填序号)。
①原子的核外电子数
②元素的相对原子质量
③元素的原子序数
④原子的最外层电子数
【答案】(1)Na+
E
(2)NaCl
(3)④
【解析】(1)D所表示的粒子有11个质子,10个电子,故为Na+;原子中质子数等于电子数,故氯原子的结构示意图为E,F是氯离子的结构示意图;(2)D为Na+,F为Cl-,两者形成的化合物的化学式为NaCl;(3)元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,所以决定元素化学性质的是最外层电子数。
B
组
15.下表是元素周期表中第2、3周期的元素,请回答有关问题。
(1)下列各组具有相似化学性质的元素是________(填字母序号);
A.Na、Cl
B.O、S
C.F、C1
D.Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律__________;
(3)笫7号元素与笫12号元素的原子形成化合物的化学式为__________;
(4)某粒子的结构示意图为,当x-y=8时,该粒子的符号为__________;
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。下列各组粒子中属于等电子体的是________(填字母序号)。
A.
NO和O2
B.
CO和
N2
C.
SO2和
CO2
D.
PO43-和SO42-
【答案】(1)BC
(2)同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左到右最外层电子数依次增大等(答对一条即可)
(3)Mg3N2
(4)S2-
(5)BD
【解析】(1)元素的化学性质是由原子的最外层电子数决定的,因而最外层电子数相同,化学性质相似,即同一族内的元素化学性质相似,故选BC;(2)同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左到右最外层电子数依次增大等;(3)第7号元素是氮元素,最外层电子数是5,在化学反应中容易得3个电子形成阴离子,因而其化合价为-3价;第12号元素为镁元素,最外层电子数为2,在化学反应中易失去电子,形成阳离子,因而其化合价为+2价,故氮元素与镁元素形成的化合物的化学式为Mg3N2;(4)由于x-y=8,可以得出x=8+y,由该粒子的结构示意图可知,核外电子数为10+y,核内质子数为x,即8+y,由此可知核外电子数比核内质子数多2个电子,因而该粒子是的两个电子才达到稳定结构的,因而核内质子数为16,该元素为硫元素,其离子符号为S2-;(5)一氧化氮和氧气的电子数分别是15和16,不属于等电子体;一氧化碳和氮气的原子个数都是2,电子个数都相等都是14,属于等电子体;二氧化硫和二氧化碳的电子数分别是32和22,不属于等电子体;磷酸根和硫酸根的原子个数都是4,电子个数都是50,属于等电子体;因而B、D选项正确。
16.
(2017·江苏南京)核电菏数为1~18的元素的原子结构示意图等信息如下,请回答下列间题:
(1)2017年5月9日,中国科学院等单位联合发布了115号元素的中文名为“镆”。此元素原子的核电荷数为______,核外电子数为______。
(2)在第三周期中,随着原子序数的递增,元素原子核外电子排布的变化规律是_________。
(3)利用上表中给出的元素,写出含有氮元素的常见单质、氧化物、酸、键、盐的化学式各一个,并标出所写化学式中氮元素的化合价:单质______、氧化物______、酸______、碱______、盐______。
(4)以钠和氯为例,简迷结构与性质的关系。________________________。
(5)国产C919大型客机上使用了大量的铝合金。工业上用电解氧化铝(Al2O3)得到铝和氧气、试计算电解102t氧化铝最多能生成铝的质量是多少?(在答题卡上写出计算过程)
【答案】(1)115
115
(2)最外层电子数依次递增
(3)
(4)最外层电子数、得失电子与化学性质之间的关系
(5)54t。
【解析】⑴在原子中,原子序数=质子数=核电荷数=核外电子数;⑵最外层电子数从1依次增加1最后到8个电子;⑶含氮元素的单质为氮气,氮的氧化物很多,硝酸是含量氮的酸,氨水是常见的碱,硝酸钠、硝酸铵属于盐;⑷最外层电子数决定元素的化学性质,钠最外层1个电子,易失去1个电子变成Na+;氯最外层7个电子,易得到1个电子变成Cl-;⑸设电解102t氧化铝最多能生成铝的质量是x
2Al2O34Al+3O2↑
204
108
102t
x
解得x=54t
C
组
16.用微粒的观点解释“墙内开花墙外香”的主要原因是
A.
分子很小
B.
分子不断运动
C.
分子之间有间隔
D.
分子由原子构成
【答案】B
【解析】墙内开花墙外香是因为构成物质的分子是不断运动的,随着具有花香物质的分子的运动,花香物质进入鼻孔,让人闻到花香。
17.下列微粒中不能直接构成物质的是(
)
A.
分子
B.
原子
C.
中子
D.
离子
【答案】C
【解析】分子、原子、离子都可以直接构成物质,中子不能直接构成物质;
18.
关于物质的组成与结构的说法中,正确的是( )
A.物质都是由分子构成
B.原子得到电子形成阳离子
C.空气是由氮气、氧气、二氧化碳等组成的混合物
D.一个H2O分子是由两个氢元素和一个氧元素组成
【答案】C
【解析】A.分子、原子和离子都是构成物质的基本粒子,故A错误;
B.原子得到电子后显负电性,是阴离子,故B错误;
C.空气是由氮气、氧气、二氧化碳等组成的混合物,故C正确;
D.一个H2O分子是由两个氢原子和一个氧原子构成的,故D错误;
19.
下列有关粒子的说法中正确的是( )
A.分子可分,原子不可分
B.原子得到电子后带正电荷
C.分子、原子和离子都可以直接构成物质
D.原子的原子核都是由质子和中子构成的
【答案】C
【解析】A.分子可分,原子也可以再分,原子可以分成质子、中子和电子,选项说法错误;
B.电子带负电,所以原子得到电子后带负电荷,选项说法错误;
C.分子、原子和离子都可以直接构成物质,如水是由水分子构成的,铁是由铁原子构成的,氯化钠是由钠离子和氯离子构成的,选项说法正确;
D.原子核不一定都是由质子和中子构成的,如氢原子的原子核内只有质子,没有中子,选项说法错误。
20.
奶制品、豆类、虾皮等食物中含钙丰富,是日常饮食中钙的较好来源,这里的“钙”指
A.
钙离子
B.
钙原子
C.
钙元素
D.
钙单质
【答案】C
【解析】奶制品、豆类、虾皮等食物中含钙丰富,这些物质中的所说的钙不是以离子、原子、单质等形式存在,通常用元素来描述,故选:C。
21.
形状记忆合金是具有形状记忆效应的合金,人造卫星和宇宙卫星上的天线是由钛镍形状记忆合金制造的。如图所示是钛元素在元素周期表中的信息。下列关于钛的说法错误的是
A.
元素符号是Ti
B.
钛原子核外有22个电子
C.
钛的核电荷数为22
D.
钛的相对原子质量为47.87g
【答案】D
【解析】A、在元素周期表中,元素名称右上角的符号表示元素符号,故钛的元素符号是Ti,不符合题意;
B、在元素周期表中,元素名称左上角的数字表示原子序数,故钛的原子序数为22,原子的核外电子数=原子序数=22,不符合题意;
C、原子序数=核电荷数=22,不符合题意;
D、在元素周期表中,元素名称下方的数字表示相对原子质量,相对原子质量是一个比值,单位为“1”,常省略不写,故钛的相对原子质量为47.87,符合题意。
22.
“宏观辨识与微观探析”是化学学科的核心素养之一。下图是四种粒子的结构示意图,下列说法不正确的是
A.
③④属于同种元素
B.
①④均表示离子
C.
③④化学性质相似
D.
②和③可形成化合物AlCl3
【答案】C
【解析】A、元素是质子数相同的一类原子的总称,③④质子数相同,属于同种元素,不符合题意;
B、①质子数大于核外电子数,表示阳离子;④质子数小于核外电子数,表示阴离子,均表示离子,不符合题意;
C、③④最外层电子数不同,化学性质不相似,符合题意;
D、质子数=原子序数,13号元素是铝元素,通常显+3价,17号元素是氯元素,通常显-1价,故②和③可形成化合物AlCl3,不符合题意。
23.
1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验,根据实验,不能获得的结论是
A.
金原子核带正电
B.
金原子核外电子带负电
C.
金原子核体积很小
D.
金原子核的质量比α粒子大得多
【答案】B
【解析】A、由图可知,带正电的α粒子遇到原子核后,方向发生了偏转,说明原子核带正电,不符合题意;
B、由该实验不能得出金原子核外电子带负电,符合题意;
C、由图可知,绝大多数α粒子穿过金箔后仍沿原来的方向前进,只有少量α粒子的运转方向发生了偏转,说明金原子核体积很小,不符合题意;
D、由图可知,有少数的α粒子被反弹了回来,说明遇到了质量很大的物质,故金原子核的质量比α粒子大得多,不符合题意。
物质构成的奥秘
【内容概述】
本单元包括三个课题。课题1“分子和原子”说明物质是由分子和原子等微观粒子构成的,分子可以分成原子,原子能够重新组合。课题2“原子的结构”讲解了原子的构成和核外电子排布知识,进一步介绍了相对原子质量。课题3“元素”学习了元素和元素符号,简单介绍了元素周期表。本单元是学习化学微观世界的基础。其中,分子、原子的性质,应用原子、分子的性质解释有关的宏观现象,原子的构成,离子的形成,以及元素概念的理解及元素符号的写法是中考的重点。
【学习目标】
重点:
1.
构成物质的微观粒子有:分子,原子,离子。
2.
微观粒子的基本性质。轻小动距。
3.
原子的结构,核外电子排布及原子结构示意图。
4.
相对原子质量。。
5.
元素及元素符号的概念。
难点:
1.
原子的结构及核外电子排布。
2.
运用分子,原子的性质解释有关的宏观现象。。
3.
相对原子质量概念的理解。
4.
元素符号的理解记忆。
【命题分析】
1.本单元知识中物质与元素、原子、分子以及离子的区别和联系等均是中考的热点,特别是与之相关的高科技信息题是近几年中考的命题方向。命题中形式多样,考查学生的想象力和综合分析能力。将抽象具体化,对比记忆是复习的有效方法。
2.有关元素、分子、原子的概念辨析以及应用这些概念描述物质的组成或结构,在中考中常见题型为选择题或填空题。
3.结构示意图及化学符号周围数字的意义等知识点,常以图片或元素周期表的形式并且会结合热点新闻、新材料为素材考查。考查学生的阅读能力、自学能力、信息提取能力的题目将会成为主流。在备考时要对所给信息进行科学评价、判断正误,进行知识迁移。
【中考解读】
中考常考考点
难度
常考题型
1.
分子和原子的性质区别与联系
★★★
选择题、填空题、简答题
2.
用微粒的观点解释现象
★★★
选择题、填空题、实验探究题
3.
判断构成物质的粒子
★★
选择题
4.原子的构成
★★★
选择题
5.
粒子结构示意图
★★★
选择题、填空题
6.
元素的概念
★★★
选择题、填空题
7.
元素周期表
★★★
选择题、填空题
知识梳理
考点一、分子的基本性质
1、分子的体积和质量都很小。
2、分子总是在不断地运动着。
3、分子之间有间隔同种分子构成的化学性质相同,不同种分子构成的化学性质不同。
二、分子和原子的异同
分子
原子
定义
分子是保持物质化学性质的最小粒子。
原子是化学变化中的最小粒子。
性质
质量小、体积小;不断运动;有间隔;同种粒子的化学性质相同。
联系
分子是由原子构成的。分子、原子都是构成物质的微粒。
区别
在化学变化中,分子可以再分,而原子不可以再分。
备注
所有金属、稀有气体、金刚石(石墨)和硅是由原子构成的,其他大多数物质是由分子构成的。
在受热的情况下,粒子能量增大,运动速率加快。
物体的热胀冷缩现象,原因是构成物质的粒子的间隔受热时增大,遇冷时缩小。
气体容易压缩是因为构成气体的粒子的间隔较大。
不同液体混合后总体积小于原体积的和,说明粒子间是有间隔的。
一种物质如果由分子构成,那么保持它化学性质的最小粒子是分子;如果它由原子构成,那么保持它化学性质的最小粒子是原子。
考点二、原子的构成
(
原子
(不带电)
原子核(带正电)
核外电子(每个电子带一个单位负电荷;电子分层排布)
质子(每个质子带
一个单位正电荷)
中子(不带电)
在核外一个相对很大的空间内做着高速运动动
体积很小,约占原子体积的十万分之一
)
原子一般是由质子、中子和电子构成,有的原子不一定有中子,质子数也不一定等于中子数。
※构成原子的各种粒子间的关系:在原子中,原子序数=核电荷数=核内质子数=核外电子数。
原子核外电子排布
原子的核外电子最少的只有一层,最多的有七层;最外层电子数不超过8个(只有一层的,电子数不超过2个)。
原子结构示意图。(以氧原子的结构示意图为例)
离子
概念:带电的原子(或原子团)
表示:在元素符号的右上角用“+”或“-”号表示离子的电性,数字表示离子所带的电荷数,先写数字,后写“+”或“-”号,当数字为1,时省略不写。
种类:阳离子:带正电的原子(或原子团)
阴离子:带负电的原子(或原子团)
符号意义:表示离子(或一个离子)2Mg2+
相对原子质量
相对原子质量≈质子数+中子数
考点三、元素
1)定义:元素是质子数(即核电荷数)相同的一类原子的总称。
元素与原子的区别和联系:
元素
原子
区别
只表示一类原子的总称;只表示种类,不论个数,是宏观概念
既表示种类,又表示数量含义原子
是微观概念
化学变化中元素种类不变,但形态可能变化
化学变化中,原子种类和数量不变,但最外层电子数可能变化
联系
元素是同一类原子的总称,原子是构成元素的基本单元
元素之最:地壳中含量(质量分数)排在前五位的元素:氧、硅、铝、铁、钙
2)元素符号的意义:元素符号不仅表示一种元素,还表示这种元素的一个原子。如果物质由原子构成,元素符号还可以表示一种物质。
如果元素符号前加上系数,就只表示该原子的个数,只具有微观意义。
3)元素周期表
1、原子序数:原子序数=核内质子数=核电荷数=核外电子数
2、横行(周期):每一个横行叫一个周期,共有七个周期。同一周期元素原子的电子层数相等。
纵行(族):每一个纵行叫一个族,共有18个纵行16个族,其中8、9、10三个纵行共同组成一个族。
4、每一格:能够表示该元素的名称、符号、原子序数、相对原子质量。
【考点详览】
考点一
利用分子和原子的性质分析和解决问题
1.下列对有关事实的解释错误的是
A.
干冰升华—一分子的体积变大
B.
冰水共存物属于纯净物一一冰和水都由水分子构成
C.
氧化汞受热分解—一在化学变化中分子可以分为原子
D.
酒精挥发一—分子总是在不断运动着
【答案】A
【解析】A、干冰升华是因为分子之间的间隔变大,分子的体积不变,符合题意;
B、冰和水都由水分子构成,故冰水共存物只由水一种物质组成,属于纯净物,不符合题意;
C、氧化汞受热分解是因为在化学变化中,分子可以分为原子,原子不能再分,不符合题意;
D、酒精挥发,是因为分子在不断运动,不符合题意。
考点二
微粒与元素的关系
2.
世界万物都是由极其微小的粒子构成的,下列说法正确的是( )
A.海水是由海水分子构成的
B.分子、原子、离子都能直接构成物质
C.二氧化碳是由碳原子和氧原子构成的
D.自然界中的物质都是由质子、中子、电子等粒子构成的
【答案】B
【解析】A、海水是混合物,不存在海水分子,错误;
B、分子、原子、离子都能直接构成物质,正确;
C、二氧化碳分子由碳原子和氧原子构成,错误;
D、自然界中的物质是由分子、原子、离子构成的,质子、中子、电子是构成原子的基本微粒,错误
考点三
原子的结构
3.
原子核中一定含有的粒子是( )
A.中子
B.质子
C.电子
D.质子和电子
【答案】B
【解析】原子核是由质子和中子构成的,但是中子不一定存在,例如普通氢原子不含有中子,故原子核中一定含有质子。
考点四
判断构成物质的粒子
4.下列物质中,由分子构成的是(
)
A.
水
B.
汞
C.
氯化钠
D.
金刚石
【答案】A
【解析】A、水是由水分子构成的,故选项正确。
B、汞属于金属单质,是由汞原子直接构成的,故选项错误。
C、氯化钠是由钠离子和氯离子构成的,故选项错误。
D、金刚石属于固态非金属单质,是由碳原子直接构成的,故选项错误。
考点五
元素的概念
5.2020年1月14日,C919大型客机第二架机迎来了进入2020年后的第一次飞行。C919部分机身采用了新型的铝锂合金。铝锂合金中铝(Al)元素与锂(Li)元素的本质区别是( )
A.
相对原于质量不同
B.
原子的中子数不同
C.
原子的电子数不同
D.
原子的质子数不同
【答案】D
【解析】元素是质子数(即核电荷数)相同的一类原子的总称,不同种元素最本质的区别是质子数(即核电荷数)不同,所以铝元素与锂元素的本质区别是质子数(即核电荷数)不同。
考点六
粒子结构示意图
6.如图所示的原子,在化学反应中易得到电子的是( )
A.
B.
C.
D.
【答案】D
【解析】A、最外层的电子数是1,小于4,在化学反应中失去到电子,故A不符合题意;
B、最外层的电子数是8,达到了相对稳定结构,在化学反应中不易得失电子,故B不符合题意;
C、最外层的电子数是2,小于4,在化学反应中失去到电子,故C不符合题意;
D、最外层的电子数是7,大于4,在化学反应中易得到到电子,故D符合题意。
考点七
元素周期表
7.
5G时代已经来临,高纯度单质硅(Si)是制作芯片的材料,如图是硅元素在元素周期表中的信息,下列叙述错误的是
A.
硅属于金属元素
B.
硅原子中的质子数是14
C.
硅的相对原子质量是28.09
D.
硅原子中的核外电子数是14
【答案】A
【解析】A.硅元素属于非金属元素,故符合题意;
B.由图片知:硅原子中的质子数是14,故不符合题意;
C.由图片知:硅的相对原子质量为28.09,故不符合题意;
D.因为在原子中质子数等于核外电子数,所以硅原子的核外电子数也是14,故不符合题意。
【课后作业】
A组
1.水变成水蒸气的过程中,发生变化的是(
)
A.分子质量
B.分子种类
C.分子间隔
D.分子大小
【答案】C
【解析】水变成水蒸气,发生的是物理变化,此变化过程中,分子本身不变,只是水分子间隔发生了改变。
2.为防止师生吸“二手烟”,教育部下发通知:凡进入中小学校的任何人,在任何地方、任何时候不得吸烟。从分子和原子的知识来看,造成非吸烟者在公共场所吸“二手烟”的主要原因是(
)
A.分子质量小
B.分子体积小
C.分子间有间隔
D.分子在不断运动
【答案】D
【解析】二手烟就是因为分子在不断运动,造成别人被动吸烟。
3.湖南省首届芍药花节在邵东县斫曹乡芍药花基地举行,引来无数游客,走近基地,芍药花香扑面而来,用分子观点解释正确的是
(
)
A.分子不断运动
B.分子很小
C.不同分子,性质不同
D.分子间有间隔
【答案】A
【解析】走近芍药基地,芍药花香扑面而来,说明分子是不断运动的。
4.下列关于分子和原子的说法错误的是(
)
A.“墙内开花墙外香”说明分子总在不停运动
B.“热胀冷缩”说明分子的体积随温度的变化而变化
C.在化学变化中,分子可以再分,原子不可分
D.在原子中,质子数一定等于核外电子数,但不一定等于中子数
【答案】B
【解析】墙内开花墙外香是由于构成香气的分子在不断运动,被人闻到,A正确;热胀冷缩说明分子之间的间隔发生变化,分子体积大小不变,B错误;在化学变化中分子分成原子,原子再重新组合成新的分子,所以在化学变化中,分子可以再分,原子不能再分,C正确;在原子中质子数等于核外电子数不一定等于中子数,D正确。
5.科学家最近研发出用铝稼合金制备氧气的新工艺。稼原子的质子数为31,相对原子质量为70。则稼原子的核外电子数为(
)
A.
31
B.39
C.
70
D.101
【答案】A
【解析】原子中,核外电子数=质子数,所以稼原子的核外电子数为31。
6.(2017?云南昆明)某粒子的结构示意图如图所示,该粒子是( )
A.Al
B.Al3+
C.Mg
D.Mg2+
【答案】C
【解析】由粒子的结构示意图可知,该微粒的质子数=电子数=12,是镁原子,符号为:Mg,故选C。
7.右图是元素X的一种粒子结构示意图,下列说法正确的是(
)
A.X是非金属元素
B.X的最外层电子数为8
C.该粒子最外层电子层已达到相对稳定结构
D.该粒子可表示为X-
【答案】C
【解析】结合X粒子的结构示意图可知,X是钠元素,属于金属元素,A错误;该粒子的质子数为11,核外电子数为10,因此X原子的最外层电子数为1,B错误;该粒子最外层有8个电子,达到了相对稳定结构,C正确;该粒子属于阳离子,因此其符号为X+,D错误。
8.已知元素周期表中第三周期各元素原子结构示意图如下,
下列分析错误的是(
)
A.以上原子的核外都有三个电子层
B.Na+和Mg2+的核外电子数不相同
C.Na与S形成化合物的化学式为Na2S
D.在化学反应中氯原子容易得到电子
【答案】B
【解析】从图中看出,以上原子的核外都有三个电子层,A正确;
Na+和Mg2+的核外电子数都为10个,B错误;化合物中钠为+1价,硫可以显示-2价,故Na与S形成化合物的化学式为Na2S
,C正确;氯原子最外层电子数为7>4,故在化学反应中氯原子容易得到1个电子,D正确。
9.地壳中含量最多的元素是(
)
A.氧
B.硅
C.铝
D.钙
【答案】A
【解析】地壳中含量最多元素前五位依次是氧、硅、铝、铁、钙。
10.
“含氟牙膏”中的“氟”指的是(
)
A.分子
B.原子
C.离子
D.元素
【答案】D
【解析】物质都是由元素组成的,故牙膏中的“氟”指的元素。
11.碘是人体必需的微量元素之一,有“智力元素”之称,如图为碘在元素周期表中的相关信息及原子结构示意图,据此判断下列说法正确的是( )
碘是一种金属元素
B.碘原子的核外有7个电子层
C.碘原子的核电荷数为53
D.碘的相对原子质量为126.9g
【答案】C
【解析】碘的汉字名称偏旁是“石”字,属于非金属元素,A错误;由碘原子结构示意图可知,碘原子的核外有5个电子层,B错误;由元素周期表的信息可知,碘元素的原子序数为53,原子序数=核电荷数,所以碘原子的核电荷数为53,C正确;根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,碘元素的相对原子质量为126.9,相对原子质量单位是“1”,不是“克”,D错误。
12.如图1为溴原子(Br)的结构示意图;如图2为A、B、C、D、E5种粒子的结构示意图.请回答下列问题:
(1)图1中第三层电子数与最外层电子数之差为
(注意:不能填代数式);图2中E粒子形成的单质的化学式是
(填用元素符号表示的化学式).
(2)D粒子与溴原子可以结合成化合物,该化合物的化学式为
(填用元素符号表示的化学式)
(3)图2的结构示意图中,
(填字母代号)表示的是非金属元素的粒子.
【答案】(1)11
Cl2
(2)NaBr
(3)CE
【解析】(1)图1中溴原子的核内质子数为35,因而在该原子中2+8+18+x=35,则x=7,因而该原子的第三层电子数与最外层电子数之差为18-7=11;图2中E粒子是17号元素氯元素,因而氯元素形成的单质的化学式为Cl2;(2)D粒子是钠原子,在化合物中显示的化合价为+1价,溴原子的最外层电子数为7,在化学反应中易得1个电子形成阴离子,其化合价为-1价,因而钠原子和溴原子形成的化合物的化学式为NaBr;(3)非金属元素的原子的最外层电子数一般多于或等于4个,因而图2中属于非金属元素的粒子是CE。
13.如图为A、B、C、D四种粒子的结构示意图以及硒元素在元素周期表中的信息,请按要求填空:
(1)A、B、C、D四种粒子中,属于同种元素的是
(填序号),C粒子的符号为 。
(2)由A元素和B元素形成的化合物的化学式为
。
(3)该硒原子的中子数是
。
【答案】(1)AD
O2-(2)Al2S3(3)45
【解析】(1)A、B、C、D中具有相同核电荷数的粒子属于同种元素,即A、D是同种元素的粒子;C粒子的质子数小于核外电子数,属于阴离子,所以x=8,故该粒子是氧离子,其符号为O2-;(2)A元素原子的核电荷数为16,为硫元素,B元素原子的核电荷数为13,属于铝元素,根据两种元素粒子的结构示意图可知,硫元素的化合价为-2,铝元素的化合价为+3,所以两种元素形成化合物的化学式为Al2S3;(3)根据硒元素周期表中的信息可知,硒原子的质子数为34,相对原子质量为79,根据相对原子质量约等于质子数与中子数的和,可知硒原子的中子数为79-34=45。
14.下列是钠元素、氯元素在元素周期表中的信息及有关粒子的结构示意图。请回答下列问题:
(1)D所表示的粒子是______(填写化学符号),氯原子的结构示意图是______(填序号)。
(2)D、F形成化合物的化学式是_________。
(3)与元素的化学性质关系最密切的是______(填序号)。
①原子的核外电子数
②元素的相对原子质量
③元素的原子序数
④原子的最外层电子数
【答案】(1)Na+
E
(2)NaCl
(3)④
【解析】(1)D所表示的粒子有11个质子,10个电子,故为Na+;原子中质子数等于电子数,故氯原子的结构示意图为E,F是氯离子的结构示意图;(2)D为Na+,F为Cl-,两者形成的化合物的化学式为NaCl;(3)元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,所以决定元素化学性质的是最外层电子数。
B
组
15.下表是元素周期表中第2、3周期的元素,请回答有关问题。
(1)下列各组具有相似化学性质的元素是________(填字母序号);
A.Na、Cl
B.O、S
C.F、C1
D.Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律__________;
(3)笫7号元素与笫12号元素的原子形成化合物的化学式为__________;
(4)某粒子的结构示意图为,当x-y=8时,该粒子的符号为__________;
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。下列各组粒子中属于等电子体的是________(填字母序号)。
A.
NO和O2
B.
CO和
N2
C.
SO2和
CO2
D.
PO43-和SO42-
【答案】(1)BC
(2)同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左到右最外层电子数依次增大等(答对一条即可)
(3)Mg3N2
(4)S2-
(5)BD
【解析】(1)元素的化学性质是由原子的最外层电子数决定的,因而最外层电子数相同,化学性质相似,即同一族内的元素化学性质相似,故选BC;(2)同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左到右最外层电子数依次增大等;(3)第7号元素是氮元素,最外层电子数是5,在化学反应中容易得3个电子形成阴离子,因而其化合价为-3价;第12号元素为镁元素,最外层电子数为2,在化学反应中易失去电子,形成阳离子,因而其化合价为+2价,故氮元素与镁元素形成的化合物的化学式为Mg3N2;(4)由于x-y=8,可以得出x=8+y,由该粒子的结构示意图可知,核外电子数为10+y,核内质子数为x,即8+y,由此可知核外电子数比核内质子数多2个电子,因而该粒子是的两个电子才达到稳定结构的,因而核内质子数为16,该元素为硫元素,其离子符号为S2-;(5)一氧化氮和氧气的电子数分别是15和16,不属于等电子体;一氧化碳和氮气的原子个数都是2,电子个数都相等都是14,属于等电子体;二氧化硫和二氧化碳的电子数分别是32和22,不属于等电子体;磷酸根和硫酸根的原子个数都是4,电子个数都是50,属于等电子体;因而B、D选项正确。
16.
(2017·江苏南京)核电菏数为1~18的元素的原子结构示意图等信息如下,请回答下列间题:
(1)2017年5月9日,中国科学院等单位联合发布了115号元素的中文名为“镆”。此元素原子的核电荷数为______,核外电子数为______。
(2)在第三周期中,随着原子序数的递增,元素原子核外电子排布的变化规律是_________。
(3)利用上表中给出的元素,写出含有氮元素的常见单质、氧化物、酸、键、盐的化学式各一个,并标出所写化学式中氮元素的化合价:单质______、氧化物______、酸______、碱______、盐______。
(4)以钠和氯为例,简迷结构与性质的关系。________________________。
(5)国产C919大型客机上使用了大量的铝合金。工业上用电解氧化铝(Al2O3)得到铝和氧气、试计算电解102t氧化铝最多能生成铝的质量是多少?(在答题卡上写出计算过程)
【答案】(1)115
115
(2)最外层电子数依次递增
(3)
(4)最外层电子数、得失电子与化学性质之间的关系
(5)54t。
【解析】⑴在原子中,原子序数=质子数=核电荷数=核外电子数;⑵最外层电子数从1依次增加1最后到8个电子;⑶含氮元素的单质为氮气,氮的氧化物很多,硝酸是含量氮的酸,氨水是常见的碱,硝酸钠、硝酸铵属于盐;⑷最外层电子数决定元素的化学性质,钠最外层1个电子,易失去1个电子变成Na+;氯最外层7个电子,易得到1个电子变成Cl-;⑸设电解102t氧化铝最多能生成铝的质量是x
2Al2O34Al+3O2↑
204
108
102t
x
解得x=54t
C
组
16.用微粒的观点解释“墙内开花墙外香”的主要原因是
A.
分子很小
B.
分子不断运动
C.
分子之间有间隔
D.
分子由原子构成
【答案】B
【解析】墙内开花墙外香是因为构成物质的分子是不断运动的,随着具有花香物质的分子的运动,花香物质进入鼻孔,让人闻到花香。
17.下列微粒中不能直接构成物质的是(
)
A.
分子
B.
原子
C.
中子
D.
离子
【答案】C
【解析】分子、原子、离子都可以直接构成物质,中子不能直接构成物质;
18.
关于物质的组成与结构的说法中,正确的是( )
A.物质都是由分子构成
B.原子得到电子形成阳离子
C.空气是由氮气、氧气、二氧化碳等组成的混合物
D.一个H2O分子是由两个氢元素和一个氧元素组成
【答案】C
【解析】A.分子、原子和离子都是构成物质的基本粒子,故A错误;
B.原子得到电子后显负电性,是阴离子,故B错误;
C.空气是由氮气、氧气、二氧化碳等组成的混合物,故C正确;
D.一个H2O分子是由两个氢原子和一个氧原子构成的,故D错误;
19.
下列有关粒子的说法中正确的是( )
A.分子可分,原子不可分
B.原子得到电子后带正电荷
C.分子、原子和离子都可以直接构成物质
D.原子的原子核都是由质子和中子构成的
【答案】C
【解析】A.分子可分,原子也可以再分,原子可以分成质子、中子和电子,选项说法错误;
B.电子带负电,所以原子得到电子后带负电荷,选项说法错误;
C.分子、原子和离子都可以直接构成物质,如水是由水分子构成的,铁是由铁原子构成的,氯化钠是由钠离子和氯离子构成的,选项说法正确;
D.原子核不一定都是由质子和中子构成的,如氢原子的原子核内只有质子,没有中子,选项说法错误。
20.
奶制品、豆类、虾皮等食物中含钙丰富,是日常饮食中钙的较好来源,这里的“钙”指
A.
钙离子
B.
钙原子
C.
钙元素
D.
钙单质
【答案】C
【解析】奶制品、豆类、虾皮等食物中含钙丰富,这些物质中的所说的钙不是以离子、原子、单质等形式存在,通常用元素来描述,故选:C。
21.
形状记忆合金是具有形状记忆效应的合金,人造卫星和宇宙卫星上的天线是由钛镍形状记忆合金制造的。如图所示是钛元素在元素周期表中的信息。下列关于钛的说法错误的是
A.
元素符号是Ti
B.
钛原子核外有22个电子
C.
钛的核电荷数为22
D.
钛的相对原子质量为47.87g
【答案】D
【解析】A、在元素周期表中,元素名称右上角的符号表示元素符号,故钛的元素符号是Ti,不符合题意;
B、在元素周期表中,元素名称左上角的数字表示原子序数,故钛的原子序数为22,原子的核外电子数=原子序数=22,不符合题意;
C、原子序数=核电荷数=22,不符合题意;
D、在元素周期表中,元素名称下方的数字表示相对原子质量,相对原子质量是一个比值,单位为“1”,常省略不写,故钛的相对原子质量为47.87,符合题意。
22.
“宏观辨识与微观探析”是化学学科的核心素养之一。下图是四种粒子的结构示意图,下列说法不正确的是
A.
③④属于同种元素
B.
①④均表示离子
C.
③④化学性质相似
D.
②和③可形成化合物AlCl3
【答案】C
【解析】A、元素是质子数相同的一类原子的总称,③④质子数相同,属于同种元素,不符合题意;
B、①质子数大于核外电子数,表示阳离子;④质子数小于核外电子数,表示阴离子,均表示离子,不符合题意;
C、③④最外层电子数不同,化学性质不相似,符合题意;
D、质子数=原子序数,13号元素是铝元素,通常显+3价,17号元素是氯元素,通常显-1价,故②和③可形成化合物AlCl3,不符合题意。
23.
1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验,根据实验,不能获得的结论是
A.
金原子核带正电
B.
金原子核外电子带负电
C.
金原子核体积很小
D.
金原子核的质量比α粒子大得多
【答案】B
【解析】A、由图可知,带正电的α粒子遇到原子核后,方向发生了偏转,说明原子核带正电,不符合题意;
B、由该实验不能得出金原子核外电子带负电,符合题意;
C、由图可知,绝大多数α粒子穿过金箔后仍沿原来的方向前进,只有少量α粒子的运转方向发生了偏转,说明金原子核体积很小,不符合题意;
D、由图可知,有少数的α粒子被反弹了回来,说明遇到了质量很大的物质,故金原子核的质量比α粒子大得多,不符合题意。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
