《物质的定量分析》教学分析及建议
图片预览






文档简介
(共41张PPT)
物质的定量分析
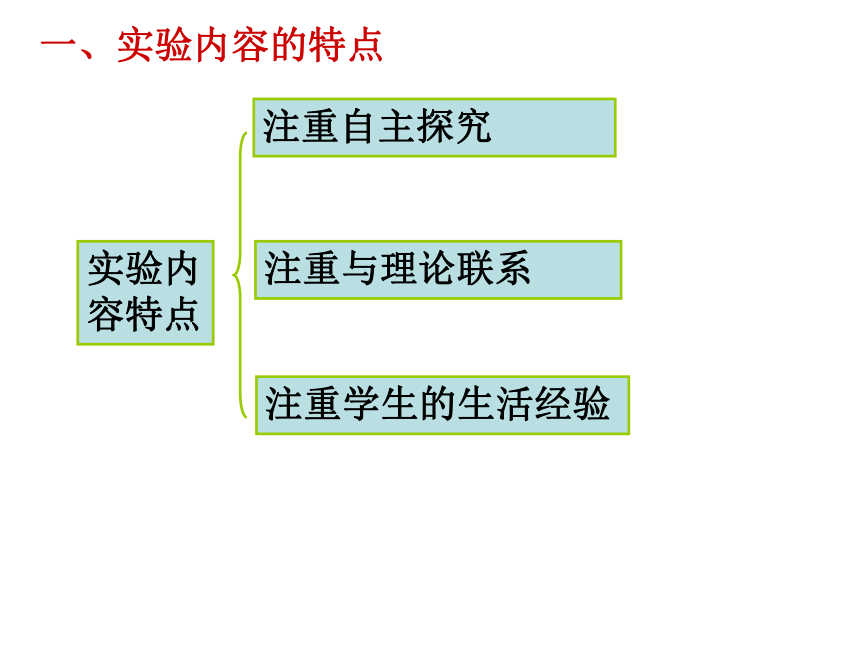
实验内容特点
注重自主探究
注重与理论联系
注重学生的生活经验
一、实验内容的特点
二、新课程化学实验教学的策略
3、积极引导学生质疑探究,培养探究精神和实验能力。
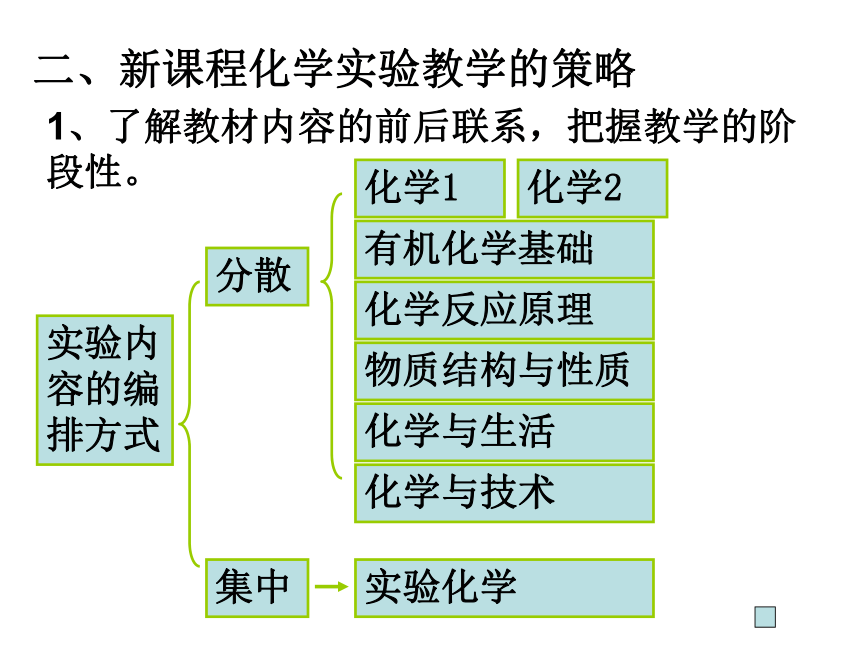
1、了解教材内容的前后联系,把握教学的阶段性。
2、着力培养对实验现象的观察和分析能力。
二、新课程化学实验教学的策略
1、了解教材内容的前后联系,把握教学的阶段性。
实验内容的编排方式
分散
集中
化学1
化学2
有机化学基础
化学反应原理
物质结构与性质
化学与生活
化学与技术
实验化学
本专题在实验化学中的地位和作用
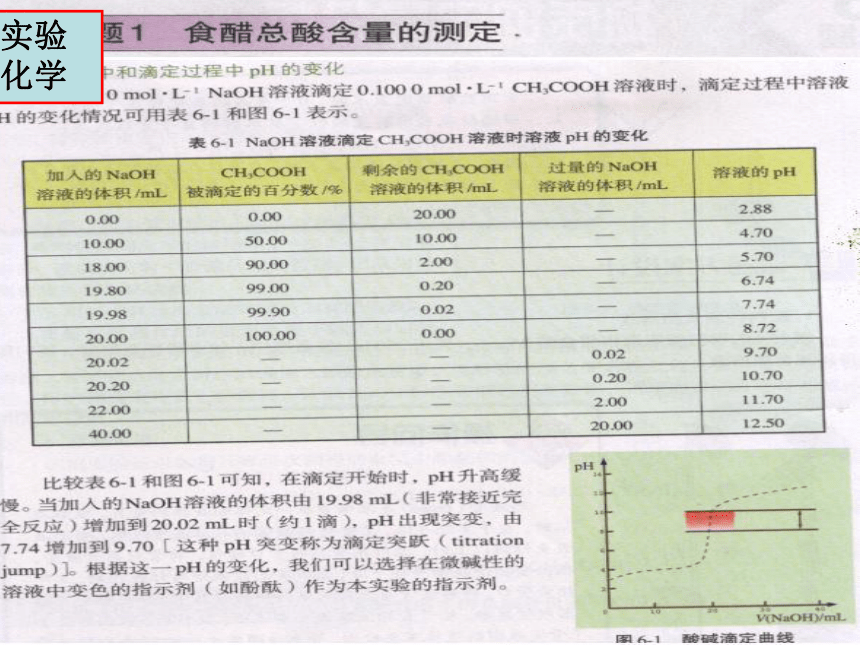
在化学研究中,我们不仅需要知道化学物质的组成元素、组成成分,而且需要知道某物质组成元素、组成成分的含量,这就需要用定量分析的方法来测定。定量分析在科学研究中的重要性是不言而喻的。
本专题以融生活和化学知识于一体的两个课题为主线,介绍定量分析的一般过程、定量分析实验方案的设计方法、常用定量分析仪器的使用方法,以及如何记录和处理实验数据等内容。
课 题1
食醋总酸含量的测定
酸碱中和滴定在各模块中的呈现
模块 专题、单元 实验内容
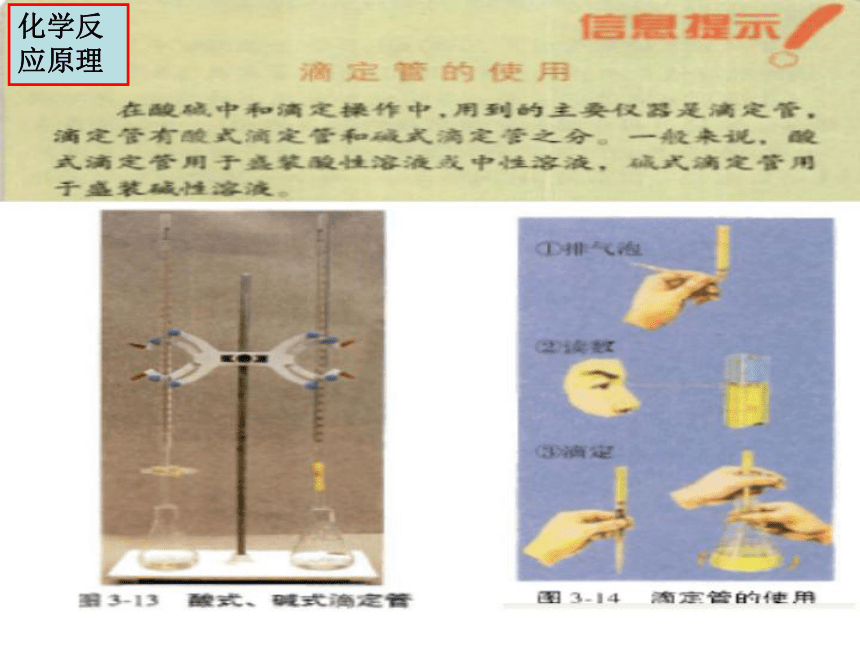
化学反应原理 专题3 第二单元《溶液的酸碱性》 [信息提示]滴定管的使用
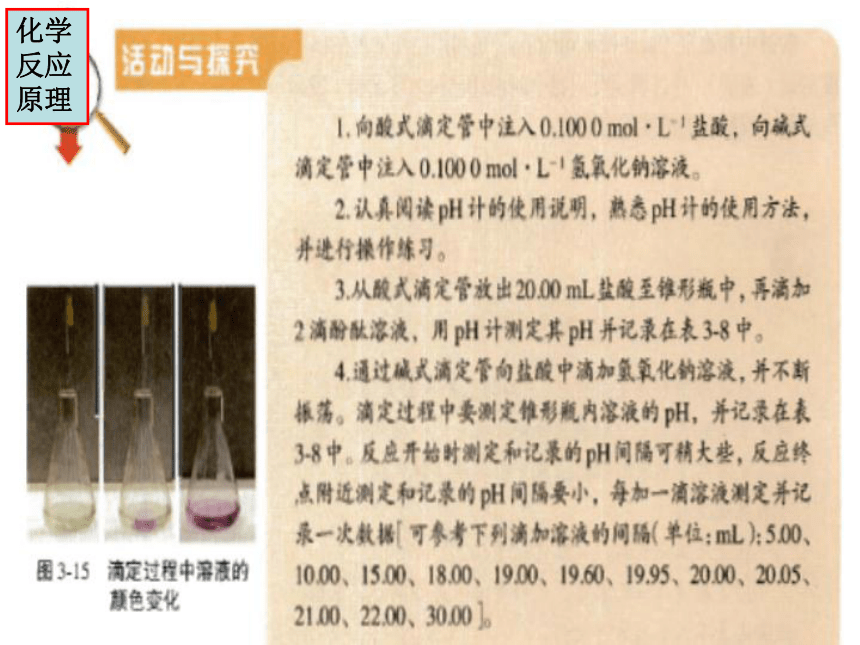
[活动与探究]
0.1000mol/LNaOH滴定20.00mL0.1000mol/LHCl
[活动与探究]用标准盐酸测定NaOH溶液的浓度
实验化学 专题6《物质的定量分析》 课题1 食醋总酸度的测定
[拓展实验]配制并标定氢氧化钠溶液
化学反应原理
化学反应原理
化学反应原理
实验化学
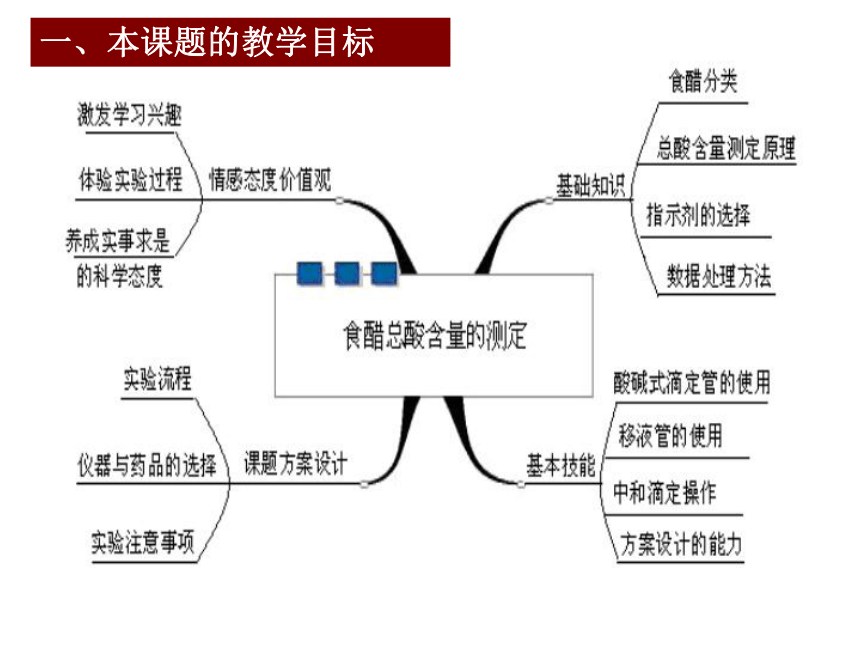
一、本课题的教学目标
实验新特点
1.移液管的使用
2.指示剂的选择
3.相对平均偏差的计算
4.涉及滴定曲线
5.运用中和滴定原理设计实验方案解决实际问题
(与旧人教版比较)
实验原理
1.化学反应原理:
CH3COOH+NaOH = CH3COONa + H2O
HnA(有机酸)+nNaOH = NanA + nH2O
3.实验数据的处理:
m(CH3COOH) = c(NaOH)·V(NaOH)·M(CH3COOH)
100mL食醋中所含醋酸的质量为:
m′(CH3COOH) = c(NaOH)·V(NaOH)·
M(CH3COOH)× ×
根据3次接近的平行测定值,可计算食醋中总酸含量的平均值。
平均相对偏差的计算
绝对偏差(di)表示测定值(xi)与平均值(x)之差:
di=xi-x, x=
平均偏差(d)为各个单个偏差的平均值:
d= =
相对平均偏差:Rd = ×100%
x1+ x2+x3+…+xn
n
d1+ d2+d3+…+dn
n
|x1-x|+|x2-x|+|x3-x|+…+|xn-x|
n
n
d
实验准备
实验方案
实验方案
仪器的洗涤
溶液的装配
★NaOH标准溶液配制
中和滴定
指示剂的选择
滴定与记录
数据处理与结论
数据处理
误差分析
记录与结论
NaOH标准溶液浓度c(NaOH)= 0.1000 mol/L
实验次数 第一次 第二次 第三次
待测食醋的体积初读数/mL
待测食醋的体积终读数/mL
待测食醋的体积
V(CH3COOH)/mL 25 25 25
NaOH标准溶液的体积初读数/mL 2.00 2.32 2.14
NaOH标准溶液的体积终读数/mL 22.68 23.04 22.85
NaOH标准溶液的体积
V(NaOH)/mL 20.68 20.72 20.71
实验测得的食醋总酸含量(g/100mL) 4.963 4.973 4.907
食醋总酸含量的平均值(g/100mL) 4.968
相对平均偏差/% 0.067%
食醋的
选择
1.白醋:效果较好
2.香醋:稀释10倍
3.陈醋: 颜色很深,影响终点判断
注意事项
消除CO2对
实验的影响
配制NaOH溶液和稀释食醋的蒸馏水在实验前应加热煮沸2~3分钟,以尽可能除去溶解的CO2,并快速冷却至室温。
(1)移液管尖嘴残留液体的处理
(2)滴定前后碱式滴定管中不能有气泡
(3)滴定管使用前要用待盛放的溶液润洗
锥形瓶不能用待测液润洗
(4)滴定终点的判断
(5)读数时是否平视
几个关健
实验操作
交流与讨论
可结合教学参考102页的说明。
拓展课题6-1 配制并标定氢氧化钠溶液
(1)配制NaOH饱和溶液,放置一段时间后,吸取上 层清液,稀释到约0.1mol/L,即可得NaOH标准溶液。
(2)用邻苯二甲酸氢钾(HOOCC6H4COOK)作为基准物质,以酚酞作为指示剂,标定上述NaOH标准溶液。
m/M = c(NaOH)×V(NaOH)
记录与结论
实验次数 第一次 第二次 第三次
邻苯二甲酸氢钾的质量/g 0.562 0.551 0.574
氢氧化钠溶液的体积初读数/ml 2.00 5.80 2.00
氢氧化钠溶液的体积终读数/ml
27.98 31.55 28.89
氢氧化钠溶液的体积/ml
25.98 25.75 26.89
氢氧化钠溶液的浓度/mol/L 0.09451 0.09554 0.09577
氢氧化钠溶液的平均值 0.09526
平均相对偏差 0.14%
实验几点说明
1.邻苯二甲酸氢钾的质量的称量可以用分析天平。
2.氢氧化钠溶液的稀释应用新煮沸而又迅速冷却的蒸馏水。
3.邻苯二甲酸氢钾的溶解应小心振荡,需要一定的时间。
4.从相对平均偏差来看,实验结果在误差范围之内,建议教师氢氧化钠标准溶液的浓度采用0.1000mol/L。
5.教师应对学生说明有效数字的运算方法。
教学建议
1.课时分配
第一课时:食酸的分类,食醋总酸含量的测定原理,
滴定过程中pH的变化以及实验数据的处
理方法。
第二课时:通过氢氧化钠标准溶液的配制和标定,复习滴定管的使用和中和滴定操作,练习移液管的使用。
第三课时:课题方案的设计与论证。完成食酸总酸含量测定的实验与评价。
分组公布实验方案,
说出各自的困惑
各组对各种方案
进行质疑与评价
学生设计实验方案
实验与评价
初步实施实验方案
细化实验方案
4
3
2
5
6
1
食酸总酸
含量的测定
2.教学设计思路(课题方案设计教学)
课 题 2
镀锌铁皮锌镀层厚度的测定
知识与技能
⑴学会用电子天平称量物质的质量。
⑵学会用化学方法测定镀锌铁皮的锌镀层厚度。
⑶了解测定过程中产生误差的原因,并能对实验中的数据进行处理。
⑷学会书写定量测定与分析实验报告。
过程与方法
通过实验使学生进一步掌握定量分析的一般方法。
情感、态度、价值观
提高学生的实验兴趣,培养学生勤与创新、敢与实践的科学 品质。
教学目标
在“知识预备”部分的教学中,教师首先要引导学生复习和探究锌、铁的性质,复习原电池反应、电镀的工作原理,使学生不仅掌握教材上介绍的测定原理和测定方法,而且让学生尝试自己设计多种实验方案,并进行预备实验,找出较好的测定方法。
在数据记录与处理的教学中,建议教师提醒学生注意数据的记录、误差和有效数字的运算规则。
教学建议
h =△m/(2ρS)
实验原理
△m:
①用____________________测量反应前后的质量
② 用________________来溶解铁皮表面的锌镀层
电子天平(0.001g)
6 mol/LHCl
引导学生设计方案
镀锌铁片在HCl中产生H2的速率由快迅速转慢
实验现象
说明: 1、该现象非常明显,学生很容易做出判断
2、不宜用硫酸替代盐酸做该实验
3、耗时短,大约2分钟即可完成
1、镀锌铁片反应前后质量的精确测量与读数。
2、锌在酸中完全溶解后,产生氢气显著变慢,准确判断锌完全反应是本实验最重要的一环。若判断过早则会使锌未完全溶解;若过迟会使铁部分溶解,都会增加实验误差。
3、数据的准确记录与处理及误差分析。
操作要点
记录与结论
数据记录 数据处理
铁片A,长 5.00 cm宽5.06cm
铁片A,长 4.92cm宽4.90cm
铁片A,长 4.98cm宽5.00cm
镀锌铁片A,m1(A)=5.464克
镀锌铁片B,m1(B)=5.255克
镀锌铁片C,m1(C)=5.429
铁片A,m2(A)=5.322
铁片B,m2(B)=5.121
铁片C,m2(B)=5.290
镀锌
铁片 单侧厚度/mm 平均厚度/mm 相当平均偏差/%
镀锌铁片A 0.0393
0.0391
0.34%
镀锌
铁片B 0.0389
镀锌
铁片C
0.0391
一些思考
在本课题中,用到了精度达0.001g的电子天平。由于在以前的化学实验中并不需要该仪器,所以一般来讲相当学校目前可能并不具有该实验仪器,再加上该仪器价格不菲及相关领导可能没有及时给予重视,则很可能造成经费不宽裕的地区或学校放弃对该仪器的配备。如果是这样,该实验则无法开展,就会迫使实验成为“纸上谈兵”。我尝试了省新课程培训时介绍的方法:方法是用螺旋测微器直接测量铁片反应前后的厚度,则厚度差的1/2即为镀锌铁皮的锌镀层厚度 (h)。具体比较见下表。
用螺旋测微器测铁片的厚度
数据记录 镀锌铁皮 质量(g) 面积(mm2) 厚度*(mm)
反应前 5.464 2530 0.284
反应后 5.322 o.203
数据处理 锌镀层厚度(mm) 依据 h =△m/(2ρS)(锌的密度ρ=7.14g/cm3) h =(6.464-5.322)/(2·7.14·10-3·2530)=0.0393mm
锌镀层厚度(mm) 依据厚度差的1/2即为镀锌铁皮的锌镀层厚度(h)
h =(0.284-0.203)/2=0.0405mm
注:测定厚度为四次测定(铁皮上均匀取四个点)的平均值
数据与结论
附:教参提供其它实验方案
方案1:将镀锌铁片投入足量的6mol/L的盐酸中,使其完全溶解,通过测量生成氢气的体积,计算出铁片上锌的质量。
评价:实验耗时长
方案2:将镀锌铁片投入足量的3 mol/L一硫酸亚铁溶液中,过一段时间后,取出铁片,用水冲、洗烘干后,再称量。
评价:几乎不反应
方案3:将镀锌铁片投入足量的6mol/L盐酸中,使其完全溶解,再在所得溶液中加入过量的NaOH溶液,将沉淀过滤,待滤渣烘干、灼烧后,再称量。
评价:操作麻烦,实验精确度不高
方案4:将镀锌铁片投入足量的6 mol·L-1NaOH溶液中,待充分反应后,取出铁片,用水冲洗、烘干后,再称量。
评价:操作简单,原理科学,但反应速率太小
方案5:将镀锌铁片与另一块纯铁片用一根导线连接起来,放入盛有3mol·L-1硫酸亚铁溶液的烧杯中,过一段时间后,取出铁片,用水冲洗、烘干后,再称量。
评价:设计合理,但终点不好判断
方案6:将镀锌铁片与石墨用一根导线连接起来,放入盛有6mol·L-1NaOH溶液中,当石墨棒过一段时间后,取出铁片,用水冲洗、烘干后,再称量。
评价:操作简单,但耗时长
拓展课题6-2 水果中维生素C含量的测定
1、维生素C标准溶液的配制
将5片100mg的维生素C药片投入到盛有50ml蒸馏水的烧杯中,当Vc药品全部溶解后,转移到250ml容量瓶中,并稀释到刻度。
2、橙汁的准备
取鲜橙若干,榨汁,过滤备用。
3、Vc药片中Vc含量的测定
移取20ml Vc 标准液注入250ml锥形瓶中,加入1ml0.1mol/L盐酸,再加入1-2ml淀粉溶液,用0.010mol/L碘水滴定,直至溶液显蓝色且半分钟不褪色,记录消耗碘水体积。重复两次,取平均值。
4、橙汁中Vc含量的测定
移取20ml 橙汁注入250ml锥形瓶中,加入1ml0.1mol/L盐酸,再加入1-2ml淀粉溶液,用0.010mol/L碘水滴定,直至溶液显蓝色且半分钟不褪色,记录消耗碘水体积。重复两次,取平均值。
记录与结论
编号 滴定前的读数/ml 滴定前的读数/ml 消耗碘液体积/ml 消耗碘液体积的平均值/ml
维生素C
标准溶液 1 3.26 27.36 24.10 24.07
2 2.28 26.42 24.14
橙汁 3 12.77 17.58 4.81 4.79
4 17.58 22.35 4.77
橙汁中维生素C的含量=398.0mg/L
几点说明:
1、维生素C 药片的全部溶解需一定时间,要耐心,可能还会有少量的悬浮细粒。
2、建议不要用橙汁饮料做该实验,原因是其中维生素C含量比较低。
3、滴定终点不容易判断,需提醒学生注意。
4、建议可以选择多种水果和蔬菜的原汁做实验,以提高学生的兴趣,并了解各种蔬菜水果的 Vc含量的高低。
5、碘和维生素C的反应方程式不宜拓展。
物质的定量分析
实验内容特点
注重自主探究
注重与理论联系
注重学生的生活经验
一、实验内容的特点
二、新课程化学实验教学的策略
3、积极引导学生质疑探究,培养探究精神和实验能力。
1、了解教材内容的前后联系,把握教学的阶段性。
2、着力培养对实验现象的观察和分析能力。
二、新课程化学实验教学的策略
1、了解教材内容的前后联系,把握教学的阶段性。
实验内容的编排方式
分散
集中
化学1
化学2
有机化学基础
化学反应原理
物质结构与性质
化学与生活
化学与技术
实验化学
本专题在实验化学中的地位和作用
在化学研究中,我们不仅需要知道化学物质的组成元素、组成成分,而且需要知道某物质组成元素、组成成分的含量,这就需要用定量分析的方法来测定。定量分析在科学研究中的重要性是不言而喻的。
本专题以融生活和化学知识于一体的两个课题为主线,介绍定量分析的一般过程、定量分析实验方案的设计方法、常用定量分析仪器的使用方法,以及如何记录和处理实验数据等内容。
课 题1
食醋总酸含量的测定
酸碱中和滴定在各模块中的呈现
模块 专题、单元 实验内容
化学反应原理 专题3 第二单元《溶液的酸碱性》 [信息提示]滴定管的使用
[活动与探究]
0.1000mol/LNaOH滴定20.00mL0.1000mol/LHCl
[活动与探究]用标准盐酸测定NaOH溶液的浓度
实验化学 专题6《物质的定量分析》 课题1 食醋总酸度的测定
[拓展实验]配制并标定氢氧化钠溶液
化学反应原理
化学反应原理
化学反应原理
实验化学
一、本课题的教学目标
实验新特点
1.移液管的使用
2.指示剂的选择
3.相对平均偏差的计算
4.涉及滴定曲线
5.运用中和滴定原理设计实验方案解决实际问题
(与旧人教版比较)
实验原理
1.化学反应原理:
CH3COOH+NaOH = CH3COONa + H2O
HnA(有机酸)+nNaOH = NanA + nH2O
3.实验数据的处理:
m(CH3COOH) = c(NaOH)·V(NaOH)·M(CH3COOH)
100mL食醋中所含醋酸的质量为:
m′(CH3COOH) = c(NaOH)·V(NaOH)·
M(CH3COOH)× ×
根据3次接近的平行测定值,可计算食醋中总酸含量的平均值。
平均相对偏差的计算
绝对偏差(di)表示测定值(xi)与平均值(x)之差:
di=xi-x, x=
平均偏差(d)为各个单个偏差的平均值:
d= =
相对平均偏差:Rd = ×100%
x1+ x2+x3+…+xn
n
d1+ d2+d3+…+dn
n
|x1-x|+|x2-x|+|x3-x|+…+|xn-x|
n
n
d
实验准备
实验方案
实验方案
仪器的洗涤
溶液的装配
★NaOH标准溶液配制
中和滴定
指示剂的选择
滴定与记录
数据处理与结论
数据处理
误差分析
记录与结论
NaOH标准溶液浓度c(NaOH)= 0.1000 mol/L
实验次数 第一次 第二次 第三次
待测食醋的体积初读数/mL
待测食醋的体积终读数/mL
待测食醋的体积
V(CH3COOH)/mL 25 25 25
NaOH标准溶液的体积初读数/mL 2.00 2.32 2.14
NaOH标准溶液的体积终读数/mL 22.68 23.04 22.85
NaOH标准溶液的体积
V(NaOH)/mL 20.68 20.72 20.71
实验测得的食醋总酸含量(g/100mL) 4.963 4.973 4.907
食醋总酸含量的平均值(g/100mL) 4.968
相对平均偏差/% 0.067%
食醋的
选择
1.白醋:效果较好
2.香醋:稀释10倍
3.陈醋: 颜色很深,影响终点判断
注意事项
消除CO2对
实验的影响
配制NaOH溶液和稀释食醋的蒸馏水在实验前应加热煮沸2~3分钟,以尽可能除去溶解的CO2,并快速冷却至室温。
(1)移液管尖嘴残留液体的处理
(2)滴定前后碱式滴定管中不能有气泡
(3)滴定管使用前要用待盛放的溶液润洗
锥形瓶不能用待测液润洗
(4)滴定终点的判断
(5)读数时是否平视
几个关健
实验操作
交流与讨论
可结合教学参考102页的说明。
拓展课题6-1 配制并标定氢氧化钠溶液
(1)配制NaOH饱和溶液,放置一段时间后,吸取上 层清液,稀释到约0.1mol/L,即可得NaOH标准溶液。
(2)用邻苯二甲酸氢钾(HOOCC6H4COOK)作为基准物质,以酚酞作为指示剂,标定上述NaOH标准溶液。
m/M = c(NaOH)×V(NaOH)
记录与结论
实验次数 第一次 第二次 第三次
邻苯二甲酸氢钾的质量/g 0.562 0.551 0.574
氢氧化钠溶液的体积初读数/ml 2.00 5.80 2.00
氢氧化钠溶液的体积终读数/ml
27.98 31.55 28.89
氢氧化钠溶液的体积/ml
25.98 25.75 26.89
氢氧化钠溶液的浓度/mol/L 0.09451 0.09554 0.09577
氢氧化钠溶液的平均值 0.09526
平均相对偏差 0.14%
实验几点说明
1.邻苯二甲酸氢钾的质量的称量可以用分析天平。
2.氢氧化钠溶液的稀释应用新煮沸而又迅速冷却的蒸馏水。
3.邻苯二甲酸氢钾的溶解应小心振荡,需要一定的时间。
4.从相对平均偏差来看,实验结果在误差范围之内,建议教师氢氧化钠标准溶液的浓度采用0.1000mol/L。
5.教师应对学生说明有效数字的运算方法。
教学建议
1.课时分配
第一课时:食酸的分类,食醋总酸含量的测定原理,
滴定过程中pH的变化以及实验数据的处
理方法。
第二课时:通过氢氧化钠标准溶液的配制和标定,复习滴定管的使用和中和滴定操作,练习移液管的使用。
第三课时:课题方案的设计与论证。完成食酸总酸含量测定的实验与评价。
分组公布实验方案,
说出各自的困惑
各组对各种方案
进行质疑与评价
学生设计实验方案
实验与评价
初步实施实验方案
细化实验方案
4
3
2
5
6
1
食酸总酸
含量的测定
2.教学设计思路(课题方案设计教学)
课 题 2
镀锌铁皮锌镀层厚度的测定
知识与技能
⑴学会用电子天平称量物质的质量。
⑵学会用化学方法测定镀锌铁皮的锌镀层厚度。
⑶了解测定过程中产生误差的原因,并能对实验中的数据进行处理。
⑷学会书写定量测定与分析实验报告。
过程与方法
通过实验使学生进一步掌握定量分析的一般方法。
情感、态度、价值观
提高学生的实验兴趣,培养学生勤与创新、敢与实践的科学 品质。
教学目标
在“知识预备”部分的教学中,教师首先要引导学生复习和探究锌、铁的性质,复习原电池反应、电镀的工作原理,使学生不仅掌握教材上介绍的测定原理和测定方法,而且让学生尝试自己设计多种实验方案,并进行预备实验,找出较好的测定方法。
在数据记录与处理的教学中,建议教师提醒学生注意数据的记录、误差和有效数字的运算规则。
教学建议
h =△m/(2ρS)
实验原理
△m:
①用____________________测量反应前后的质量
② 用________________来溶解铁皮表面的锌镀层
电子天平(0.001g)
6 mol/LHCl
引导学生设计方案
镀锌铁片在HCl中产生H2的速率由快迅速转慢
实验现象
说明: 1、该现象非常明显,学生很容易做出判断
2、不宜用硫酸替代盐酸做该实验
3、耗时短,大约2分钟即可完成
1、镀锌铁片反应前后质量的精确测量与读数。
2、锌在酸中完全溶解后,产生氢气显著变慢,准确判断锌完全反应是本实验最重要的一环。若判断过早则会使锌未完全溶解;若过迟会使铁部分溶解,都会增加实验误差。
3、数据的准确记录与处理及误差分析。
操作要点
记录与结论
数据记录 数据处理
铁片A,长 5.00 cm宽5.06cm
铁片A,长 4.92cm宽4.90cm
铁片A,长 4.98cm宽5.00cm
镀锌铁片A,m1(A)=5.464克
镀锌铁片B,m1(B)=5.255克
镀锌铁片C,m1(C)=5.429
铁片A,m2(A)=5.322
铁片B,m2(B)=5.121
铁片C,m2(B)=5.290
镀锌
铁片 单侧厚度/mm 平均厚度/mm 相当平均偏差/%
镀锌铁片A 0.0393
0.0391
0.34%
镀锌
铁片B 0.0389
镀锌
铁片C
0.0391
一些思考
在本课题中,用到了精度达0.001g的电子天平。由于在以前的化学实验中并不需要该仪器,所以一般来讲相当学校目前可能并不具有该实验仪器,再加上该仪器价格不菲及相关领导可能没有及时给予重视,则很可能造成经费不宽裕的地区或学校放弃对该仪器的配备。如果是这样,该实验则无法开展,就会迫使实验成为“纸上谈兵”。我尝试了省新课程培训时介绍的方法:方法是用螺旋测微器直接测量铁片反应前后的厚度,则厚度差的1/2即为镀锌铁皮的锌镀层厚度 (h)。具体比较见下表。
用螺旋测微器测铁片的厚度
数据记录 镀锌铁皮 质量(g) 面积(mm2) 厚度*(mm)
反应前 5.464 2530 0.284
反应后 5.322 o.203
数据处理 锌镀层厚度(mm) 依据 h =△m/(2ρS)(锌的密度ρ=7.14g/cm3) h =(6.464-5.322)/(2·7.14·10-3·2530)=0.0393mm
锌镀层厚度(mm) 依据厚度差的1/2即为镀锌铁皮的锌镀层厚度(h)
h =(0.284-0.203)/2=0.0405mm
注:测定厚度为四次测定(铁皮上均匀取四个点)的平均值
数据与结论
附:教参提供其它实验方案
方案1:将镀锌铁片投入足量的6mol/L的盐酸中,使其完全溶解,通过测量生成氢气的体积,计算出铁片上锌的质量。
评价:实验耗时长
方案2:将镀锌铁片投入足量的3 mol/L一硫酸亚铁溶液中,过一段时间后,取出铁片,用水冲、洗烘干后,再称量。
评价:几乎不反应
方案3:将镀锌铁片投入足量的6mol/L盐酸中,使其完全溶解,再在所得溶液中加入过量的NaOH溶液,将沉淀过滤,待滤渣烘干、灼烧后,再称量。
评价:操作麻烦,实验精确度不高
方案4:将镀锌铁片投入足量的6 mol·L-1NaOH溶液中,待充分反应后,取出铁片,用水冲洗、烘干后,再称量。
评价:操作简单,原理科学,但反应速率太小
方案5:将镀锌铁片与另一块纯铁片用一根导线连接起来,放入盛有3mol·L-1硫酸亚铁溶液的烧杯中,过一段时间后,取出铁片,用水冲洗、烘干后,再称量。
评价:设计合理,但终点不好判断
方案6:将镀锌铁片与石墨用一根导线连接起来,放入盛有6mol·L-1NaOH溶液中,当石墨棒过一段时间后,取出铁片,用水冲洗、烘干后,再称量。
评价:操作简单,但耗时长
拓展课题6-2 水果中维生素C含量的测定
1、维生素C标准溶液的配制
将5片100mg的维生素C药片投入到盛有50ml蒸馏水的烧杯中,当Vc药品全部溶解后,转移到250ml容量瓶中,并稀释到刻度。
2、橙汁的准备
取鲜橙若干,榨汁,过滤备用。
3、Vc药片中Vc含量的测定
移取20ml Vc 标准液注入250ml锥形瓶中,加入1ml0.1mol/L盐酸,再加入1-2ml淀粉溶液,用0.010mol/L碘水滴定,直至溶液显蓝色且半分钟不褪色,记录消耗碘水体积。重复两次,取平均值。
4、橙汁中Vc含量的测定
移取20ml 橙汁注入250ml锥形瓶中,加入1ml0.1mol/L盐酸,再加入1-2ml淀粉溶液,用0.010mol/L碘水滴定,直至溶液显蓝色且半分钟不褪色,记录消耗碘水体积。重复两次,取平均值。
记录与结论
编号 滴定前的读数/ml 滴定前的读数/ml 消耗碘液体积/ml 消耗碘液体积的平均值/ml
维生素C
标准溶液 1 3.26 27.36 24.10 24.07
2 2.28 26.42 24.14
橙汁 3 12.77 17.58 4.81 4.79
4 17.58 22.35 4.77
橙汁中维生素C的含量=398.0mg/L
几点说明:
1、维生素C 药片的全部溶解需一定时间,要耐心,可能还会有少量的悬浮细粒。
2、建议不要用橙汁饮料做该实验,原因是其中维生素C含量比较低。
3、滴定终点不容易判断,需提醒学生注意。
4、建议可以选择多种水果和蔬菜的原汁做实验,以提高学生的兴趣,并了解各种蔬菜水果的 Vc含量的高低。
5、碘和维生素C的反应方程式不宜拓展。
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
