第二单元课题3氧气的制取(第二课时)学案-2021-2022学年九年级化学人教版上册
文档属性
| 名称 | 第二单元课题3氧气的制取(第二课时)学案-2021-2022学年九年级化学人教版上册 |  | |
| 格式 | docx | ||
| 文件大小 | 47.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-30 07:53:30 | ||
图片预览

文档简介
2021_2022学年度人教版九年级化学上册导学案
第二单元我们周围的空气
课题3氧气的制取(第二课时)
【学习目标】
1.掌握实验室用高锰酸钾制取氧气的反应原理及步骤;
2.理解分解反应及其化合反应的区别;
3.了解氧气的工业制法;
4.掌握两套气体制取装置的优缺点和适用范围。
【课前预习】
1.下列有关“一定”和“不一定”的说法正确的是
A.物质跟氧气发生的化学反应不一定是氧化反应
B.化学反应一定有明显的现象
C.生成两种物质的反应不一定是分解反应
D.氧化反应一定是化合反应
2.空气是人和其他生物赖以生存的基本物质之一,下列有关空气和氧气的说法正确的是
A.空气中氧气的含量越高对人越有利
B.空气中氮气的质量分数为78%
C.空气属于混合物
D.分离液态空气制氧气属于分解反应
3.下列关于氧气的说法错误的是
A.氧气具有助燃性
B.工业上可以利用分离液态空气法制氧气
C.液氧是无色液体
D.有氧气参与的反应属于氧化反应
4.用双氧水制取氧气时,忘记加二氧化锰,其结果是
A.不放出氧气
B.放出氧气速率慢
C.放出氧气总量会减少
D.放出氧气总量更多
5.下列说法中正确的是(
)
A.氧气能支持燃烧,可做燃料
B.按质量计算,空气中含有氮气约78%,氧气约21%
C.空气中的氧气主要来自于植物的光合作用
D.工业上分离液态空气制氧气的过程属于分解反应】
【学习探究】
自主学习
阅读课本
完成下列问题
1.
实验室制取氧气的常用药品是:__________
、______________和_______________。
2.高锰酸钾制取氧气的反应原理____________________________________________。
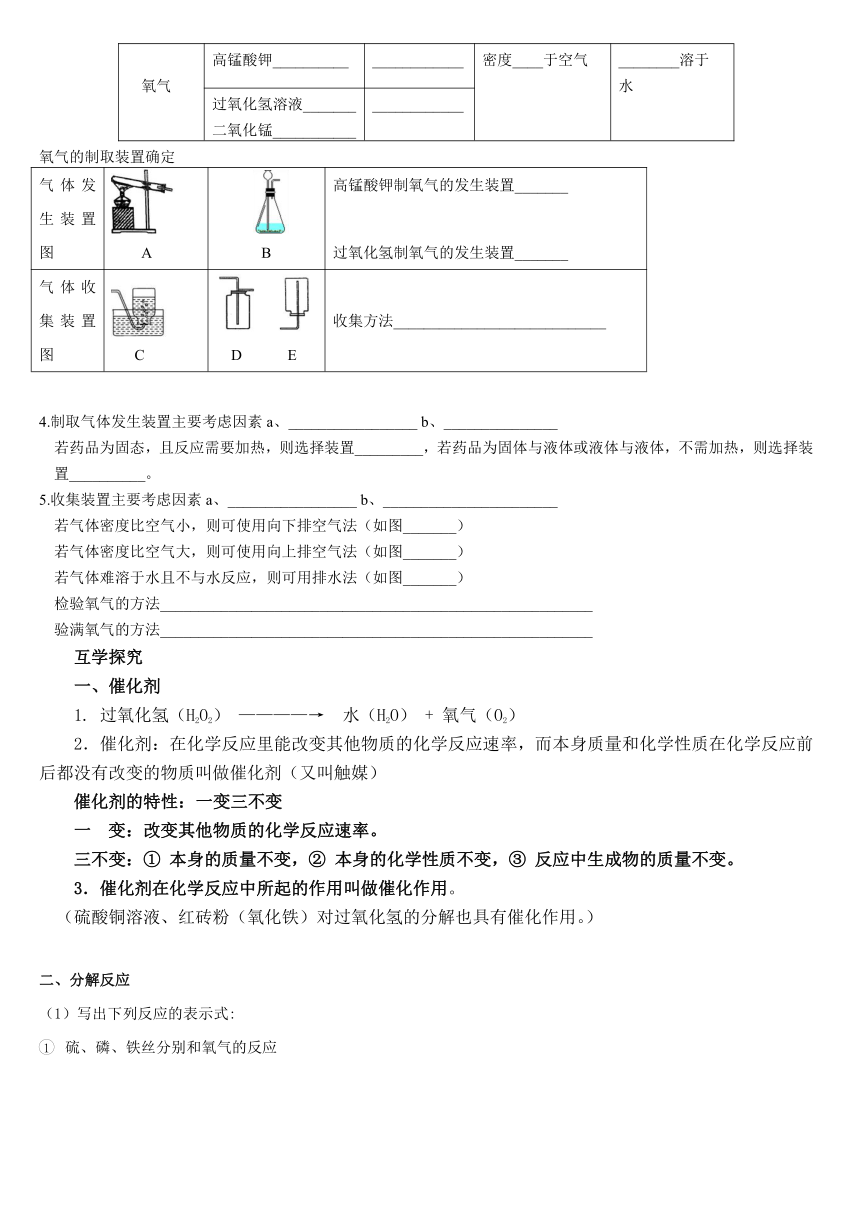
3.回顾实验室制取氧气的相关信息,填空。
反应物的状态
反应条件
密度
溶解性
氧气
高锰酸钾__________
____________
密度____于空气
________溶于
水
过氧化氢溶液_______
二氧化锰___________
____________
氧气的制取装置确定
气体发生装置图
A
B
高锰酸钾制氧气的发生装置_______
过氧化氢制氧气的发生装置_______
气体收集装置图
C
D
E
收集方法____________________________
4.制取气体发生装置主要考虑因素a、_________________
b、_______________
若药品为固态,且反应需要加热,则选择装置_________,若药品为固体与液体或液体与液体,不需加热,则选择装置__________。
5.收集装置主要考虑因素a、_________________
b、_______________________
若气体密度比空气小,则可使用向下排空气法(如图_______)
若气体密度比空气大,则可使用向上排空气法(如图_______)
若气体难溶于水且不与水反应,则可用排水法(如图_______)
检验氧气的方法_________________________________________________________
验满氧气的方法_________________________________________________________
互学探究
一、催化剂
1.
过氧化氢(H2O2)
————→
水(H2O)
+
氧气(O2)
2.催化剂:在化学反应里能改变其他物质的化学反应速率,而本身质量和化学性质在化学反应前后都没有改变的物质叫做催化剂(又叫触媒)
催化剂的特性:一变三不变
一
变:改变其他物质的化学反应速率。
三不变:①
本身的质量不变,②
本身的化学性质不变,③
反应中生成物的质量不变。
3.催化剂在化学反应中所起的作用叫做催化作用。
(硫酸铜溶液、红砖粉(氧化铁)对过氧化氢的分解也具有催化作用。)
二、分解反应
(1)写出下列反应的表示式:
硫、磷、铁丝分别和氧气的反应
过氧化氢、氯酸钾分别在二氧化锰催化作用下分解制氧气;高锰酸钾受热分解制氧气
从反应物、生成物种类比较上述反应的异同,对比化合反应的特点,通过讨论分析三个反应有何特点?
学生展示学生讨论回答
归纳总结:分解反应的定义:_________________________;其主要特点是反应物有一种,生成物有多种,“一变多”
【针对练习】①氢气+氧气→水;
②碳酸钙→氧化钙+二氧化碳;
③酒精+氧气→水+二氧化碳;
④碳酸氢钠→碳酸钠+二氧化碳+水;
⑤水→氢气+氧气
上述反应中,属于分解反应的是________;化合反应的是__________;氧化反应的是_________。
分解反应和化合反应的区别
三、氧气的工业制法
工业上需要的大量氧气是如何制取的?(阅读课文)
工业制法(分离液态空气法)原理:利用液态氮的沸点比液态氧的沸点低,因此氮气首先从液态空气中蒸发出来,剩下的主要就是液态氧。
(1)具体过程
(2)注意:该过程是
变化
【课后练习】
1.下列有关空气的说法正确的是
A.硫在空气中和在氧气中燃烧的现象是一致的
B.空气中的稀有气体不会与其他任何物质发生反应
C.工业上利用分离液态空气制取氧气的过程属于物理变化
D.细铁丝能在空气中剧烈燃烧,火星四射,生成黑色固体
2.化学实验中常用到木条或火柴梗,下列实验方案或操作不能达到目的的是
A.用带火星的木条检验氧气
B.将火柴梗迅速平放入火焰中,约1~2s后取出比较火焰各层温度
C.将火柴系在细铁丝下端,点燃后待火柴快燃尽时伸入氧气中
D.用燃着的木条区分氮气和二氧化碳
3.下列关于实验操作中先后顺序的叙述不正确的是
A.氢气先验纯后点燃
B.加热高锰酸钾制氧气并用排水法收集完毕时,先熄灭酒精灯,后将导气管撤离水槽
C.加热试管中的药品时,先均匀预热,后集中加热
D.制备气体时,先检查装置气密性,后装药品
4.下列关于氧气的说法正确的是
A.工业上用分离液态空气法制取氧气,其原理属于化学变化
B.氧气能跟所有物质发生氧化反应
C.水中的生物能依靠微溶于水中的氧气而生存
D.带火星的木条一定能在含有氧气的集气瓶中复燃
5.下列关于物质的鉴别、制备、除杂的方法错误的是
A.测定空气中氧气含量,利用红磷除去空气中的氧气
B.利用颜色区分高锰酸钾和氯酸钾
C.利用二氧化锰区分水和过氧化氢溶液
D.实验室利用加热分解氧化汞的方法来制取氧气
6.写出下列反应的符号表达式,并在括号内注明其基本反应类型:
①实验室加热高锰酸钾制取氧气:_________________________________;(_________)反应
②氢气在氯气中燃烧生成氯化氢:_________________________________;(_________)反应
③过氧化氢溶液与硫酸铜溶液混合发生反应:_______________________;(_________)反应
④利用红磷燃烧法测定空气中氧气含量的原理:_____________________。
7.在潜水艇里要配备氧气再生设备,有以下几种制备氧气的方法:
①加热高锰酸钾?②通电分解水?③常温下过氧化钠与二氧化碳反应生成氧气和碳酸钠
(1)你认为最合适潜水艇里制取氧气的方法是________(填序号)
(2)与其他两种方法相比,这种最佳方法的优点是:①_________
②_______.
8.由于氧气的密度比空气____,收集氧气时,可用_________法,又因为氧气______溶于水,收集它时可用______法,欲得到较纯净的氧气(尽可能不含空气)最好选用_____法收集.
9.工业上用分离液态空气法的方法制取氧气,这一方法属于_______变化。实验室制氧气方法:常温分解_________(常用二氧化锰做催化剂)或在二氧化锰存在的条件下加热_______制取氧气或加热_________制取氧气。这三种方法都是_______变化,其基本反应类型________。(药品填化学式)
10.某同学在做过氧化氢制氧气的实验后,想起自己家里也有一瓶消毒用的双氧水,经查看,发现已经过了使用日期。
(1)为检验该双氧水是否全部变质,他进行了以下实验:a
管中倒入少量双氧水;b
管中加入一定量的二氧化锰,正确的操作顺序是______(填字母序号)。
(2)若实验中观察到______,说明该瓶双氧水______(填“有”或“没有”)完全变质。
(3)若该瓶双氧水完全变质,则瓶内余下的物质是______(填“纯净物”或“混合物”);若该瓶双氧水没有全部变质.该同学用它收集好了一瓶气体,则气体应______(填“正放”或“倒放”)在桌面上。
【参考答案】
【课前预习】
1.C
2.C
3.C
4.B
5.C
【课后练习】
1.C
2.D
3.B
4.C
5.D
6.
分解
化合
分解
7.③
反应在常温下就能进行
能将二氧化碳处理掉
8.大
向上排空气
不易
排水
排水
9.物理
H2O2
KClO3
KMnO4
化学
分解反应
10.ba
有气泡冒出
没有
纯净物
正放
第二单元我们周围的空气
课题3氧气的制取(第二课时)
【学习目标】
1.掌握实验室用高锰酸钾制取氧气的反应原理及步骤;
2.理解分解反应及其化合反应的区别;
3.了解氧气的工业制法;
4.掌握两套气体制取装置的优缺点和适用范围。
【课前预习】
1.下列有关“一定”和“不一定”的说法正确的是
A.物质跟氧气发生的化学反应不一定是氧化反应
B.化学反应一定有明显的现象
C.生成两种物质的反应不一定是分解反应
D.氧化反应一定是化合反应
2.空气是人和其他生物赖以生存的基本物质之一,下列有关空气和氧气的说法正确的是
A.空气中氧气的含量越高对人越有利
B.空气中氮气的质量分数为78%
C.空气属于混合物
D.分离液态空气制氧气属于分解反应
3.下列关于氧气的说法错误的是
A.氧气具有助燃性
B.工业上可以利用分离液态空气法制氧气
C.液氧是无色液体
D.有氧气参与的反应属于氧化反应
4.用双氧水制取氧气时,忘记加二氧化锰,其结果是
A.不放出氧气
B.放出氧气速率慢
C.放出氧气总量会减少
D.放出氧气总量更多
5.下列说法中正确的是(
)
A.氧气能支持燃烧,可做燃料
B.按质量计算,空气中含有氮气约78%,氧气约21%
C.空气中的氧气主要来自于植物的光合作用
D.工业上分离液态空气制氧气的过程属于分解反应】
【学习探究】
自主学习
阅读课本
完成下列问题
1.
实验室制取氧气的常用药品是:__________
、______________和_______________。
2.高锰酸钾制取氧气的反应原理____________________________________________。
3.回顾实验室制取氧气的相关信息,填空。
反应物的状态
反应条件
密度
溶解性
氧气
高锰酸钾__________
____________
密度____于空气
________溶于
水
过氧化氢溶液_______
二氧化锰___________
____________
氧气的制取装置确定
气体发生装置图
A
B
高锰酸钾制氧气的发生装置_______
过氧化氢制氧气的发生装置_______
气体收集装置图
C
D
E
收集方法____________________________
4.制取气体发生装置主要考虑因素a、_________________
b、_______________
若药品为固态,且反应需要加热,则选择装置_________,若药品为固体与液体或液体与液体,不需加热,则选择装置__________。
5.收集装置主要考虑因素a、_________________
b、_______________________
若气体密度比空气小,则可使用向下排空气法(如图_______)
若气体密度比空气大,则可使用向上排空气法(如图_______)
若气体难溶于水且不与水反应,则可用排水法(如图_______)
检验氧气的方法_________________________________________________________
验满氧气的方法_________________________________________________________
互学探究
一、催化剂
1.
过氧化氢(H2O2)
————→
水(H2O)
+
氧气(O2)
2.催化剂:在化学反应里能改变其他物质的化学反应速率,而本身质量和化学性质在化学反应前后都没有改变的物质叫做催化剂(又叫触媒)
催化剂的特性:一变三不变
一
变:改变其他物质的化学反应速率。
三不变:①
本身的质量不变,②
本身的化学性质不变,③
反应中生成物的质量不变。
3.催化剂在化学反应中所起的作用叫做催化作用。
(硫酸铜溶液、红砖粉(氧化铁)对过氧化氢的分解也具有催化作用。)
二、分解反应
(1)写出下列反应的表示式:
硫、磷、铁丝分别和氧气的反应
过氧化氢、氯酸钾分别在二氧化锰催化作用下分解制氧气;高锰酸钾受热分解制氧气
从反应物、生成物种类比较上述反应的异同,对比化合反应的特点,通过讨论分析三个反应有何特点?
学生展示学生讨论回答
归纳总结:分解反应的定义:_________________________;其主要特点是反应物有一种,生成物有多种,“一变多”
【针对练习】①氢气+氧气→水;
②碳酸钙→氧化钙+二氧化碳;
③酒精+氧气→水+二氧化碳;
④碳酸氢钠→碳酸钠+二氧化碳+水;
⑤水→氢气+氧气
上述反应中,属于分解反应的是________;化合反应的是__________;氧化反应的是_________。
分解反应和化合反应的区别
三、氧气的工业制法
工业上需要的大量氧气是如何制取的?(阅读课文)
工业制法(分离液态空气法)原理:利用液态氮的沸点比液态氧的沸点低,因此氮气首先从液态空气中蒸发出来,剩下的主要就是液态氧。
(1)具体过程
(2)注意:该过程是
变化
【课后练习】
1.下列有关空气的说法正确的是
A.硫在空气中和在氧气中燃烧的现象是一致的
B.空气中的稀有气体不会与其他任何物质发生反应
C.工业上利用分离液态空气制取氧气的过程属于物理变化
D.细铁丝能在空气中剧烈燃烧,火星四射,生成黑色固体
2.化学实验中常用到木条或火柴梗,下列实验方案或操作不能达到目的的是
A.用带火星的木条检验氧气
B.将火柴梗迅速平放入火焰中,约1~2s后取出比较火焰各层温度
C.将火柴系在细铁丝下端,点燃后待火柴快燃尽时伸入氧气中
D.用燃着的木条区分氮气和二氧化碳
3.下列关于实验操作中先后顺序的叙述不正确的是
A.氢气先验纯后点燃
B.加热高锰酸钾制氧气并用排水法收集完毕时,先熄灭酒精灯,后将导气管撤离水槽
C.加热试管中的药品时,先均匀预热,后集中加热
D.制备气体时,先检查装置气密性,后装药品
4.下列关于氧气的说法正确的是
A.工业上用分离液态空气法制取氧气,其原理属于化学变化
B.氧气能跟所有物质发生氧化反应
C.水中的生物能依靠微溶于水中的氧气而生存
D.带火星的木条一定能在含有氧气的集气瓶中复燃
5.下列关于物质的鉴别、制备、除杂的方法错误的是
A.测定空气中氧气含量,利用红磷除去空气中的氧气
B.利用颜色区分高锰酸钾和氯酸钾
C.利用二氧化锰区分水和过氧化氢溶液
D.实验室利用加热分解氧化汞的方法来制取氧气
6.写出下列反应的符号表达式,并在括号内注明其基本反应类型:
①实验室加热高锰酸钾制取氧气:_________________________________;(_________)反应
②氢气在氯气中燃烧生成氯化氢:_________________________________;(_________)反应
③过氧化氢溶液与硫酸铜溶液混合发生反应:_______________________;(_________)反应
④利用红磷燃烧法测定空气中氧气含量的原理:_____________________。
7.在潜水艇里要配备氧气再生设备,有以下几种制备氧气的方法:
①加热高锰酸钾?②通电分解水?③常温下过氧化钠与二氧化碳反应生成氧气和碳酸钠
(1)你认为最合适潜水艇里制取氧气的方法是________(填序号)
(2)与其他两种方法相比,这种最佳方法的优点是:①_________
②_______.
8.由于氧气的密度比空气____,收集氧气时,可用_________法,又因为氧气______溶于水,收集它时可用______法,欲得到较纯净的氧气(尽可能不含空气)最好选用_____法收集.
9.工业上用分离液态空气法的方法制取氧气,这一方法属于_______变化。实验室制氧气方法:常温分解_________(常用二氧化锰做催化剂)或在二氧化锰存在的条件下加热_______制取氧气或加热_________制取氧气。这三种方法都是_______变化,其基本反应类型________。(药品填化学式)
10.某同学在做过氧化氢制氧气的实验后,想起自己家里也有一瓶消毒用的双氧水,经查看,发现已经过了使用日期。
(1)为检验该双氧水是否全部变质,他进行了以下实验:a
管中倒入少量双氧水;b
管中加入一定量的二氧化锰,正确的操作顺序是______(填字母序号)。
(2)若实验中观察到______,说明该瓶双氧水______(填“有”或“没有”)完全变质。
(3)若该瓶双氧水完全变质,则瓶内余下的物质是______(填“纯净物”或“混合物”);若该瓶双氧水没有全部变质.该同学用它收集好了一瓶气体,则气体应______(填“正放”或“倒放”)在桌面上。
【参考答案】
【课前预习】
1.C
2.C
3.C
4.B
5.C
【课后练习】
1.C
2.D
3.B
4.C
5.D
6.
分解
化合
分解
7.③
反应在常温下就能进行
能将二氧化碳处理掉
8.大
向上排空气
不易
排水
排水
9.物理
H2O2
KClO3
KMnO4
化学
分解反应
10.ba
有气泡冒出
没有
纯净物
正放
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
