2021-2022学年人教版化学九年级上册 第六单元 课题2 二氧化碳制取的研究教学课件(18张PPT)
文档属性
| 名称 | 2021-2022学年人教版化学九年级上册 第六单元 课题2 二氧化碳制取的研究教学课件(18张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-30 10:10:53 | ||
图片预览




文档简介
化学 九年级上册 人教版
教学课件
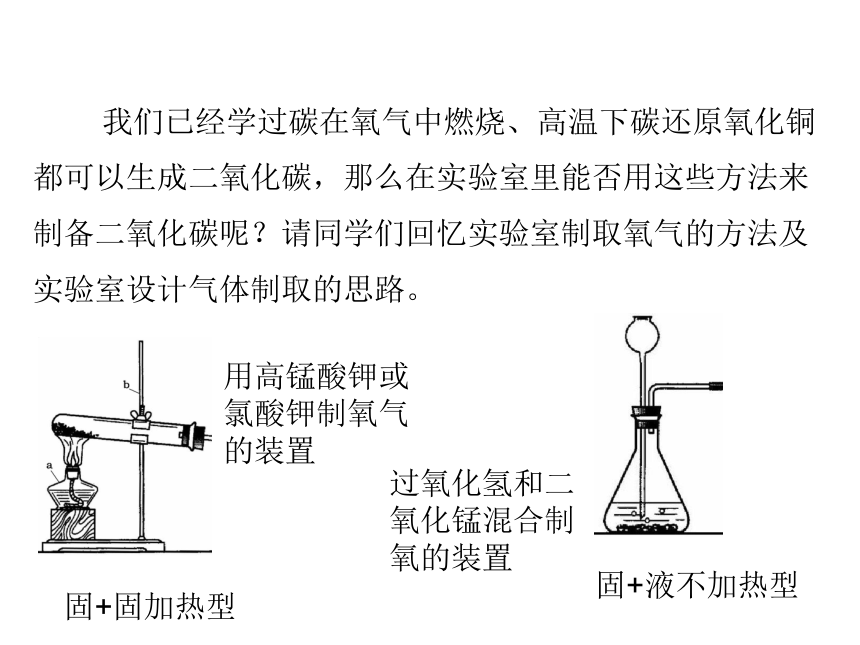
我们已经学过碳在氧气中燃烧、高温下碳还原氧化铜都可以生成二氧化碳,那么在实验室里能否用这些方法来制备二氧化碳呢?请同学们回忆实验室制取氧气的方法及实验室设计气体制取的思路。
过氧化氢和二氧化锰混合制氧的装置
固+固加热型
固+液不加热型
用高锰酸钾或氯酸钾制氧气的装置
[实验探究]
探究实验室制取二氧化碳的理想原料:
可供选择的药品:⑴碳酸钠粉末(Na2CO3);⑵石灰石或大理石(CaCO3);⑶稀盐酸(HCl);⑷稀硫酸(H2SO4) 。
可供选择的仪器:试管、药匙、胶头滴管。
方法:将药品⑴⑵分别与药品⑶⑷两两反应,观察反应速度快慢。
一、实验室制取CO2的反应原理
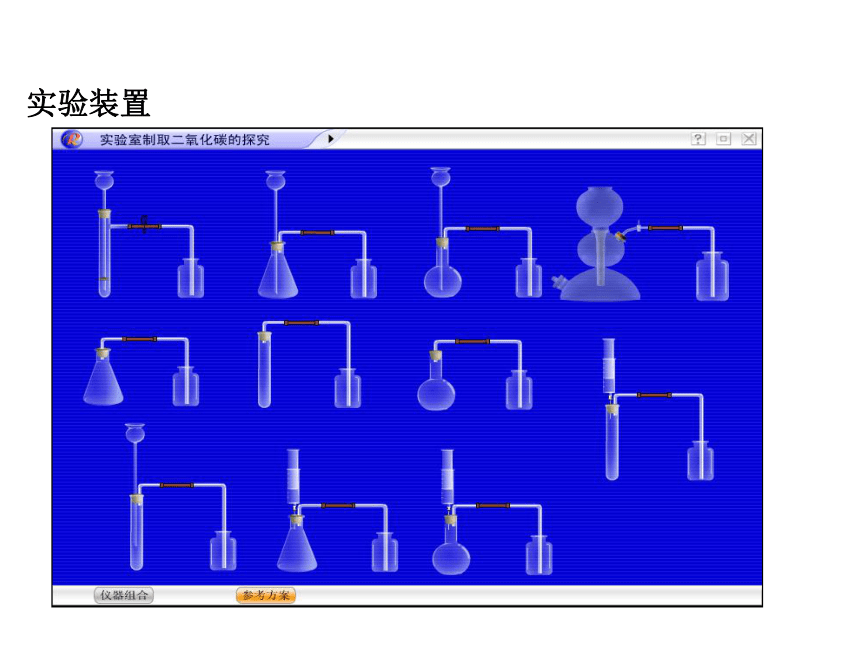
实验装置
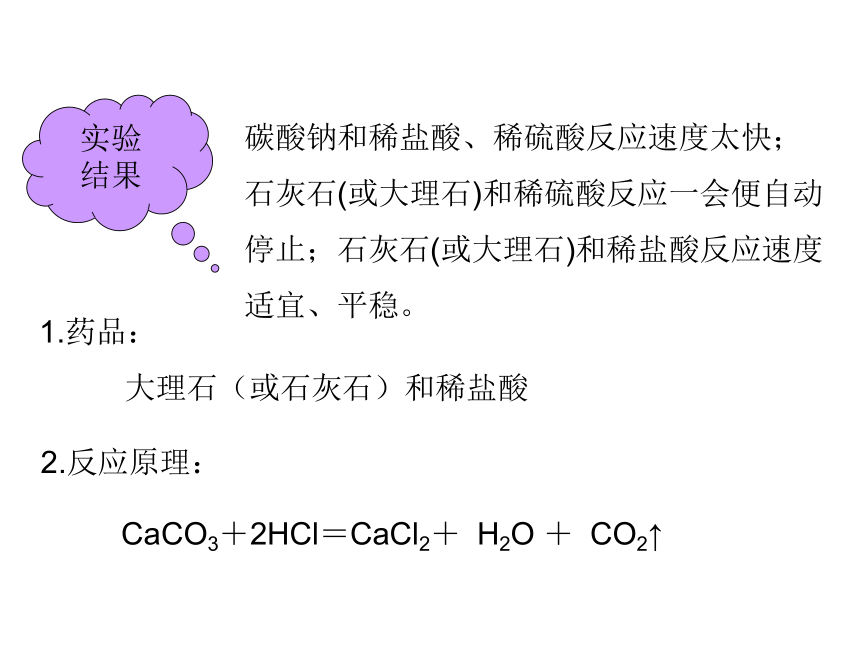
碳酸钠和稀盐酸、稀硫酸反应速度太快;
石灰石(或大理石)和稀硫酸反应一会便自动停止;石灰石(或大理石)和稀盐酸反应速度适宜、平稳。
1.药品:
大理石(或石灰石)和稀盐酸
2.反应原理:
CaCO3+2HCl=CaCl2+ H2O + CO2↑
实验
结果
CaCO3+H2SO4=CaSO4+H2O+CO2↑
生成了微溶物硫酸钙,覆盖在石灰石表面,阻碍反应继续进行。
因为浓盐酸易挥发出HCl气体,导致收集的二氧化碳不纯。
因为碳酸钠和稀盐酸反应速度太快、不易控制。
思考?
(1)为什么不能用稀硫酸代替稀盐酸?
(2)为什么不能用碳酸钠?
(3)为什么不能用浓盐酸?
请同学们根据上图回答:
1.实验室制取气体的装置由哪几部分组成?
2.确定气体发生装置时应考虑哪些因素?
3.确定气体收集装置时应考虑哪些因素?
二、实验室制取二氧化碳的装置
[归纳]实验室里制取气体的装置的确定方法
实验室制取气体的装置
气体发生装置
反应物的状态
反应条件(是否需要加热等)
固体和固体反应
固体和液体反应
液体和液体反应
排空气法
排水法(不易溶于水、不与水发生反应)
密度大于空气——向上排气法
密度小于空气——向下排气法
气体收集装置
反应物
的状态
反应
条件
气体密度比空气的大或小
能否溶于水
或与水反应
CO2
O2
固+液
常温
稍大
不易
大
能
固
加热
固+液
常温
二氧化碳和氧气制取实验及相关性质比较
共同总结:实验制取二氧化碳装置的确定
发生装置:
固+液不加热型
收集装置:
向上排空气法
选择以下仪器设计制取二氧化碳的装置
B中长颈漏斗为何要插入液面以下?
导管为何要插入集气瓶底部?
【B、D】
右图是实验室制备CO2的装置图。该装置的特点是:打开弹簧夹,大理石和盐酸接触,发生反应;关闭弹簧夹后,盐酸被反应产生的CO2气体压回长颈漏斗,与大理石分离,停止反应。用该装置制备CO2可起到节约药品和取用方便的效果。下图装置中哪些可以起到与右图装置相同的效果?
三、实验室制取CO2的步骤
①检查装置的气密性
②加入药品(先固后液)
③收集气体
④验满
⑤检验气体
澄清石灰水
变浑浊
木条熄灭
二氧化碳的工业制法:
煅烧石灰石法:CaCO3 === CaO + CO2↑
高温
例1.已知氨气是一种无色有刺激性气味的气体,密度小于空气,极易溶于水。实验室常用碱石灰和硫酸铵两种固体混合加热的方法制取氨气。根据所学的知识判断,实验室制取氨气时发生装置应选择( )装置,收集装置应选择( )装置。
A
B
E
D
C
A
C
二氧化碳制取的研究
1.反应原理
2.实验装置
3.实验步骤
大理石(或石灰石)和稀盐酸
CaCO3+2HCl=CaCl2+H2O+CO2↑
①检查装置的气密性
②加入药品(先固后液)
③收集气体
④验满
⑤检验气体
教学课件
我们已经学过碳在氧气中燃烧、高温下碳还原氧化铜都可以生成二氧化碳,那么在实验室里能否用这些方法来制备二氧化碳呢?请同学们回忆实验室制取氧气的方法及实验室设计气体制取的思路。
过氧化氢和二氧化锰混合制氧的装置
固+固加热型
固+液不加热型
用高锰酸钾或氯酸钾制氧气的装置
[实验探究]
探究实验室制取二氧化碳的理想原料:
可供选择的药品:⑴碳酸钠粉末(Na2CO3);⑵石灰石或大理石(CaCO3);⑶稀盐酸(HCl);⑷稀硫酸(H2SO4) 。
可供选择的仪器:试管、药匙、胶头滴管。
方法:将药品⑴⑵分别与药品⑶⑷两两反应,观察反应速度快慢。
一、实验室制取CO2的反应原理
实验装置
碳酸钠和稀盐酸、稀硫酸反应速度太快;
石灰石(或大理石)和稀硫酸反应一会便自动停止;石灰石(或大理石)和稀盐酸反应速度适宜、平稳。
1.药品:
大理石(或石灰石)和稀盐酸
2.反应原理:
CaCO3+2HCl=CaCl2+ H2O + CO2↑
实验
结果
CaCO3+H2SO4=CaSO4+H2O+CO2↑
生成了微溶物硫酸钙,覆盖在石灰石表面,阻碍反应继续进行。
因为浓盐酸易挥发出HCl气体,导致收集的二氧化碳不纯。
因为碳酸钠和稀盐酸反应速度太快、不易控制。
思考?
(1)为什么不能用稀硫酸代替稀盐酸?
(2)为什么不能用碳酸钠?
(3)为什么不能用浓盐酸?
请同学们根据上图回答:
1.实验室制取气体的装置由哪几部分组成?
2.确定气体发生装置时应考虑哪些因素?
3.确定气体收集装置时应考虑哪些因素?
二、实验室制取二氧化碳的装置
[归纳]实验室里制取气体的装置的确定方法
实验室制取气体的装置
气体发生装置
反应物的状态
反应条件(是否需要加热等)
固体和固体反应
固体和液体反应
液体和液体反应
排空气法
排水法(不易溶于水、不与水发生反应)
密度大于空气——向上排气法
密度小于空气——向下排气法
气体收集装置
反应物
的状态
反应
条件
气体密度比空气的大或小
能否溶于水
或与水反应
CO2
O2
固+液
常温
稍大
不易
大
能
固
加热
固+液
常温
二氧化碳和氧气制取实验及相关性质比较
共同总结:实验制取二氧化碳装置的确定
发生装置:
固+液不加热型
收集装置:
向上排空气法
选择以下仪器设计制取二氧化碳的装置
B中长颈漏斗为何要插入液面以下?
导管为何要插入集气瓶底部?
【B、D】
右图是实验室制备CO2的装置图。该装置的特点是:打开弹簧夹,大理石和盐酸接触,发生反应;关闭弹簧夹后,盐酸被反应产生的CO2气体压回长颈漏斗,与大理石分离,停止反应。用该装置制备CO2可起到节约药品和取用方便的效果。下图装置中哪些可以起到与右图装置相同的效果?
三、实验室制取CO2的步骤
①检查装置的气密性
②加入药品(先固后液)
③收集气体
④验满
⑤检验气体
澄清石灰水
变浑浊
木条熄灭
二氧化碳的工业制法:
煅烧石灰石法:CaCO3 === CaO + CO2↑
高温
例1.已知氨气是一种无色有刺激性气味的气体,密度小于空气,极易溶于水。实验室常用碱石灰和硫酸铵两种固体混合加热的方法制取氨气。根据所学的知识判断,实验室制取氨气时发生装置应选择( )装置,收集装置应选择( )装置。
A
B
E
D
C
A
C
二氧化碳制取的研究
1.反应原理
2.实验装置
3.实验步骤
大理石(或石灰石)和稀盐酸
CaCO3+2HCl=CaCl2+H2O+CO2↑
①检查装置的气密性
②加入药品(先固后液)
③收集气体
④验满
⑤检验气体
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
