不同类型的晶体
图片预览





文档简介
(共24张PPT)
不同类型的晶体
(苏教版)必修Ⅱ 专题1
第三单元
你知道吗?
我们在日常生活中见到的冰糖的形状如何?(观察实物—冰糖)
答:具有规则的几何外形(扁形六棱柱)
介绍几种有规则几何外形的固体。如:
固态物质
晶态(晶体):具有规则几何外形的固体。
非晶态。
原因:
构成晶体的微粒在空间呈有规则的重复排列的结果。
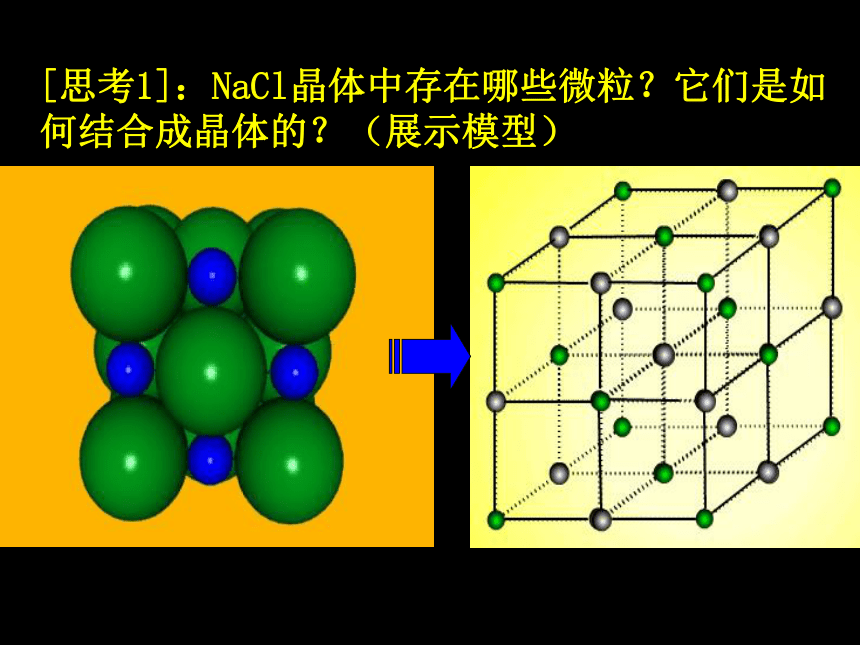
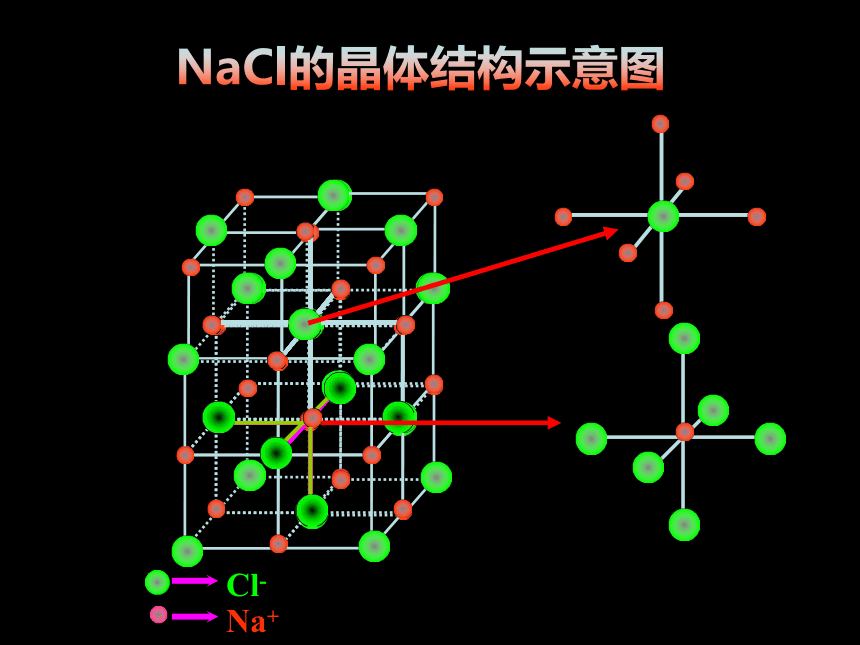
[思考1]:NaCl晶体中存在哪些微粒?它们是如何结合成晶体的?(展示模型)
Cl-
Na+
[小结]:在NaCl晶体中, (填存在或不存在)分子,存在许多 离子和 离子,以 键相结合,它们按一定的方式有规则排列成晶体。(即离子晶体)
不存在
Na+
Cl-
离子
离子化合物中的阴、阳离子按一定的方式有规则地排列而形成的晶体。
一、离子晶体
形成离子晶体的物质:
如:KOH 、 CuSO4、 NH4Cl 、 CaO等离子化合物。
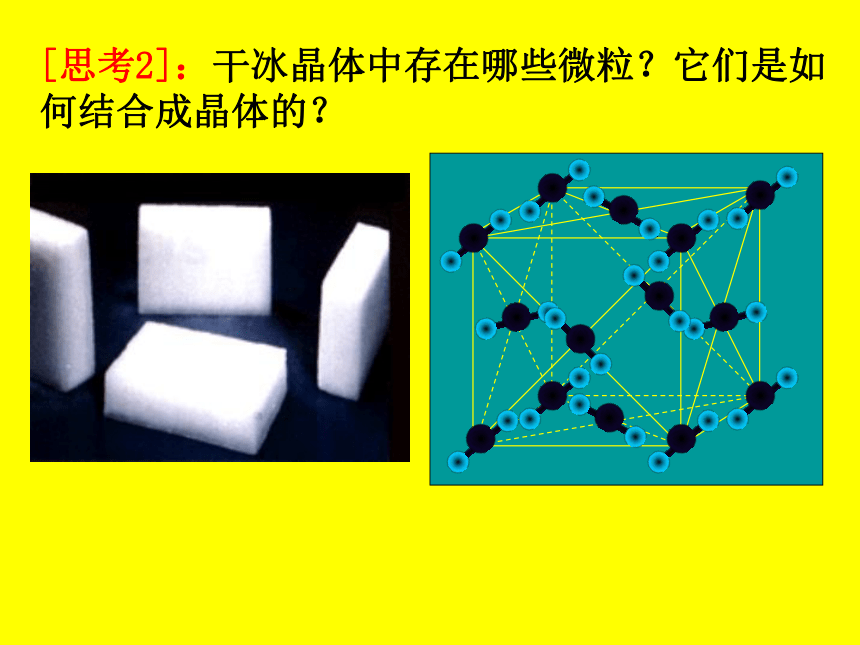
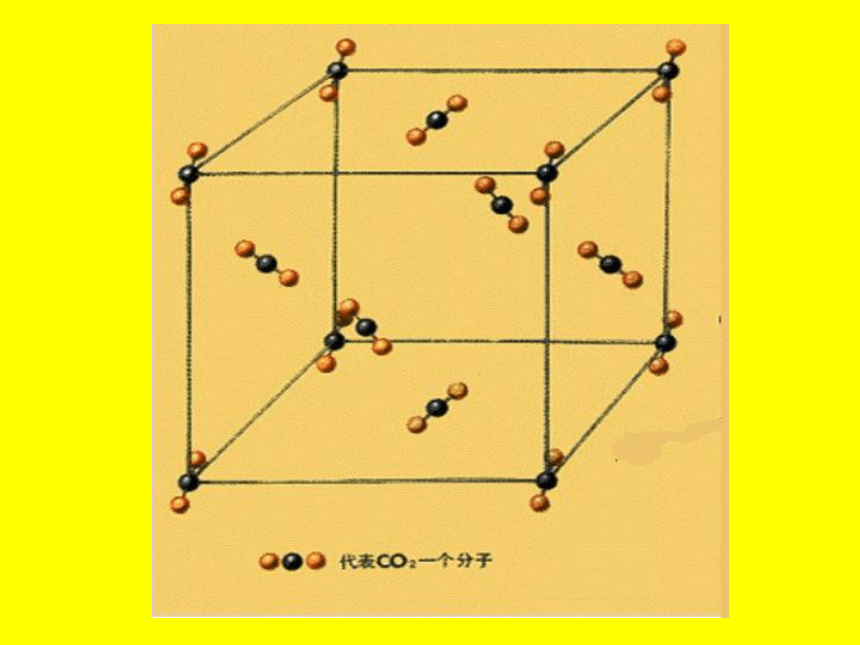
[思考2]:干冰晶体中存在哪些微粒?它们是如何结合成晶体的?
二、分子晶体:(由分子构成的物质)
——分子之间依靠分子间作用力按一定规则排列而成的晶体。
[小结]:在干冰晶体中,存在 分子。它们依靠 按一定的方式有规则排列成晶体。(即分子晶体)
CO2
分子间作用力
形成分子晶体的物质:
如:H2、Cl2、He 、HCl 、H2O、CO2等
知识回顾:
问题1:CO2 和SiO2的物理性质有什么不同?
答:CO2常温下是气体,固体二氧化碳熔、沸点低,硬度小。
SiO2常温下是固体,坚硬、难熔。
问题2:它们的物理性质为什么有怎么大的差别?
答:可能与它们的结构特点有关。
共价键
[思考3]:金刚石晶体中存在哪些微粒?它们是如何结合成晶体的?
三、原子晶体
相邻原子通过共价键结合而形成空间网状结构的晶体。
[小结]:在金刚石晶体中,存在 。每个碳原子与相邻的 个碳原子以 结合形成 。(即原子晶体)
碳原子
四
共价键
空间网状结构
晶
体
硅
180
109 28
Si
o
共价键
记忆:常见的原子晶体:
金刚石、晶体硅、石英(SiO2)
[小结]:在SiO2晶体中,存在 。每个碳原子与相邻的 个氧原子(每个氧原子与相邻的 个碳原子)以
结合形成 。(即原子晶体) (填存在与不存在) 分子。
碳原子和氧原子
四
共价键
空间网状结构
二
不存在
四、晶体分类:
--根据构成晶体的粒子种类不同及粒子间的相互作用的不同。晶体分为离子晶体、分子晶体、原子晶体、金属晶体。
简介:金属晶体
金属阳离子
自由电子
几种常见晶体的物理性质
晶体 氯化钠 氯化钡 金刚石 二氧化硅 硫 白磷 钠 钨
熔点/oC 801 1560 〉3550 1723 112.8 44.1 97.8 3410
硬度 较硬 较硬 很硬 硬而脆 脆 软 柔软 硬
晶体类型
晶体性质特点
离子晶体
原子晶体
分子晶体
金属晶体
硬度较大、熔点较高
硬度大、熔点高
硬度小、熔点低
导电、传热、延展性、金属光泽
离子晶体 分子晶体 原子晶体 金属晶体
粒子种类
粒子间的相互作用
熔化时破坏的相互作用
阴、阳离子
离子键
分子
分子间作用力
原子
共价键
金属阳离子和自由电子
离子键
分子间作用力
共价键
2、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氢氧化钠熔化
1、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 BaSO4、 金刚石、
水晶(SiO2)、 Na2O、KOH。
C
课 堂 练 习
3、按下列四种有关性质的叙述,可能属于原子晶体的是( )
A、由分子间作用力结合而成,熔点很低; B、固体或熔融后易导电,熔点在1000℃左右;
C、由共价键结合成网状晶体,熔点很高D、固体不导电,但溶于水或熔融后能导电。
C
不同类型的晶体
(苏教版)必修Ⅱ 专题1
第三单元
你知道吗?
我们在日常生活中见到的冰糖的形状如何?(观察实物—冰糖)
答:具有规则的几何外形(扁形六棱柱)
介绍几种有规则几何外形的固体。如:
固态物质
晶态(晶体):具有规则几何外形的固体。
非晶态。
原因:
构成晶体的微粒在空间呈有规则的重复排列的结果。
[思考1]:NaCl晶体中存在哪些微粒?它们是如何结合成晶体的?(展示模型)
Cl-
Na+
[小结]:在NaCl晶体中, (填存在或不存在)分子,存在许多 离子和 离子,以 键相结合,它们按一定的方式有规则排列成晶体。(即离子晶体)
不存在
Na+
Cl-
离子
离子化合物中的阴、阳离子按一定的方式有规则地排列而形成的晶体。
一、离子晶体
形成离子晶体的物质:
如:KOH 、 CuSO4、 NH4Cl 、 CaO等离子化合物。
[思考2]:干冰晶体中存在哪些微粒?它们是如何结合成晶体的?
二、分子晶体:(由分子构成的物质)
——分子之间依靠分子间作用力按一定规则排列而成的晶体。
[小结]:在干冰晶体中,存在 分子。它们依靠 按一定的方式有规则排列成晶体。(即分子晶体)
CO2
分子间作用力
形成分子晶体的物质:
如:H2、Cl2、He 、HCl 、H2O、CO2等
知识回顾:
问题1:CO2 和SiO2的物理性质有什么不同?
答:CO2常温下是气体,固体二氧化碳熔、沸点低,硬度小。
SiO2常温下是固体,坚硬、难熔。
问题2:它们的物理性质为什么有怎么大的差别?
答:可能与它们的结构特点有关。
共价键
[思考3]:金刚石晶体中存在哪些微粒?它们是如何结合成晶体的?
三、原子晶体
相邻原子通过共价键结合而形成空间网状结构的晶体。
[小结]:在金刚石晶体中,存在 。每个碳原子与相邻的 个碳原子以 结合形成 。(即原子晶体)
碳原子
四
共价键
空间网状结构
晶
体
硅
180
109 28
Si
o
共价键
记忆:常见的原子晶体:
金刚石、晶体硅、石英(SiO2)
[小结]:在SiO2晶体中,存在 。每个碳原子与相邻的 个氧原子(每个氧原子与相邻的 个碳原子)以
结合形成 。(即原子晶体) (填存在与不存在) 分子。
碳原子和氧原子
四
共价键
空间网状结构
二
不存在
四、晶体分类:
--根据构成晶体的粒子种类不同及粒子间的相互作用的不同。晶体分为离子晶体、分子晶体、原子晶体、金属晶体。
简介:金属晶体
金属阳离子
自由电子
几种常见晶体的物理性质
晶体 氯化钠 氯化钡 金刚石 二氧化硅 硫 白磷 钠 钨
熔点/oC 801 1560 〉3550 1723 112.8 44.1 97.8 3410
硬度 较硬 较硬 很硬 硬而脆 脆 软 柔软 硬
晶体类型
晶体性质特点
离子晶体
原子晶体
分子晶体
金属晶体
硬度较大、熔点较高
硬度大、熔点高
硬度小、熔点低
导电、传热、延展性、金属光泽
离子晶体 分子晶体 原子晶体 金属晶体
粒子种类
粒子间的相互作用
熔化时破坏的相互作用
阴、阳离子
离子键
分子
分子间作用力
原子
共价键
金属阳离子和自由电子
离子键
分子间作用力
共价键
2、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氢氧化钠熔化
1、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 BaSO4、 金刚石、
水晶(SiO2)、 Na2O、KOH。
C
课 堂 练 习
3、按下列四种有关性质的叙述,可能属于原子晶体的是( )
A、由分子间作用力结合而成,熔点很低; B、固体或熔融后易导电,熔点在1000℃左右;
C、由共价键结合成网状晶体,熔点很高D、固体不导电,但溶于水或熔融后能导电。
C
