福建省龙岩一高2021-2022学年高一上学期7月实验班选拔考试化学试题 PDF版含答案
文档属性
| 名称 | 福建省龙岩一高2021-2022学年高一上学期7月实验班选拔考试化学试题 PDF版含答案 | 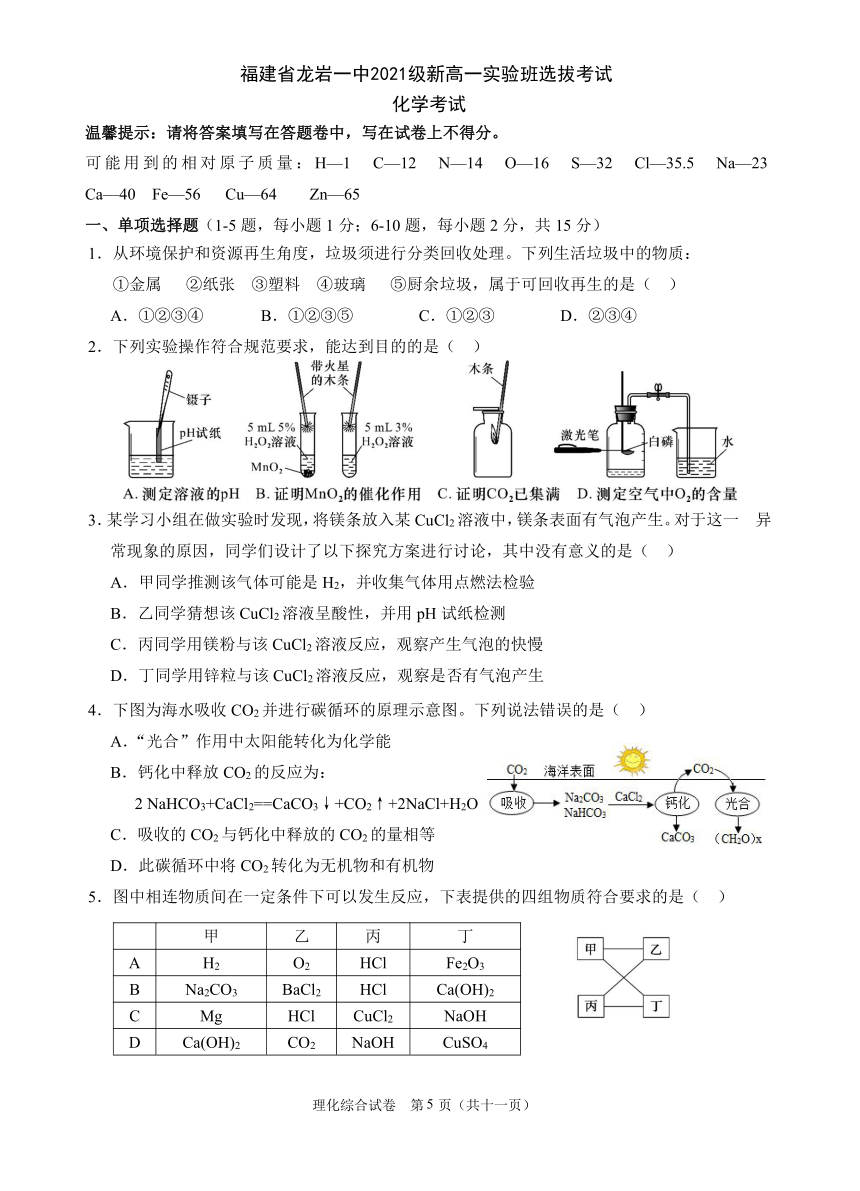 | |
| 格式 | |||
| 文件大小 | 570.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-30 22:01:58 | ||
图片预览



文档简介
福建省龙岩一中2021级新高一实验班选拔考试
化学考试
温馨提示:请将答案填写在答题卷中,写在试卷上不得分。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cl—35.5 Na—23
Ca—40 Fe—56 Cu—64 Zn—65
一、单项选择题(1-5 题,每小题 1 分;6-10 题,每小题 2 分,共 15 分)
1.从 环境 保护 和资 源再 生角 度 ,垃 圾须 进行 分类 回收 处理 。下 列生 活垃 圾中 的物 质:
①金属 ② 纸张 ③ 塑料 ④ 玻璃 ⑤ 厨余 垃圾 ,属 于可 回收 再生 的是 ( )
A.①②③ ④ B.①②③ ⑤ C.①②③ D.②③④
2.下 列实 验操作符 合规 范要 求,能达 到目的的 是( )
3.某学习小组在做实 验时发现 ,将镁 条放 入某CuCl2溶液中,镁条 表面 有气 泡产 生。对于这一 异
常现 象的原因 ,同 学们设计 了以下探究方案进行讨 论,其中 没有意义 的是( )
A.甲同学推测 该气 体可 能是H2,并收集气体 用点 燃法检验
B.乙同学 猜想 该CuCl2溶液 呈酸 性,并用pH试纸检测
C.丙同学 用镁粉与 该CuCl2溶液 反应 ,观察产生气泡的快慢
D.丁同学 用锌粒与 该CuCl2溶液反应 ,观 察是否有气泡 产生
4.下图为海水 吸收CO2并进行碳循环的原理示 意图 。下 列说法错误的是( )
A.“ 光合 ”作用中太阳能转化为化 学能
B.钙化中释放CO2的反应为 :
2NaHCO3+CaCl2==CaCO3↓+CO2↑+2NaCl+ H2O
C.吸收的CO2与钙 化中释放 的CO2的量相等
D.此碳循 环中将CO2转化为无机物 和有机物
5.图 中相连物质间在一定条件下可以发生反应,下表提 供的四组物质 符合要求的是 ( )
甲 乙 丙 丁
A H2 O2 HCl Fe2O3
B Na2CO3 BaCl2 HCl Ca(OH)2
C Mg HCl CuCl2 NaOH
D Ca(OH)2 CO2 NaOH CuSO4
理化综合试卷 第 页5 (共十一页)
6.含硫煤燃烧会产生大气污染。为防治该污染,某工厂设计的新的治污方法不仅吸收了SO2,同
时还得到了某种化工产品。该工艺流程如图所示,下列叙述不正确的是( )
A.该流程中可得到化工产品 H2SO4
B.图中 FeSO4→Fe2(SO4)3的反应类型是复分解反应
C.该流程中化合价发生改变的元素为 Fe、S 和 O
D.图中吸收 SO2的化 学反 应方 程式 为:
Fe2(SO4)3 + SO2+ 2H2O == 2FeSO4+ 2H2SO4
7.某样品中仅含有Na2CO3、NaNO3和Ba(NO3)2中的一种或几种。现将13.8g样品加入足量的水,
样品全部溶解,再加入过量氯化钙溶液,得到10g沉淀。对样品中的组成判断合理的是( )
A.肯定没有Ba(NO3)2,含有Na2CO3和NaNO3
B.肯定没有Na2CO3,含有NaNO3和Ba(NO3)2
C.肯定不含NaNO3和Ba(NO3)2,只含有Na2CO3
D.肯定不含NaNO3,含有Na2CO3和Ba(NO3)2
8.将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和
反应时间的变化曲线如图所示,下列分析中正确的是( )
A.AB段表示未发生化学反应
B.C点生成的氢气质量大于D点
C.CD段压强变化的主要影响因素是气体温度
D.D点表示反应恰好结束
9.甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响。它们的溶解度曲线如
右图所示。下列说法正确的是( )
A.t1℃甲、乙的饱和溶液,降低温度,甲先析出晶体
B.t1℃时,70g甲的饱和溶液加入40g乙物质,溶液质量仍为70g
C.将t2℃甲、乙的饱和溶液分别降温至t1℃,析出晶体的质量:甲>乙
D.将t1℃甲、乙的饱和溶液分别升温至t2℃,溶液的质量质数:甲=乙
10.FeCl3溶液常用于蚀刻印刷电路,反应原理为 aFeCl3+bCu==c CuCl2+dX。向含溶质32.5g的
FeCl3溶液中慢慢加入一定量的铜粉,反应过程中FeCl3、CuCl2的质量随铜粉的质量变化如
图所示,下列说法不正确的是( )
A.X不可能为Fe
B.化学计量数c=1
C.化学方程式中a和b的比为1:2
D.完全反应后,生成X的质量为25.4g
二、填空简答题(本大题包括4小题,共21分)
理化综合试卷 第6页(共十一页)
11.(5分)请沿用科学家认识事物的方式认识“空气”。
(1)从分类角度:空气属于 (填“混合物”或“纯净物”)。
(2)从微观角度:用“ ”表示氮原子,“ ”表 示氧原 子 。
①用“ ”可表示的微粒是 (填微粒名称)。
②同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,下图可表示空
气微观模型的是 (填标号)。
(3)从变化角度:已知常压下,氮气沸点-196℃,氧气沸点-183℃。将燃着的木条置于盛满
液态空气的烧杯口,观察到的现象是 。将该烧杯放置一段时间后,液态物质剩余约
1/10体积,其主要成分是 。
(4)从应用角度:利用空气制取氮肥的流程如下图所示。
①Ⅰ中参加反应的单质甲为 。
②Ⅱ中反应的化学方程式为 。
③物质所含元素化合价有发生变化的反应称为氧化还原反应。反应Ⅲ (填“属于”或
“不属于”)氧化还原反应。
(5)从环保角度:下列保护空气措施合理的是 (填标号)。
A.工厂通过加高烟囱直接排放废气 B.推广使用乙醇汽油代替普通汽油
C.提倡步行、骑自行车等“低碳”出行方式
12.(4分)下图是元素周期表中第2、3周期的元素,请回答有关问题:
3Li 4Be 5B 6C 7N 8O 9F 10Ne
2 锂 铍 硼 碳 氮 氧 氟 氖
6.94 9.01 10.81 12.01 14.01 16.00 19.00 20.18
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
3 钠 镁 铝 硅 磷 硫 氯 氩
22.99 24.31 26.98 28.09 30.97 32.07 35.45 39.95
(1)第9号元素与第12号元素原子形成化合物的化学式 ;
(2)具有相似化学性质的元素是 ;
①Na、Cl ②O、S ③F、Cl ④Cl、Ar
(3)某微粒的结构示意如右图所示,当x-y=8时,该粒子的符号为______;
(4)具有相同原子数和电子数的分子或离子称为等电子体,等电子体具有相似的结构。
下列各组粒子中属于等电子体的是_____。
— —
A.CO与N2 B.CO2与SO2 C.H2O与NH3 D.SO42 与ClO4
13.(5分)下图为硫及其化合物的价类图,其中各字母代表含硫元素的物质,回答下列问题:
理化综合试卷 第7页(共十一页)
(1)物质d的化学式为______;
(2)若g、h为中学常见的两种钠盐,固体g露置于
空气中易被氧化为h,写出该化学方程式:
__________________________________;
(3)实验室常用固体 g与70%f浓溶液制备气体b,写出反应该化学方程式:
____________________________________________。
14.(7分)草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产
锂电池的原材料。某兴趣小组设计实验验证草酸亚铁晶体热分解的气体产物,探究过程如下:
【查阅资料】草酸亚铁晶体热分解的气体产物是H2O,CO,CO2。
【实验设计】从下图所示的装置中选择(必要时可以重复)并连接,进行实验。
(1)装置连接顺序为A→___________________________________→B。
(2)装置B的作用是________________________________。
(3)证明草酸亚铁晶体热分解的气体产物中含CO的实验现象是____________________。
【问题讨论】
(4)该兴趣小组进行上述实验时,先点燃装置A中的酒精灯,一段时间后再点燃G处的酒
精灯,原因是_________________________________________________。
三、计算题
15.(4分)某化学兴趣小组的同学为了测定某黄铜(铜锌合金)的组成,取mg黄铜样品于烧杯
中,向其中分4次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量
及剩余固体的质量记录于下表,求:
加入稀硫酸的质量/g 充分反应后剩余固体的质量/g
第1次 10 n
第2次 10 6.0
第3次 10 4.0
第4次 10 3.5
(1)n= ,m= 。
(2)最终所得溶液中ZnSO4的质量分数(精确到0.1%,不考虑反应带出的水蒸气,有简要计算过程)。
理化综合试卷 第8页(共十一页)
第二部分 化学部分(40分)
一、单项选择题(1-5题,每小题1分;6—10题,每小题2分,共15分)
题号 1 2 3 4 5 6 7 8 9 10
答案
二、填空简答题(本大题包括4小题,共21分)
11.(5分)(1)____________。(2)①_____________; ②_____;
(3)_____________________; _______。
(4)①_______; ②____________________________________; ③________。
(5)______。
12.(4分)(1)_________; (2)________; (3)________; (4)________。
13.(5分)(1)_________;(2)____________________________________;
(3)_________________________________________。
14.(7分)
(1)_________________________________________;
(2)_________________________________________;
(3)_________________________________________;
(4)_______________________________________________________。
三、计算题
15.(4分)
(1)n= ,m= 。
(2)
理化综合试卷 第11页(共十一页)
第二部分 化学部分
一、单项选择题(1—5题,每小题1分,6—10题,每小题2分,共15分)
1—5ADCCD 6—10BACDC
二 、 填 空简 答 题(本 大题 包括 4小 题, 共21分)
11.(5分)
(1)混 合物 (0.5分)
(2)①氧分子 (或 氧气 分子 )(0.5分, 未写 分子 不给 分) ②C(0.5分)
(3)燃 着的 木条 熄灭 (0.5分) 液氧 (0.5分)
(4)①H2 (0.5分) ②4NH3+5O2 4NO+6H2O(1分)
③属于(0.5分) (5)BC(全对0.5分)
12.(4分)
(1)MgF2;(1分)(2)②③;(1分)(3)S2- (1分)(4)AD(1分)
13.(5分)
(1)H2S(1分) (2)2Na2SO3+O2=2Na2SO4 (2分)
(3)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O (2分)
14.(7分)
(1)F、C、D、C(可不写)、E、G、C(全对2分)
(2)收集尾气,防止未反应CO扩散到空气中造成污染;(1分)
(3)G中固体变红,最后一个C中石灰水变浑浊;(每个现象1分,共2分)
(4)可燃性气体CO与O2混合比达到一定程度时,加热可能发生爆炸,故不宜先点燃G处酒精
灯。(2分)
三、计算题
15.(4分)
(1) 8 10 (各1分)
(2) Zn+H2SO4=ZnSO4+H2↑
65 161 2
6.5g m(ZnSO4) m(H2)
∴ m(ZnSO4)=16.1g m(H2)=0.2g
∴ w(ZnSO4)=[16.1g÷ (40+6.5-0.2)g]×100%=34.8%(2分)
理化综合试卷 第14页(共十一页)
化学考试
温馨提示:请将答案填写在答题卷中,写在试卷上不得分。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cl—35.5 Na—23
Ca—40 Fe—56 Cu—64 Zn—65
一、单项选择题(1-5 题,每小题 1 分;6-10 题,每小题 2 分,共 15 分)
1.从 环境 保护 和资 源再 生角 度 ,垃 圾须 进行 分类 回收 处理 。下 列生 活垃 圾中 的物 质:
①金属 ② 纸张 ③ 塑料 ④ 玻璃 ⑤ 厨余 垃圾 ,属 于可 回收 再生 的是 ( )
A.①②③ ④ B.①②③ ⑤ C.①②③ D.②③④
2.下 列实 验操作符 合规 范要 求,能达 到目的的 是( )
3.某学习小组在做实 验时发现 ,将镁 条放 入某CuCl2溶液中,镁条 表面 有气 泡产 生。对于这一 异
常现 象的原因 ,同 学们设计 了以下探究方案进行讨 论,其中 没有意义 的是( )
A.甲同学推测 该气 体可 能是H2,并收集气体 用点 燃法检验
B.乙同学 猜想 该CuCl2溶液 呈酸 性,并用pH试纸检测
C.丙同学 用镁粉与 该CuCl2溶液 反应 ,观察产生气泡的快慢
D.丁同学 用锌粒与 该CuCl2溶液反应 ,观 察是否有气泡 产生
4.下图为海水 吸收CO2并进行碳循环的原理示 意图 。下 列说法错误的是( )
A.“ 光合 ”作用中太阳能转化为化 学能
B.钙化中释放CO2的反应为 :
2NaHCO3+CaCl2==CaCO3↓+CO2↑+2NaCl+ H2O
C.吸收的CO2与钙 化中释放 的CO2的量相等
D.此碳循 环中将CO2转化为无机物 和有机物
5.图 中相连物质间在一定条件下可以发生反应,下表提 供的四组物质 符合要求的是 ( )
甲 乙 丙 丁
A H2 O2 HCl Fe2O3
B Na2CO3 BaCl2 HCl Ca(OH)2
C Mg HCl CuCl2 NaOH
D Ca(OH)2 CO2 NaOH CuSO4
理化综合试卷 第 页5 (共十一页)
6.含硫煤燃烧会产生大气污染。为防治该污染,某工厂设计的新的治污方法不仅吸收了SO2,同
时还得到了某种化工产品。该工艺流程如图所示,下列叙述不正确的是( )
A.该流程中可得到化工产品 H2SO4
B.图中 FeSO4→Fe2(SO4)3的反应类型是复分解反应
C.该流程中化合价发生改变的元素为 Fe、S 和 O
D.图中吸收 SO2的化 学反 应方 程式 为:
Fe2(SO4)3 + SO2+ 2H2O == 2FeSO4+ 2H2SO4
7.某样品中仅含有Na2CO3、NaNO3和Ba(NO3)2中的一种或几种。现将13.8g样品加入足量的水,
样品全部溶解,再加入过量氯化钙溶液,得到10g沉淀。对样品中的组成判断合理的是( )
A.肯定没有Ba(NO3)2,含有Na2CO3和NaNO3
B.肯定没有Na2CO3,含有NaNO3和Ba(NO3)2
C.肯定不含NaNO3和Ba(NO3)2,只含有Na2CO3
D.肯定不含NaNO3,含有Na2CO3和Ba(NO3)2
8.将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和
反应时间的变化曲线如图所示,下列分析中正确的是( )
A.AB段表示未发生化学反应
B.C点生成的氢气质量大于D点
C.CD段压强变化的主要影响因素是气体温度
D.D点表示反应恰好结束
9.甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响。它们的溶解度曲线如
右图所示。下列说法正确的是( )
A.t1℃甲、乙的饱和溶液,降低温度,甲先析出晶体
B.t1℃时,70g甲的饱和溶液加入40g乙物质,溶液质量仍为70g
C.将t2℃甲、乙的饱和溶液分别降温至t1℃,析出晶体的质量:甲>乙
D.将t1℃甲、乙的饱和溶液分别升温至t2℃,溶液的质量质数:甲=乙
10.FeCl3溶液常用于蚀刻印刷电路,反应原理为 aFeCl3+bCu==c CuCl2+dX。向含溶质32.5g的
FeCl3溶液中慢慢加入一定量的铜粉,反应过程中FeCl3、CuCl2的质量随铜粉的质量变化如
图所示,下列说法不正确的是( )
A.X不可能为Fe
B.化学计量数c=1
C.化学方程式中a和b的比为1:2
D.完全反应后,生成X的质量为25.4g
二、填空简答题(本大题包括4小题,共21分)
理化综合试卷 第6页(共十一页)
11.(5分)请沿用科学家认识事物的方式认识“空气”。
(1)从分类角度:空气属于 (填“混合物”或“纯净物”)。
(2)从微观角度:用“ ”表示氮原子,“ ”表 示氧原 子 。
①用“ ”可表示的微粒是 (填微粒名称)。
②同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,下图可表示空
气微观模型的是 (填标号)。
(3)从变化角度:已知常压下,氮气沸点-196℃,氧气沸点-183℃。将燃着的木条置于盛满
液态空气的烧杯口,观察到的现象是 。将该烧杯放置一段时间后,液态物质剩余约
1/10体积,其主要成分是 。
(4)从应用角度:利用空气制取氮肥的流程如下图所示。
①Ⅰ中参加反应的单质甲为 。
②Ⅱ中反应的化学方程式为 。
③物质所含元素化合价有发生变化的反应称为氧化还原反应。反应Ⅲ (填“属于”或
“不属于”)氧化还原反应。
(5)从环保角度:下列保护空气措施合理的是 (填标号)。
A.工厂通过加高烟囱直接排放废气 B.推广使用乙醇汽油代替普通汽油
C.提倡步行、骑自行车等“低碳”出行方式
12.(4分)下图是元素周期表中第2、3周期的元素,请回答有关问题:
3Li 4Be 5B 6C 7N 8O 9F 10Ne
2 锂 铍 硼 碳 氮 氧 氟 氖
6.94 9.01 10.81 12.01 14.01 16.00 19.00 20.18
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
3 钠 镁 铝 硅 磷 硫 氯 氩
22.99 24.31 26.98 28.09 30.97 32.07 35.45 39.95
(1)第9号元素与第12号元素原子形成化合物的化学式 ;
(2)具有相似化学性质的元素是 ;
①Na、Cl ②O、S ③F、Cl ④Cl、Ar
(3)某微粒的结构示意如右图所示,当x-y=8时,该粒子的符号为______;
(4)具有相同原子数和电子数的分子或离子称为等电子体,等电子体具有相似的结构。
下列各组粒子中属于等电子体的是_____。
— —
A.CO与N2 B.CO2与SO2 C.H2O与NH3 D.SO42 与ClO4
13.(5分)下图为硫及其化合物的价类图,其中各字母代表含硫元素的物质,回答下列问题:
理化综合试卷 第7页(共十一页)
(1)物质d的化学式为______;
(2)若g、h为中学常见的两种钠盐,固体g露置于
空气中易被氧化为h,写出该化学方程式:
__________________________________;
(3)实验室常用固体 g与70%f浓溶液制备气体b,写出反应该化学方程式:
____________________________________________。
14.(7分)草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产
锂电池的原材料。某兴趣小组设计实验验证草酸亚铁晶体热分解的气体产物,探究过程如下:
【查阅资料】草酸亚铁晶体热分解的气体产物是H2O,CO,CO2。
【实验设计】从下图所示的装置中选择(必要时可以重复)并连接,进行实验。
(1)装置连接顺序为A→___________________________________→B。
(2)装置B的作用是________________________________。
(3)证明草酸亚铁晶体热分解的气体产物中含CO的实验现象是____________________。
【问题讨论】
(4)该兴趣小组进行上述实验时,先点燃装置A中的酒精灯,一段时间后再点燃G处的酒
精灯,原因是_________________________________________________。
三、计算题
15.(4分)某化学兴趣小组的同学为了测定某黄铜(铜锌合金)的组成,取mg黄铜样品于烧杯
中,向其中分4次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量
及剩余固体的质量记录于下表,求:
加入稀硫酸的质量/g 充分反应后剩余固体的质量/g
第1次 10 n
第2次 10 6.0
第3次 10 4.0
第4次 10 3.5
(1)n= ,m= 。
(2)最终所得溶液中ZnSO4的质量分数(精确到0.1%,不考虑反应带出的水蒸气,有简要计算过程)。
理化综合试卷 第8页(共十一页)
第二部分 化学部分(40分)
一、单项选择题(1-5题,每小题1分;6—10题,每小题2分,共15分)
题号 1 2 3 4 5 6 7 8 9 10
答案
二、填空简答题(本大题包括4小题,共21分)
11.(5分)(1)____________。(2)①_____________; ②_____;
(3)_____________________; _______。
(4)①_______; ②____________________________________; ③________。
(5)______。
12.(4分)(1)_________; (2)________; (3)________; (4)________。
13.(5分)(1)_________;(2)____________________________________;
(3)_________________________________________。
14.(7分)
(1)_________________________________________;
(2)_________________________________________;
(3)_________________________________________;
(4)_______________________________________________________。
三、计算题
15.(4分)
(1)n= ,m= 。
(2)
理化综合试卷 第11页(共十一页)
第二部分 化学部分
一、单项选择题(1—5题,每小题1分,6—10题,每小题2分,共15分)
1—5ADCCD 6—10BACDC
二 、 填 空简 答 题(本 大题 包括 4小 题, 共21分)
11.(5分)
(1)混 合物 (0.5分)
(2)①氧分子 (或 氧气 分子 )(0.5分, 未写 分子 不给 分) ②C(0.5分)
(3)燃 着的 木条 熄灭 (0.5分) 液氧 (0.5分)
(4)①H2 (0.5分) ②4NH3+5O2 4NO+6H2O(1分)
③属于(0.5分) (5)BC(全对0.5分)
12.(4分)
(1)MgF2;(1分)(2)②③;(1分)(3)S2- (1分)(4)AD(1分)
13.(5分)
(1)H2S(1分) (2)2Na2SO3+O2=2Na2SO4 (2分)
(3)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O (2分)
14.(7分)
(1)F、C、D、C(可不写)、E、G、C(全对2分)
(2)收集尾气,防止未反应CO扩散到空气中造成污染;(1分)
(3)G中固体变红,最后一个C中石灰水变浑浊;(每个现象1分,共2分)
(4)可燃性气体CO与O2混合比达到一定程度时,加热可能发生爆炸,故不宜先点燃G处酒精
灯。(2分)
三、计算题
15.(4分)
(1) 8 10 (各1分)
(2) Zn+H2SO4=ZnSO4+H2↑
65 161 2
6.5g m(ZnSO4) m(H2)
∴ m(ZnSO4)=16.1g m(H2)=0.2g
∴ w(ZnSO4)=[16.1g÷ (40+6.5-0.2)g]×100%=34.8%(2分)
理化综合试卷 第14页(共十一页)
同课章节目录
