重庆市渝中区2020-2021学年高一下学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 重庆市渝中区2020-2021学年高一下学期期中考试化学试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 225.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-30 22:05:54 | ||
图片预览



文档简介
重庆市渝中区2020-2021学年高一下学期期中考试
化学试题
时间:75分钟 总分:100分
可能用到的相对原子质量: N-14 O-16 S-32 Fe-56 Cu-64
第I卷选择题(共42分)
一、选择题(共14小题,每小题3分,满分42分。每小题给出的四个选项中,只有一项符合题目要求)
1.下列说法正确的是( )
A.?酸雨是指pH小于7的降水
B.?Na2O2、Na2O都是碱性氧化物
C.?城市空气质量报告中包括 PM2.5、SO2、NO2、CO2等污染物。
D.?钢是用量最大、用途最广的合金
2.二氧化硫能使溴水褪色,说明二氧化硫具有( )
还原性B.氧化性
C.漂白性D.酸性
具有氮的固定作用的化学反应是( )
A.氮气与氢气在一定条件下反应生成氨气
B.一氧化氮与氧气反应生成二氧化氮
C.氨气经催化氧化生成一氧化氮
D.由氨气制碳酸氢铵和硫酸铵
4. 下列是对某溶液进行离子检测的方法和结论,其中正确的是(??? ?)
A.?用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
B.?加入足量的CaCl2溶液,产生白色沉淀,则溶液中一定含有大量的CO32-
C.?加入NaOH溶液后加热产生有刺激性气味的气体,则溶液中一定含有大量的NH4+
D.?先加入适量的盐酸酸化,再加入AgNO3溶液,产生白色沉淀,则溶液中一定含有大量的Cl-
5.硅及其化合物与科学、技术,社会,环境密切相关。下列有关说法不正确的是( )
A.单质硅是将太阳能转变为电能的常用材料
B.硅主要以单质形式存在于自然界中
C.水晶、石英、玛瑙等的主要成分是false而不是硅酸盐
D.传统无机非金属材料陶瓷、水泥、玻璃的主要成分是硅酸盐
6.下列现象的产生与人为排放的含硫物质有关的是( )
A.温室效应 B.光化学烟雾 C.水体富营养化 D.酸雨
7(改编).下列离子方程式书写正确的是( )
A.将少量false通入NaOH溶液中:false
B将NaOH溶液与false溶液混合并加热:false
C.向氨水中加入盐酸:false
D向氨水中加入氯化铁溶液:false
8(改编).检验下列物质所用的方法和对应实验现象均正确的是( )
选项
待检验物质
方法与操作
实验现象
A
false
取待检验溶液于试管中,加入氢氧化钠,在试管口放湿润的蓝色石蕊试纸
蓝色石蕊试纸变红
B
false
取待检验溶液于试管中,加入铜片
试管口有红棕色气体产生
C
false
取待检验溶液于试管中,加入盐酸酸化无明显现象,取上层清液再加入false溶液
有白色沉淀产生
D
false
将气体通入酸性false溶液中
false溶液褪色
根据红外研究结果推测,false在false(Sn为false)上吸附/脱附过程可以用如下反应来表示,吸附:false
脱附:falsefalse。
下列说法不正确的是( )
A.吸附过程中false是氧化剂
B.当气体变为无色,吸附过程完成
C.脱附过程中生成的false的化学式为false
D.脱附过程中生成0.1molfalse时,转移的电子的物质的量为0.2mol
10(改编). 铜粉放入稀硫酸中,加热后无明显现象发生。当加入下列一种物质后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出,该物质是( )
A.?Al2(SO4)3?????????????????????????????B.?Na2CO3????????????????????C.?NaNO3???????????????????????D.?Fe2(SO4)3
11.青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸处理时,还原产物只有NO,下列说法不正确的是( )
A.青石棉是一种硅酸盐产品
B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O
D. 1 mol青石棉能还原1 mol HNO3
12.在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀盐酸,完全反应后,离子数目几乎没有改变的是( )
A.?Fe2+??????????????????????????????????B.?Fe3+????? ?????????????????????????C.?Al3+??????????????????????????????????D.?NH4+
13. 相同质量的四份铜片,分别置于足量的下列酸中,在一定条件下反应,所得到的气体的物质的量最多的是( )
A.浓硫酸B.稀硫酸 C.浓硝酸 D.稀硝酸
14.已知硫代硫酸钠可作为脱氧剂,25.0 mL 0.100 mol·L-1的Na2S2O3溶液恰好把224 mL(标准状况下)Cl2转化为Cl-,则S2O将转化为( )
A. S2-B. SC. SOD. SO
第II卷非选择题(共58分)
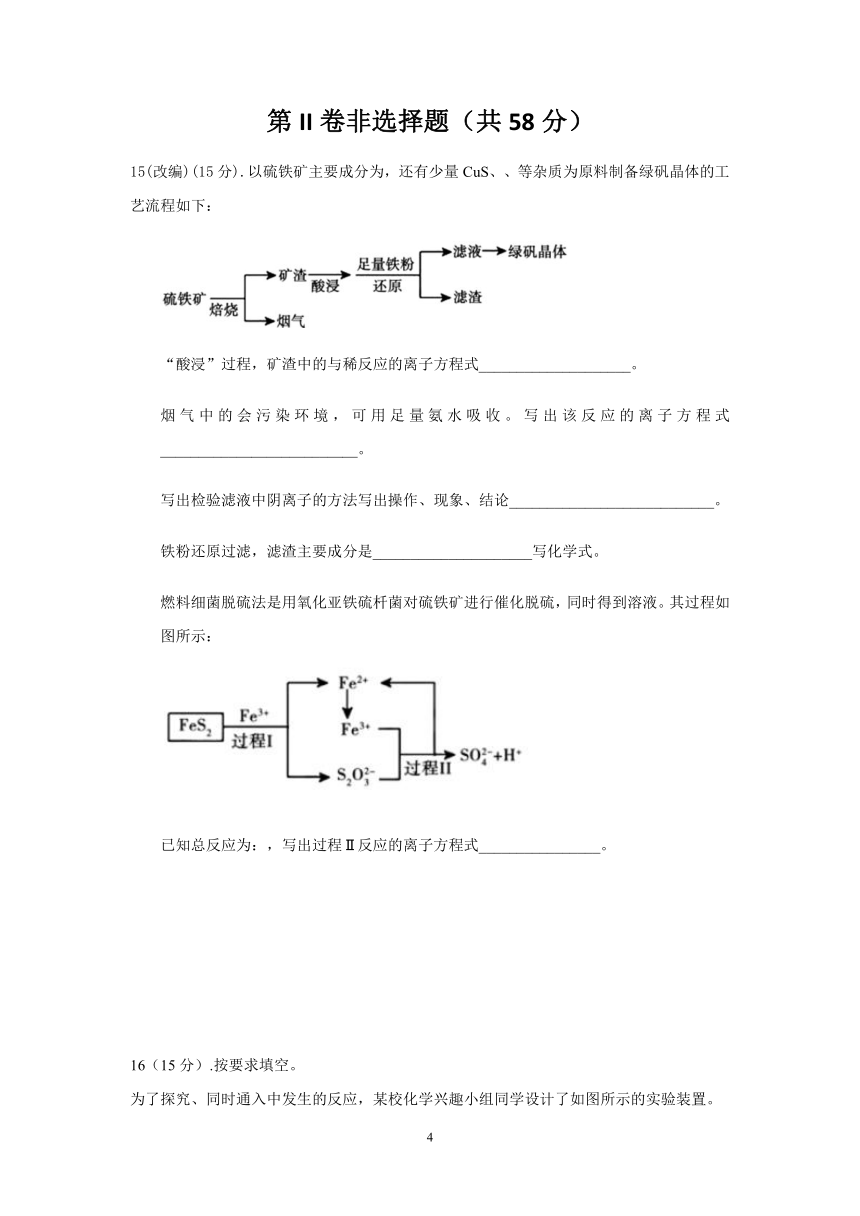
15(改编)(15分).以硫铁矿主要成分为,还有少量CuS、、等杂质为原料制备绿矾晶体的工艺流程如下:
“酸浸”过程,矿渣中的与稀反应的离子方程式____________________。
烟气中的会污染环境,可用足量氨水吸收。写出该反应的离子方程式__________________________。
写出检验滤液中阴离子的方法写出操作、现象、结论___________________________。
铁粉还原过滤,滤渣主要成分是_____________________写化学式。
燃料细菌脱硫法是用氧化亚铁硫杄菌对硫铁矿进行催化脱硫,同时得到溶液。其过程如图所示:
?
已知总反应为:,写出过程Ⅱ反应的离子方程式________________。
16(15分).按要求填空。
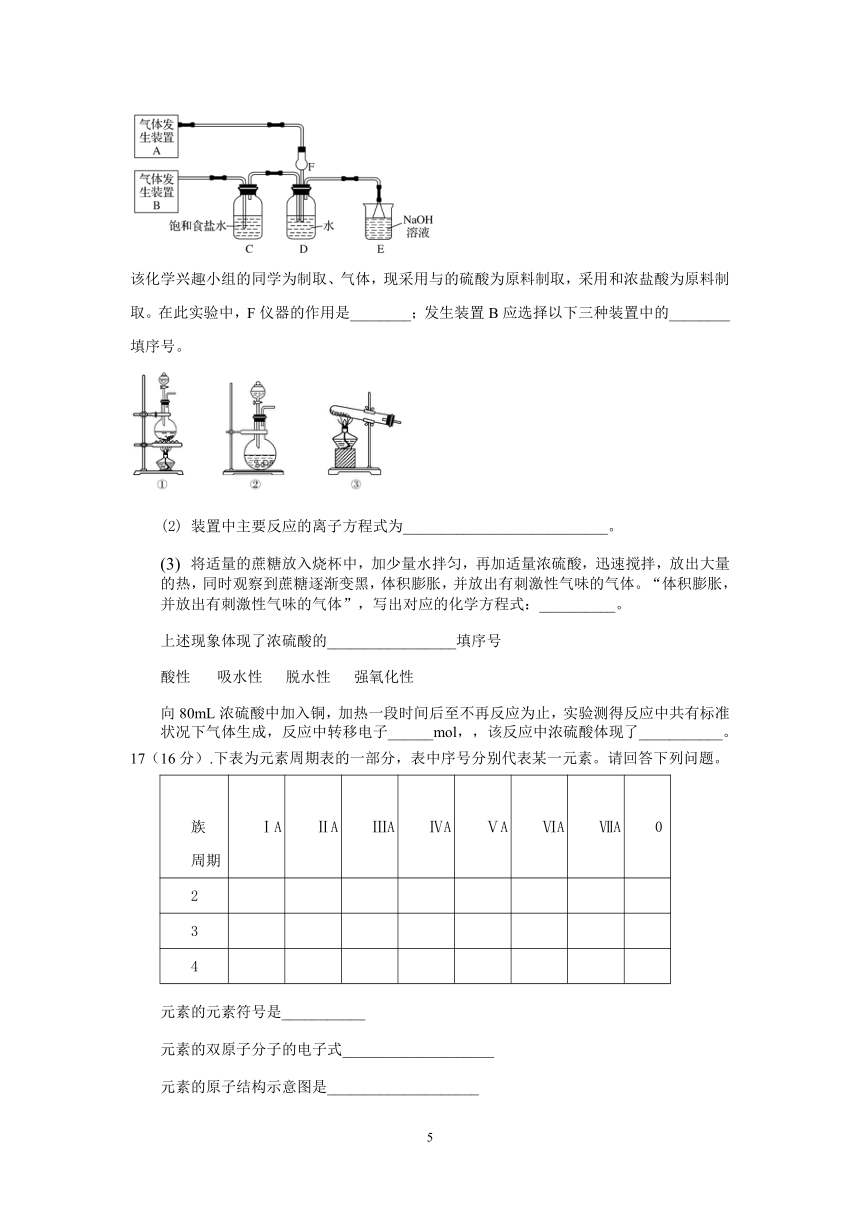
为了探究、同时通入中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
该化学兴趣小组的同学为制取、气体,现采用与的硫酸为原料制取,采用和浓盐酸为原料制取。在此实验中,F仪器的作用是________;发生装置B应选择以下三种装置中的________填序号。
装置中主要反应的离子方程式为___________________________。
将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。“体积膨胀,并放出有刺激性气味的气体”,写出对应的化学方程式:__________。
上述现象体现了浓硫酸的_________________填序号
酸性????? 吸水性???? 脱水性???? 强氧化性
向80mL浓硫酸中加入铜,加热一段时间后至不再反应为止,实验测得反应中共有标准状况下气体生成,反应中转移电子______mol,,该反应中浓硫酸体现了___________。
17(16分).下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
? 族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
3
4
元素的元素符号是___________
元素的双原子分子的电子式____________________
元素的原子结构示意图是____________________
这十种元素的最高价氧化物中,属于两性氧化物的是_______________填化学式。
中,最活泼的金属元素是________写元素符号,下同,最不活泼的元素是_____
中,其原子半径最大的是________写元素符号;最高价氧化物的水化物中:酸性最强的是____________填化学式;碱性最强的是__________________填化学式,该碱与的最高价氧化物的水化物反应的化学方程式为________________________
的气态氢化物,更稳定的是____________填化学式;元素的非金属性:________填“”或“”。
18(改编)(12分).Ⅰ某同学做如下实验,以探究反应中的能量变化。
?
在实验中发现反应后中温度升高,由此可以判断中反应是________热反应;中温度降低,由此可以判断中反应是________热反应。
根据能量守恒定律,中反应物的总能量应该________生成物的总能量。
Ⅱ某学习小组依据氧化还原反应原理:设计成的原电池如下图所示。
从能量转化角度分析,上述原电池将化学能转化为________。
负极的电极材料为________。
正极发生的电极反应:________。
重庆市渝中区2020-2021学年高一下学期期中考试
化学答案
1-5 D A A C B 6-10 D D C AC 11-14 B C C D
15【答案】?(3分)
(3分)
取少量溶液于试管中,先加稀盐酸,再加溶液,有白色沉淀生成,证明含有硫酸根离子?;(3分)
、Cu、(3分)
(3分)
【解析】
【分析】
本题考查离子方程式的书写、硫酸根离子的检验等内容,题目难度中等,熟练掌握工艺流程中的物质变化是解题的关键。
【解答】
硫铁矿的主要成分为,在煅烧时、CuS反应产生和氧化铜,矿渣用酸处理,与酸反应产生和水,氧化铜与酸反应产生和水,等杂质不能与酸反应,向反应后的溶液中加入足量还原铁粉,铁离子反应转化为亚铁离子,反应转化为Cu,然后过滤,将滤液蒸发浓缩冷却结晶可得绿矾,滤渣主要成分是Fe、Cu、。
“酸浸”过程,矿渣中的碱性氧化物与稀反应产生硫酸铁和水,反应的离子方程式为:;
在煅烧时硫铁矿中的S元素转化为烟气中的会污染环境,可用足量氨水吸收,与氨水反应产生亚硫酸铵和水,该反应的离子方程式为;
滤液中金属阴离子是,检验的方法是取少量溶液于试管中,先加稀盐酸,再加溶液,有白色沉淀生成,证明含有硫酸根离子?;
由上面分析可知,铁粉还原过滤,滤渣主要成分是Fe、Cu、;
由于总反应为:,所以过程Ⅱ反应的离子方程式为:。
16.(15分)【答案】防倒吸(2分);(2分)
(2分)
浓??(2分)
???(3分)
? ;强氧化性、酸性(2分)
【解析】
【分析】
本题考查物质的性质以及探究性实验,为高频考点,难度不大。掌握氯气、二氧化硫的制取和性质、浓硫酸的性质以及氧化还原反应计算是解答关键。
【解答】
饱和食盐水用于吸收氯气中的HCl,则B为制备氯气装置,用和浓盐酸为原料制取需要加热,所以装置B选择;A中生成,在D中氯气、二氧化硫和水发生反应,装置F的作用是防倒吸;
中氯气、二氧化硫和水发生反应,生成和HCl,离子方程式为
;
蔗糖逐渐变黑,说明有碳单质生成,体积膨胀,并放出有刺激性气味的气体,反应方程式为浓;
迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,体现了浓硫酸的吸水性、脱水性;体积膨胀,并放出有刺激性气味的气体,中S元素化合价降低,被还原,体现了浓硫酸的强氧化性,故答案为;
浓,生成标准状况下,物质的量为,则转移电子的物质的量为,浓硫酸被还原,体现了其强氧化性,产物有硫酸铜,体现了其酸性。
17.(16分)【答案】(1分)
?(2分)
?(2分)
3(2分)
; Ne??(1分)
;(1分)?;NaOH?(1分) ; 。
?(1分) ;(1分)
【解析】
【分析】
本题考查元素周期表的结构及应用,为高频考点,把握元素的位置及元素周期律为解答的关键,注意常见元素化合物性质的应用,题目难度较易。
【解答】
由元素在周期表的位置可知,分别为Na、K、Mg、Ca、Al、Si、N、F、Cl、Ne;
元素的元素符号是
元素的双原子分子氯气的电子式;
元素即Si的原子结构示意图是;
这十种元素的最高价氧化物中,属于两性氧化物的是? ;
上表中左下角的金属K金属性最强,最不活泼的元素是Ne,故本题的答案为:?K,Ne? ;?
根据同周期元素从左到右原子半径逐渐减小,可知中其原子半径最大的是Na;根据同周期从左到右元素的非金属性逐渐增强和金属性逐渐减弱、元素的非金属性越强则其最高价氧化物的水化物酸性越强和元素的金属性越强则其最高价氧化物的水化物碱性越强可知高氯酸为含氧酸中酸性最强的酸,该酸的化学式为;碱性最强的是NaOH? ;该碱与的最高价氧化物的水化物反应的化学方程式为 ;
非金属性越强,气态氢化物越稳定,F的非金属最强,则更稳定的为HF;
N的非金属性强于同主族的P,P的非金属性强于同周期的Si,故N的非金属强于Si,。
18.(12分)【答案】Ⅰ放(2分);吸(2分)
低于(2分)
Ⅱ电能(2分)
或铜(2分)
(2分)
【解析】
【分析】
本题考查能量变化探究实验与原电池实验方案的设计,设计能量变化实验过程中的现象,原电池概念、正负极判断以及电极反应式的书写,题目难度一般。
【解答】
Ⅰ在实验中发现反应后中温度升高,由此可以判断中反应是放热反应;中温度降低,由此可以判断中反应是吸热反应;
根据能量守恒定律,由于中的反应是吸热反应,故中反应物的总能量低于生成物的总能量;
Ⅱ原电池就是将化学能直接转化为电能的装置;
从原电池的反应式可知,Cu转化为化合价升高,被氧化发生氧化反应,原电池负极发生氧化反应,负极材料为或铜;
原电池正极发生还原反应,故应该是得到电子还原为Ag,正极的电极反应:。
化学试题
时间:75分钟 总分:100分
可能用到的相对原子质量: N-14 O-16 S-32 Fe-56 Cu-64
第I卷选择题(共42分)
一、选择题(共14小题,每小题3分,满分42分。每小题给出的四个选项中,只有一项符合题目要求)
1.下列说法正确的是( )
A.?酸雨是指pH小于7的降水
B.?Na2O2、Na2O都是碱性氧化物
C.?城市空气质量报告中包括 PM2.5、SO2、NO2、CO2等污染物。
D.?钢是用量最大、用途最广的合金
2.二氧化硫能使溴水褪色,说明二氧化硫具有( )
还原性B.氧化性
C.漂白性D.酸性
具有氮的固定作用的化学反应是( )
A.氮气与氢气在一定条件下反应生成氨气
B.一氧化氮与氧气反应生成二氧化氮
C.氨气经催化氧化生成一氧化氮
D.由氨气制碳酸氢铵和硫酸铵
4. 下列是对某溶液进行离子检测的方法和结论,其中正确的是(??? ?)
A.?用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
B.?加入足量的CaCl2溶液,产生白色沉淀,则溶液中一定含有大量的CO32-
C.?加入NaOH溶液后加热产生有刺激性气味的气体,则溶液中一定含有大量的NH4+
D.?先加入适量的盐酸酸化,再加入AgNO3溶液,产生白色沉淀,则溶液中一定含有大量的Cl-
5.硅及其化合物与科学、技术,社会,环境密切相关。下列有关说法不正确的是( )
A.单质硅是将太阳能转变为电能的常用材料
B.硅主要以单质形式存在于自然界中
C.水晶、石英、玛瑙等的主要成分是false而不是硅酸盐
D.传统无机非金属材料陶瓷、水泥、玻璃的主要成分是硅酸盐
6.下列现象的产生与人为排放的含硫物质有关的是( )
A.温室效应 B.光化学烟雾 C.水体富营养化 D.酸雨
7(改编).下列离子方程式书写正确的是( )
A.将少量false通入NaOH溶液中:false
B将NaOH溶液与false溶液混合并加热:false
C.向氨水中加入盐酸:false
D向氨水中加入氯化铁溶液:false
8(改编).检验下列物质所用的方法和对应实验现象均正确的是( )
选项
待检验物质
方法与操作
实验现象
A
false
取待检验溶液于试管中,加入氢氧化钠,在试管口放湿润的蓝色石蕊试纸
蓝色石蕊试纸变红
B
false
取待检验溶液于试管中,加入铜片
试管口有红棕色气体产生
C
false
取待检验溶液于试管中,加入盐酸酸化无明显现象,取上层清液再加入false溶液
有白色沉淀产生
D
false
将气体通入酸性false溶液中
false溶液褪色
根据红外研究结果推测,false在false(Sn为false)上吸附/脱附过程可以用如下反应来表示,吸附:false
脱附:falsefalse。
下列说法不正确的是( )
A.吸附过程中false是氧化剂
B.当气体变为无色,吸附过程完成
C.脱附过程中生成的false的化学式为false
D.脱附过程中生成0.1molfalse时,转移的电子的物质的量为0.2mol
10(改编). 铜粉放入稀硫酸中,加热后无明显现象发生。当加入下列一种物质后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出,该物质是( )
A.?Al2(SO4)3?????????????????????????????B.?Na2CO3????????????????????C.?NaNO3???????????????????????D.?Fe2(SO4)3
11.青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸处理时,还原产物只有NO,下列说法不正确的是( )
A.青石棉是一种硅酸盐产品
B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O
D. 1 mol青石棉能还原1 mol HNO3
12.在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀盐酸,完全反应后,离子数目几乎没有改变的是( )
A.?Fe2+??????????????????????????????????B.?Fe3+????? ?????????????????????????C.?Al3+??????????????????????????????????D.?NH4+
13. 相同质量的四份铜片,分别置于足量的下列酸中,在一定条件下反应,所得到的气体的物质的量最多的是( )
A.浓硫酸B.稀硫酸 C.浓硝酸 D.稀硝酸
14.已知硫代硫酸钠可作为脱氧剂,25.0 mL 0.100 mol·L-1的Na2S2O3溶液恰好把224 mL(标准状况下)Cl2转化为Cl-,则S2O将转化为( )
A. S2-B. SC. SOD. SO
第II卷非选择题(共58分)
15(改编)(15分).以硫铁矿主要成分为,还有少量CuS、、等杂质为原料制备绿矾晶体的工艺流程如下:
“酸浸”过程,矿渣中的与稀反应的离子方程式____________________。
烟气中的会污染环境,可用足量氨水吸收。写出该反应的离子方程式__________________________。
写出检验滤液中阴离子的方法写出操作、现象、结论___________________________。
铁粉还原过滤,滤渣主要成分是_____________________写化学式。
燃料细菌脱硫法是用氧化亚铁硫杄菌对硫铁矿进行催化脱硫,同时得到溶液。其过程如图所示:
?
已知总反应为:,写出过程Ⅱ反应的离子方程式________________。
16(15分).按要求填空。
为了探究、同时通入中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
该化学兴趣小组的同学为制取、气体,现采用与的硫酸为原料制取,采用和浓盐酸为原料制取。在此实验中,F仪器的作用是________;发生装置B应选择以下三种装置中的________填序号。
装置中主要反应的离子方程式为___________________________。
将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。“体积膨胀,并放出有刺激性气味的气体”,写出对应的化学方程式:__________。
上述现象体现了浓硫酸的_________________填序号
酸性????? 吸水性???? 脱水性???? 强氧化性
向80mL浓硫酸中加入铜,加热一段时间后至不再反应为止,实验测得反应中共有标准状况下气体生成,反应中转移电子______mol,,该反应中浓硫酸体现了___________。
17(16分).下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
? 族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
3
4
元素的元素符号是___________
元素的双原子分子的电子式____________________
元素的原子结构示意图是____________________
这十种元素的最高价氧化物中,属于两性氧化物的是_______________填化学式。
中,最活泼的金属元素是________写元素符号,下同,最不活泼的元素是_____
中,其原子半径最大的是________写元素符号;最高价氧化物的水化物中:酸性最强的是____________填化学式;碱性最强的是__________________填化学式,该碱与的最高价氧化物的水化物反应的化学方程式为________________________
的气态氢化物,更稳定的是____________填化学式;元素的非金属性:________填“”或“”。
18(改编)(12分).Ⅰ某同学做如下实验,以探究反应中的能量变化。
?
在实验中发现反应后中温度升高,由此可以判断中反应是________热反应;中温度降低,由此可以判断中反应是________热反应。
根据能量守恒定律,中反应物的总能量应该________生成物的总能量。
Ⅱ某学习小组依据氧化还原反应原理:设计成的原电池如下图所示。
从能量转化角度分析,上述原电池将化学能转化为________。
负极的电极材料为________。
正极发生的电极反应:________。
重庆市渝中区2020-2021学年高一下学期期中考试
化学答案
1-5 D A A C B 6-10 D D C AC 11-14 B C C D
15【答案】?(3分)
(3分)
取少量溶液于试管中,先加稀盐酸,再加溶液,有白色沉淀生成,证明含有硫酸根离子?;(3分)
、Cu、(3分)
(3分)
【解析】
【分析】
本题考查离子方程式的书写、硫酸根离子的检验等内容,题目难度中等,熟练掌握工艺流程中的物质变化是解题的关键。
【解答】
硫铁矿的主要成分为,在煅烧时、CuS反应产生和氧化铜,矿渣用酸处理,与酸反应产生和水,氧化铜与酸反应产生和水,等杂质不能与酸反应,向反应后的溶液中加入足量还原铁粉,铁离子反应转化为亚铁离子,反应转化为Cu,然后过滤,将滤液蒸发浓缩冷却结晶可得绿矾,滤渣主要成分是Fe、Cu、。
“酸浸”过程,矿渣中的碱性氧化物与稀反应产生硫酸铁和水,反应的离子方程式为:;
在煅烧时硫铁矿中的S元素转化为烟气中的会污染环境,可用足量氨水吸收,与氨水反应产生亚硫酸铵和水,该反应的离子方程式为;
滤液中金属阴离子是,检验的方法是取少量溶液于试管中,先加稀盐酸,再加溶液,有白色沉淀生成,证明含有硫酸根离子?;
由上面分析可知,铁粉还原过滤,滤渣主要成分是Fe、Cu、;
由于总反应为:,所以过程Ⅱ反应的离子方程式为:。
16.(15分)【答案】防倒吸(2分);(2分)
(2分)
浓??(2分)
???(3分)
? ;强氧化性、酸性(2分)
【解析】
【分析】
本题考查物质的性质以及探究性实验,为高频考点,难度不大。掌握氯气、二氧化硫的制取和性质、浓硫酸的性质以及氧化还原反应计算是解答关键。
【解答】
饱和食盐水用于吸收氯气中的HCl,则B为制备氯气装置,用和浓盐酸为原料制取需要加热,所以装置B选择;A中生成,在D中氯气、二氧化硫和水发生反应,装置F的作用是防倒吸;
中氯气、二氧化硫和水发生反应,生成和HCl,离子方程式为
;
蔗糖逐渐变黑,说明有碳单质生成,体积膨胀,并放出有刺激性气味的气体,反应方程式为浓;
迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,体现了浓硫酸的吸水性、脱水性;体积膨胀,并放出有刺激性气味的气体,中S元素化合价降低,被还原,体现了浓硫酸的强氧化性,故答案为;
浓,生成标准状况下,物质的量为,则转移电子的物质的量为,浓硫酸被还原,体现了其强氧化性,产物有硫酸铜,体现了其酸性。
17.(16分)【答案】(1分)
?(2分)
?(2分)
3(2分)
; Ne??(1分)
;(1分)?;NaOH?(1分) ; 。
?(1分) ;(1分)
【解析】
【分析】
本题考查元素周期表的结构及应用,为高频考点,把握元素的位置及元素周期律为解答的关键,注意常见元素化合物性质的应用,题目难度较易。
【解答】
由元素在周期表的位置可知,分别为Na、K、Mg、Ca、Al、Si、N、F、Cl、Ne;
元素的元素符号是
元素的双原子分子氯气的电子式;
元素即Si的原子结构示意图是;
这十种元素的最高价氧化物中,属于两性氧化物的是? ;
上表中左下角的金属K金属性最强,最不活泼的元素是Ne,故本题的答案为:?K,Ne? ;?
根据同周期元素从左到右原子半径逐渐减小,可知中其原子半径最大的是Na;根据同周期从左到右元素的非金属性逐渐增强和金属性逐渐减弱、元素的非金属性越强则其最高价氧化物的水化物酸性越强和元素的金属性越强则其最高价氧化物的水化物碱性越强可知高氯酸为含氧酸中酸性最强的酸,该酸的化学式为;碱性最强的是NaOH? ;该碱与的最高价氧化物的水化物反应的化学方程式为 ;
非金属性越强,气态氢化物越稳定,F的非金属最强,则更稳定的为HF;
N的非金属性强于同主族的P,P的非金属性强于同周期的Si,故N的非金属强于Si,。
18.(12分)【答案】Ⅰ放(2分);吸(2分)
低于(2分)
Ⅱ电能(2分)
或铜(2分)
(2分)
【解析】
【分析】
本题考查能量变化探究实验与原电池实验方案的设计,设计能量变化实验过程中的现象,原电池概念、正负极判断以及电极反应式的书写,题目难度一般。
【解答】
Ⅰ在实验中发现反应后中温度升高,由此可以判断中反应是放热反应;中温度降低,由此可以判断中反应是吸热反应;
根据能量守恒定律,由于中的反应是吸热反应,故中反应物的总能量低于生成物的总能量;
Ⅱ原电池就是将化学能直接转化为电能的装置;
从原电池的反应式可知,Cu转化为化合价升高,被氧化发生氧化反应,原电池负极发生氧化反应,负极材料为或铜;
原电池正极发生还原反应,故应该是得到电子还原为Ag,正极的电极反应:。
同课章节目录
