第十一单元课题1 生活中常见的盐-2020-2021学年九年级化学人教版下册(56张PPT)
文档属性
| 名称 | 第十一单元课题1 生活中常见的盐-2020-2021学年九年级化学人教版下册(56张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 9.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-01 08:24:20 | ||
图片预览







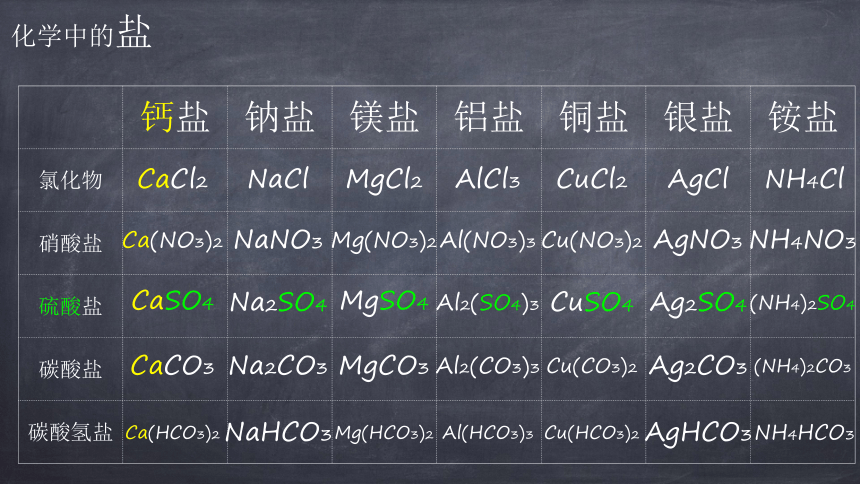




文档简介
(共56张PPT)
第十一单元
课题一
生活中常见的盐
作者:
第1课时
1.认识几种常见的盐;
2.掌握常见盐的物理性质和主要用途。
食盐
原从水中来,
不敢水中行。
人人都要我,
无我食不成。
打一物质
新闻事件
农户误用某工业盐造成8人食物中毒
厨师放错盐工人进医院石家庄37人中毒
亚硝酸钠
NaNO2
亚硝酸钠
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5
g即可引起食物中毒,3
g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
如何区别食盐(NaCl)和工业用盐亚硝酸钠(NaNO2)?
思路:利用它们性质上的不同点。
①亚硝酸钠的水溶液呈碱性,而食盐溶液为中性。可用无色酚酞溶液检验它们的酸碱性或用pH试纸测它们的pH值;
②亚硝酸钠熔点仅为摄氏211度,而食盐的熔点高达摄氏801度。可将它们分别放入烧红的铁锅内,能被熔化的是亚硝酸钠,而食盐难以熔化。
③氯化钠溶液可以与AgNO3溶液反应产生白色沉淀。可以溶于水后,分别加入少量的AgNO3溶液,若生成白色沉淀,则是氯化钠。
定义:指由金属离子(或NH4+)和酸根离子构成的化合物,如NaCl、K2SO4等。
盐?
一类物质
化学中的盐
钙盐
钠盐
镁盐
铝盐
铜盐
银盐
铵盐
氯化物
硝酸盐
硫酸盐
碳酸盐
碳酸氢盐
CaCl2
NaCl
MgCl2
AlCl3
CuCl2
AgCl
NH4Cl
Ca(NO3)2
NaNO3
Mg(NO3)2
Al(NO3)3
Cu(NO3)2
AgNO3
NH4NO3
CaSO4
Na2SO4
MgSO4
Al2(SO4)3
CuSO4
Ag2SO4
(NH4)2SO4
CaCO3
Na2CO3
MgCO3
Al2(CO3)3
Cu(CO3)2
Ag2CO3
(NH4)2CO3
NaHCO3
Ca(HCO3)2
Mg(HCO3)2
Al(HCO3)3
Cu(HCO3)2
AgHCO3
NH4HCO3
几种常见的盐
一、氯化钠
常见的盐——氯化钠
(1)
俗称:食盐;
(2)
化学式:NaCl;
(3)
性状:白色晶体,易溶于水,有咸味,溶液呈中性;
(4)
主要来源:海水、盐湖、盐井、盐矿。
1.氯化钠的用途
氯化钠是重要的调味品
氯化钠具有广泛的用途
生理盐水
工业原料
选种
融雪剂
2.氯化钠在自然界中的分布与获取
(1)分布
:
氯化钠在自然界中的分布很广,除海水里含有大量的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
(2)获取:通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到含有较多杂质的氯化钠晶体——粗盐。当有大量粗盐从海水、盐湖水等析出时,就会形成美丽的盐景。
海水“晒盐”等方法得到的是粗盐,含有可溶性和不溶性杂质。
粗盐
精盐
?
粗盐通过溶解、沉淀、过滤、蒸发、结晶等处理,可以得到初步提纯
思考:上述过程中玻璃棒的用途分别是什么?
①搅拌,加快溶解速率
②引流
③搅拌,防止因局部温度过高,造成液滴飞溅
④转移固体
二、碳酸钠、碳酸氢钠和碳酸钙
1.碳酸钠
(1)俗名:纯碱、苏打;
(2)化学式:
Na2CO3;
(3)纯碱不是碱,而是盐;
(4)性状:白色晶体,风化成粉末,易溶于水,水溶液显碱性。
碳酸钠用途
造纸
纺织印染
洗涤剂
玻璃瓷砖
2.碳酸氢钠
(1)俗名:小苏打;
(2)化学式:
NaHCO3;
(3)性状:白色粉末,能溶于水,水溶液有弱的碱性,较易分解。
碳酸氢钠用途
做中和胃酸的胃药
饮料原料
面点发酵剂
灭火剂原料
3.碳酸钙
(1)大理石、石灰石主要成分;
(2)化学式:
CaCO3;
(3)性状:多为灰白色矿物,
纯净物为白色粉末;不溶于水,
能溶于酸。
碳酸钙用途
补钙剂
珍珠首饰
建筑材料
水泥原料
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗
称
颜色状态
溶解性
用
途
NaCl
Na2CO3
NaHCO3
CaCO3
食盐
纯碱、苏打
小苏打
白色固体
白色固体
白色固体
白色固体
易溶
难溶
可溶
易溶
调味品、
生理盐水
玻璃、
造纸
发酵粉、治
疗胃酸过多
建筑材料、
补钙剂
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
溶、挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
溶
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
——
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
——
Cu2+
不
溶
溶
溶
——
Ag+
——
溶
不
微
不
阴离子
阳离子
部分酸、碱和盐的溶解性表(室温)
说明:“溶”表示那种物质可溶于水,“不”表示不溶水,“微”表示微溶于水,“挥”表示挥发性,“——”表示那种物质不存在或遇到水就分解了。
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
NH3?H2O
溶
溶
溶
(NH4)2CO3
K+
KOH
溶
溶
溶
K2CO3
Na+
NaOH
溶
溶
溶
Na2CO3
Ba2+
Ba(OH)2
溶
溶
BaSO4
不
Ca2+
Ca(OH)2
溶
溶
溶
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
——
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
——
Cu2+
不
溶
溶
溶
——
Ag+
——
溶
AgCl
微
不
阴离子
阳离子
部分酸、碱和盐的溶解性表(室温)
钾钠铵盐均可溶
硝酸盐类也相同
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
所有酸类均可溶
要问碱类溶多少,钾钠钡钙铵中找
微Ag2SO4
不Ag2CO3
溶液中发生化学反应时,生成物中的八大沉淀
①白色沉淀
②蓝色沉淀
③红褐色沉淀
?不溶于水但溶于酸且不产生气体Mg(OH)2
Al(OH)3
?不溶于水但溶于酸且产生气体:CaCO3
BaCO3
?既不溶于水也不溶于酸的:AgCl
BaSO4
Cu(OH)2
Fe(OH)3
物质的分类
物质
纯净物
混合物
化合物
单质
金属单质
非金属单质
氧化物
酸
碱
盐
第2课时
1.掌握盐的四点化学性质;
2.掌握基本反应类型“复分解反应”;
3.会判断复分解反应是否发生。
【回顾】
请书写出实验室制取CO2的方程式。
CaCO3
+
2HCl
=
CaCl2
+
H2CO3
CO2↑+H2O
即:
CaCO3+2HCl=CaCl2+H2O+CO2↑
【讨论】
根据上述反应,请问Na2CO3和NaHCO3能否与稀盐酸反应?如果能反应,请问它们又会生成什么物质?
一、盐的四点化学性质
1.与酸反应
【实验11-1】碳酸钠、碳酸氢钠分别与盐酸反应,是否都能产生CO2
?
碳酸钠+
盐酸
碳酸氢钠+盐酸
现
象
分
析
白色固体溶解(有气泡生成),澄清石灰水变浑浊
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
NaHCO3
+
HCl
=
NaCl
+
H2O
+
CO2↑
盐
+
酸
=
新盐
+
新酸
H2CO3
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
NaHCO3
+
HCl
=
NaCl
+
H2O
+
CO2↑
CO32-
Na+
Na+
Cl-
H+
H+
Cl-
Na+
HCO3-
Cl-
H+
2H+
+
CO32-
=
H2O
+
CO2↑
H+
+
HCO3-
=
H2O
+
CO2↑
碳酸盐和碳酸氢盐均能与酸反应生成CO2
Na+
Na+
Cl-
Cl-
Na+
Cl-
综上所述:含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)的盐都能与盐酸反应,产生CO2
气体。
碳酸根离子或碳酸氢根离子检验方法:
某物质
产生气体
变浑浊
CO2
(水溶液含CO32-或HCO3-)
CaCO3
+稀盐酸
+澄清石灰水
2H+
+
CO32-
=
H2O
+
CO2↑
H+
+
HCO3-
=
H2O
+
CO2↑
2.与碱溶液反应
【实验11-2】向盛有少量碳酸钠溶液
的试管中滴入澄清石灰水,观察现象。
现象
分析
试管里出现白色沉淀。
碳酸钠与氢氧化钙反应,
生成一种难溶物碳酸钙。
CO32-
Na+
Na+
OH-
OH-
Ca2+
Na2CO3
+
Ca(OH)2
=
CaCO3↓
+
2NaOH
盐
+
碱
=
新盐
+
新碱
这个原理常用作两种碱之间的相互转化
Na+
Na+
OH-
OH-
(1)CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
(2)Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
(3)NaHCO3
+
HCl
=
NaCl
+
H2O
+
CO2↑
(4)Na2CO3
+
Ca(OH)2
=
2NaOH
+
CaCO3↓
观察与思考
①观察:上述几个反应有什么特点?
②讨论:由此,你又有哪些新发现?
③归纳:复分解反应的概念、一般形式与特点。
(1)CaCO3
+
2HCl
=
CaCl2
+
H2CO3
(2)Na2CO3
+
2HCl
=
2NaCl
+
H2CO3
(3)NaHCO3
+
HCl
=
NaCl
+
H2CO3
(4)Na2CO3
+
Ca(OH)2
=
2NaOH
+
CaCO3↓
观察与思考
①观察:上述几个反应有什么特点?
②讨论:由此,你又有哪些新发现?
③归纳:复分解反应的概念、一般形式与特点。
复分解反应
1.定义:在溶液中,由两种化合物相互交换成分,生成另外两种化合物的反应。
2.特点:双交换(内内外外),价不变
3.通式:AB
+
CD
=
CB
+
AD
4.发生条件:反应物一般都要溶于水;有酸参加时,另一种物质可以是难溶于水,但必须能溶于酸。(如:大理石与稀盐酸的反应)
思考:什么条件下复分解反应才能发生呢???
根据所提供的四种溶液,设计实验证明溶液两两之间是否能发生反应。√表示反应,×表示不反应。
H2SO4
BaCl2
NaOH
Na2CO3
H2SO4
BaCl2
NaOH
Na2CO3
√
√
√
√
√
√
√
√
×
×
×
×
√
BaCl2
+
H2SO4
√
NaOH
+
H2SO4
√
Na2CO3
+
H2SO4
√
Na2CO3
+
BaCl2
×
NaOH
+
BaCl2
×
NaOH
+
Na2CO3
√
Na2CO3
+
BaCl2
=
BaCO3↓
+
2NaCl
√
BaCl2
+
H2SO4
=
BaSO4↓
+
2HCl
√
2NaOH
+
H2SO4
=
Na2SO4
+
2H2O
√
Na2CO3
+
H2SO4
=
Na2SO4
+
H2O
+
CO2↑
有白色沉淀生成
有水生成
有气体生成
有白色沉淀生成
BaCl2
+
NaOH
=
不反应
Na2CO3
+
NaOH
=
不反应
复分解反应发生的条件
①生成水;②生成气体;③生成沉淀。(满足一条即可)
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
NH3?H2O
溶
溶
溶
(NH4)2CO3
K+
KOH
溶
溶
溶
K2CO3
Na+
NaOH
溶
溶
溶
Na2CO3
Ba2+
Ba(OH)2
溶
溶
BaSO4
不
Ca2+
Ca(OH)2
溶
溶
溶
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
——
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
——
Cu2+
不
溶
溶
溶
——
Ag+
——
溶
AgCl
微
不
阴离子
阳离子
部分酸、碱和盐的溶解性表(室温)
钾钠铵
钾钠钡钙铵
钾钠铵盐均可溶
硝酸盐类也相同
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
所有酸类均可溶
要问碱类溶多少,钾钠钡钙铵中找
溶液中发生化学反应时,生成物中的八大沉淀
①白色沉淀
②蓝色沉淀
③红褐色沉淀
?不溶于水但溶于酸且不产生气体Mg(OH)2
Al(OH)3
?不溶于水但溶于酸且产生气体:CaCO3
BaCO3
?既不溶于水也不溶于酸的:AgCl
BaSO4
Cu(OH)2
Fe(OH)3
?复分解反应发生时的离子变化
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
Na2SO4
+
2KNO3
=
K2SO4
+
2NaNO3
CO32-
Na+
Na+
Cl-
H+
H+
Cl-
Na+
Na+
Cl-
Cl-
SO42-
Na+
Na+
NO3-
K+
K+
NO3-
SO42-
Na+
Na+
NO3-
K+
K+
NO3-
溶液中离子种类发生改变
溶液中离子种类没发生改变
复分解反应的实质:溶液中离子种类发生改变
练一练
判断下列复分解反应能否发生:
H2SO4
+
NaNO3
Na2SO4
+
BaCl2
2HNO3
+
K2CO3
KNO3
+
NaOH
不能
不能
=
BaSO4↓
+
2NaCl
=
2KNO3
+
H2O
+
CO2↑
=
Na2SO4+
HNO3
=
NaNO3
+
KOH
我们已经学过,盐能与金属发生置换反应,如:
Fe
+
CuSO4
=
Cu
+
FeSO4
今天学到了,盐能与酸发生复分解反应,如:
Na2CO3
+
2HCl
=
2NaCl
+
CO2↑
+H2O
盐能与碱发生复分解反应,如:
Na2CO3
+
Ca(OH)2
=
CaCO3↓
+
2NaOH
盐还能与盐发生复分解反应,如:
Na2SO4
+
BaCl2
=
BaSO4↓
+
2NaCl
湿法炼铜
小结
1.盐溶液的酸碱性不确定。(如NaCl溶液呈中性,Na2CO3溶液呈碱性,NH4Cl溶液呈酸性)
2.盐的四点化学性质
盐
+
金属
=
新盐
+
新金属
盐
+
酸
=
新盐
+
新酸
盐
+
碱
=
新盐
+
新碱
盐1
+
盐2
=
新盐1
+
新盐2
Fe
+
CuSO4
=
Cu
+
FeSO4
CaCO3
+
2HCl
=
CaCl2
+
H2O
+CO2↑
Na2CO3
+
Ca(OH)2
=
CaCO3↓+
2NaOH
AgNO3
+
NaCl
=
AgCl↓
+
NaNO3
3.复分解反应发生的条件
①生成水;②生成气体;③生成沉淀。(满足一条即可)
总结
酸的五点化学性质
?酸
+
指示剂
?酸
+
金属氧化物
=
盐
+
水
?酸
+
碱
=
盐
+
水
?酸
+
盐
=
新盐
+新酸
+紫色石蕊溶液
+无色酚酞溶液
无明显现象
?酸
+
金属
=
盐
+
氢气
2H2SO4
+
Zn
=
ZnSO4
+
2H2↑
置换反应
2HCl
+
CuO
=
CuCl2
+
H2O
复分解反应
HCl
+
NaOH
=
NaCl
+
H2O
复分解反应
2HCl
+
CaCO3
=
CaCl2
+
H2O
+CO2↑
复分解反应
紫色石蕊溶液变红
总结
碱的四点化学性质
?碱
+
指示剂
?碱
+
非金属氧化物
=
盐
+
水
?碱
+
盐
=
新碱
+
新盐
+紫色石蕊溶液
紫色石蕊溶液变蓝
+无色酚酞溶液
无色酚酞溶液变红
?碱
+
酸
=
盐
+水
Ba(OH)2
+
Na2CO3
=
2NaOH
+
BaCO3↓
Ca(OH)2
+
CO2
=
CaCO3↓
+
H2O
无
NaOH
+
HCl
=
NaCl
+
H2O
复分解反应
复分解反应
总结
盐的四点化学性质
?盐
+
金属
=
新盐
+
新金属
?盐
+
碱
=
新盐
+
新碱
?盐1
+
盐2
=
新盐1
+
新盐2
?盐
+
酸
=
新盐
+
新酸
复分解反应
复分解反应
CuSO4
+
Fe
=
FeSO4
+
Cu
置换反应
CaCO3
+
2HCl
=
CaCl2
+
H2O
+CO2↑
复分解反应
Na2CO3
+
Ca(OH)2
=
CaCO3↓+
2NaOH
AgNO3
+
NaCl
=
AgCl↓
+
NaNO3
酸五、碱四、盐四
简记
第十一单元
盐的序章
实验11-3
向两只分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表
CuSO4溶液+NaOH
CuSO4溶液+BaCl2溶液
现
象
化学方程式
有蓝色沉淀生成
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
有白色沉淀生成
CuSO4+BaCl2=BaSO4↓+CuCl2
资料卡片
石笋和钟乳石的形成
如果你参加过溶洞,一定会为溶洞中形态各异的石笋和钟乳石而惊叹。在赞叹大自然的鬼斧神工之余,你是否会想:这些石笋和钟乳石而惊叹。在赞叹大自然的鬼斧神工之余,你是否会想:这些石笋和钟乳石是怎样形成的?
溶洞都分布在石灰岩组成的山洞中,石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:
CaCO3
+
CO2
+
H2O
=
Ca(HCO3)2
溶有碳酸氢钙的水遇热或当压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来,同时放出二氧化碳
Ca(HCO3)2
=
CaCO3↓+
CO2↑+
H2O
洞顶的水在慢慢向下渗透时,水中的碳酸氢钙发生上述反应,有的沉积在洞顶,有的沉积在洞底。日久天长洞顶的形成钟乳石,洞底的形成石笋,当钟乳石与石笋相连时就形成了石柱。
类似的还有小苏打的受热分解
2NaHCO3
=
Na2CO3
+
H2O
+
CO2↑
再见?
第十一单元
课题一
生活中常见的盐
作者:
第1课时
1.认识几种常见的盐;
2.掌握常见盐的物理性质和主要用途。
食盐
原从水中来,
不敢水中行。
人人都要我,
无我食不成。
打一物质
新闻事件
农户误用某工业盐造成8人食物中毒
厨师放错盐工人进医院石家庄37人中毒
亚硝酸钠
NaNO2
亚硝酸钠
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5
g即可引起食物中毒,3
g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
如何区别食盐(NaCl)和工业用盐亚硝酸钠(NaNO2)?
思路:利用它们性质上的不同点。
①亚硝酸钠的水溶液呈碱性,而食盐溶液为中性。可用无色酚酞溶液检验它们的酸碱性或用pH试纸测它们的pH值;
②亚硝酸钠熔点仅为摄氏211度,而食盐的熔点高达摄氏801度。可将它们分别放入烧红的铁锅内,能被熔化的是亚硝酸钠,而食盐难以熔化。
③氯化钠溶液可以与AgNO3溶液反应产生白色沉淀。可以溶于水后,分别加入少量的AgNO3溶液,若生成白色沉淀,则是氯化钠。
定义:指由金属离子(或NH4+)和酸根离子构成的化合物,如NaCl、K2SO4等。
盐?
一类物质
化学中的盐
钙盐
钠盐
镁盐
铝盐
铜盐
银盐
铵盐
氯化物
硝酸盐
硫酸盐
碳酸盐
碳酸氢盐
CaCl2
NaCl
MgCl2
AlCl3
CuCl2
AgCl
NH4Cl
Ca(NO3)2
NaNO3
Mg(NO3)2
Al(NO3)3
Cu(NO3)2
AgNO3
NH4NO3
CaSO4
Na2SO4
MgSO4
Al2(SO4)3
CuSO4
Ag2SO4
(NH4)2SO4
CaCO3
Na2CO3
MgCO3
Al2(CO3)3
Cu(CO3)2
Ag2CO3
(NH4)2CO3
NaHCO3
Ca(HCO3)2
Mg(HCO3)2
Al(HCO3)3
Cu(HCO3)2
AgHCO3
NH4HCO3
几种常见的盐
一、氯化钠
常见的盐——氯化钠
(1)
俗称:食盐;
(2)
化学式:NaCl;
(3)
性状:白色晶体,易溶于水,有咸味,溶液呈中性;
(4)
主要来源:海水、盐湖、盐井、盐矿。
1.氯化钠的用途
氯化钠是重要的调味品
氯化钠具有广泛的用途
生理盐水
工业原料
选种
融雪剂
2.氯化钠在自然界中的分布与获取
(1)分布
:
氯化钠在自然界中的分布很广,除海水里含有大量的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
(2)获取:通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到含有较多杂质的氯化钠晶体——粗盐。当有大量粗盐从海水、盐湖水等析出时,就会形成美丽的盐景。
海水“晒盐”等方法得到的是粗盐,含有可溶性和不溶性杂质。
粗盐
精盐
?
粗盐通过溶解、沉淀、过滤、蒸发、结晶等处理,可以得到初步提纯
思考:上述过程中玻璃棒的用途分别是什么?
①搅拌,加快溶解速率
②引流
③搅拌,防止因局部温度过高,造成液滴飞溅
④转移固体
二、碳酸钠、碳酸氢钠和碳酸钙
1.碳酸钠
(1)俗名:纯碱、苏打;
(2)化学式:
Na2CO3;
(3)纯碱不是碱,而是盐;
(4)性状:白色晶体,风化成粉末,易溶于水,水溶液显碱性。
碳酸钠用途
造纸
纺织印染
洗涤剂
玻璃瓷砖
2.碳酸氢钠
(1)俗名:小苏打;
(2)化学式:
NaHCO3;
(3)性状:白色粉末,能溶于水,水溶液有弱的碱性,较易分解。
碳酸氢钠用途
做中和胃酸的胃药
饮料原料
面点发酵剂
灭火剂原料
3.碳酸钙
(1)大理石、石灰石主要成分;
(2)化学式:
CaCO3;
(3)性状:多为灰白色矿物,
纯净物为白色粉末;不溶于水,
能溶于酸。
碳酸钙用途
补钙剂
珍珠首饰
建筑材料
水泥原料
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗
称
颜色状态
溶解性
用
途
NaCl
Na2CO3
NaHCO3
CaCO3
食盐
纯碱、苏打
小苏打
白色固体
白色固体
白色固体
白色固体
易溶
难溶
可溶
易溶
调味品、
生理盐水
玻璃、
造纸
发酵粉、治
疗胃酸过多
建筑材料、
补钙剂
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
溶、挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
溶
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
——
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
——
Cu2+
不
溶
溶
溶
——
Ag+
——
溶
不
微
不
阴离子
阳离子
部分酸、碱和盐的溶解性表(室温)
说明:“溶”表示那种物质可溶于水,“不”表示不溶水,“微”表示微溶于水,“挥”表示挥发性,“——”表示那种物质不存在或遇到水就分解了。
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
NH3?H2O
溶
溶
溶
(NH4)2CO3
K+
KOH
溶
溶
溶
K2CO3
Na+
NaOH
溶
溶
溶
Na2CO3
Ba2+
Ba(OH)2
溶
溶
BaSO4
不
Ca2+
Ca(OH)2
溶
溶
溶
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
——
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
——
Cu2+
不
溶
溶
溶
——
Ag+
——
溶
AgCl
微
不
阴离子
阳离子
部分酸、碱和盐的溶解性表(室温)
钾钠铵盐均可溶
硝酸盐类也相同
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
所有酸类均可溶
要问碱类溶多少,钾钠钡钙铵中找
微Ag2SO4
不Ag2CO3
溶液中发生化学反应时,生成物中的八大沉淀
①白色沉淀
②蓝色沉淀
③红褐色沉淀
?不溶于水但溶于酸且不产生气体Mg(OH)2
Al(OH)3
?不溶于水但溶于酸且产生气体:CaCO3
BaCO3
?既不溶于水也不溶于酸的:AgCl
BaSO4
Cu(OH)2
Fe(OH)3
物质的分类
物质
纯净物
混合物
化合物
单质
金属单质
非金属单质
氧化物
酸
碱
盐
第2课时
1.掌握盐的四点化学性质;
2.掌握基本反应类型“复分解反应”;
3.会判断复分解反应是否发生。
【回顾】
请书写出实验室制取CO2的方程式。
CaCO3
+
2HCl
=
CaCl2
+
H2CO3
CO2↑+H2O
即:
CaCO3+2HCl=CaCl2+H2O+CO2↑
【讨论】
根据上述反应,请问Na2CO3和NaHCO3能否与稀盐酸反应?如果能反应,请问它们又会生成什么物质?
一、盐的四点化学性质
1.与酸反应
【实验11-1】碳酸钠、碳酸氢钠分别与盐酸反应,是否都能产生CO2
?
碳酸钠+
盐酸
碳酸氢钠+盐酸
现
象
分
析
白色固体溶解(有气泡生成),澄清石灰水变浑浊
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
NaHCO3
+
HCl
=
NaCl
+
H2O
+
CO2↑
盐
+
酸
=
新盐
+
新酸
H2CO3
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
NaHCO3
+
HCl
=
NaCl
+
H2O
+
CO2↑
CO32-
Na+
Na+
Cl-
H+
H+
Cl-
Na+
HCO3-
Cl-
H+
2H+
+
CO32-
=
H2O
+
CO2↑
H+
+
HCO3-
=
H2O
+
CO2↑
碳酸盐和碳酸氢盐均能与酸反应生成CO2
Na+
Na+
Cl-
Cl-
Na+
Cl-
综上所述:含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)的盐都能与盐酸反应,产生CO2
气体。
碳酸根离子或碳酸氢根离子检验方法:
某物质
产生气体
变浑浊
CO2
(水溶液含CO32-或HCO3-)
CaCO3
+稀盐酸
+澄清石灰水
2H+
+
CO32-
=
H2O
+
CO2↑
H+
+
HCO3-
=
H2O
+
CO2↑
2.与碱溶液反应
【实验11-2】向盛有少量碳酸钠溶液
的试管中滴入澄清石灰水,观察现象。
现象
分析
试管里出现白色沉淀。
碳酸钠与氢氧化钙反应,
生成一种难溶物碳酸钙。
CO32-
Na+
Na+
OH-
OH-
Ca2+
Na2CO3
+
Ca(OH)2
=
CaCO3↓
+
2NaOH
盐
+
碱
=
新盐
+
新碱
这个原理常用作两种碱之间的相互转化
Na+
Na+
OH-
OH-
(1)CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
(2)Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
(3)NaHCO3
+
HCl
=
NaCl
+
H2O
+
CO2↑
(4)Na2CO3
+
Ca(OH)2
=
2NaOH
+
CaCO3↓
观察与思考
①观察:上述几个反应有什么特点?
②讨论:由此,你又有哪些新发现?
③归纳:复分解反应的概念、一般形式与特点。
(1)CaCO3
+
2HCl
=
CaCl2
+
H2CO3
(2)Na2CO3
+
2HCl
=
2NaCl
+
H2CO3
(3)NaHCO3
+
HCl
=
NaCl
+
H2CO3
(4)Na2CO3
+
Ca(OH)2
=
2NaOH
+
CaCO3↓
观察与思考
①观察:上述几个反应有什么特点?
②讨论:由此,你又有哪些新发现?
③归纳:复分解反应的概念、一般形式与特点。
复分解反应
1.定义:在溶液中,由两种化合物相互交换成分,生成另外两种化合物的反应。
2.特点:双交换(内内外外),价不变
3.通式:AB
+
CD
=
CB
+
AD
4.发生条件:反应物一般都要溶于水;有酸参加时,另一种物质可以是难溶于水,但必须能溶于酸。(如:大理石与稀盐酸的反应)
思考:什么条件下复分解反应才能发生呢???
根据所提供的四种溶液,设计实验证明溶液两两之间是否能发生反应。√表示反应,×表示不反应。
H2SO4
BaCl2
NaOH
Na2CO3
H2SO4
BaCl2
NaOH
Na2CO3
√
√
√
√
√
√
√
√
×
×
×
×
√
BaCl2
+
H2SO4
√
NaOH
+
H2SO4
√
Na2CO3
+
H2SO4
√
Na2CO3
+
BaCl2
×
NaOH
+
BaCl2
×
NaOH
+
Na2CO3
√
Na2CO3
+
BaCl2
=
BaCO3↓
+
2NaCl
√
BaCl2
+
H2SO4
=
BaSO4↓
+
2HCl
√
2NaOH
+
H2SO4
=
Na2SO4
+
2H2O
√
Na2CO3
+
H2SO4
=
Na2SO4
+
H2O
+
CO2↑
有白色沉淀生成
有水生成
有气体生成
有白色沉淀生成
BaCl2
+
NaOH
=
不反应
Na2CO3
+
NaOH
=
不反应
复分解反应发生的条件
①生成水;②生成气体;③生成沉淀。(满足一条即可)
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
NH3?H2O
溶
溶
溶
(NH4)2CO3
K+
KOH
溶
溶
溶
K2CO3
Na+
NaOH
溶
溶
溶
Na2CO3
Ba2+
Ba(OH)2
溶
溶
BaSO4
不
Ca2+
Ca(OH)2
溶
溶
溶
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
——
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
——
Cu2+
不
溶
溶
溶
——
Ag+
——
溶
AgCl
微
不
阴离子
阳离子
部分酸、碱和盐的溶解性表(室温)
钾钠铵
钾钠钡钙铵
钾钠铵盐均可溶
硝酸盐类也相同
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
所有酸类均可溶
要问碱类溶多少,钾钠钡钙铵中找
溶液中发生化学反应时,生成物中的八大沉淀
①白色沉淀
②蓝色沉淀
③红褐色沉淀
?不溶于水但溶于酸且不产生气体Mg(OH)2
Al(OH)3
?不溶于水但溶于酸且产生气体:CaCO3
BaCO3
?既不溶于水也不溶于酸的:AgCl
BaSO4
Cu(OH)2
Fe(OH)3
?复分解反应发生时的离子变化
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
Na2SO4
+
2KNO3
=
K2SO4
+
2NaNO3
CO32-
Na+
Na+
Cl-
H+
H+
Cl-
Na+
Na+
Cl-
Cl-
SO42-
Na+
Na+
NO3-
K+
K+
NO3-
SO42-
Na+
Na+
NO3-
K+
K+
NO3-
溶液中离子种类发生改变
溶液中离子种类没发生改变
复分解反应的实质:溶液中离子种类发生改变
练一练
判断下列复分解反应能否发生:
H2SO4
+
NaNO3
Na2SO4
+
BaCl2
2HNO3
+
K2CO3
KNO3
+
NaOH
不能
不能
=
BaSO4↓
+
2NaCl
=
2KNO3
+
H2O
+
CO2↑
=
Na2SO4+
HNO3
=
NaNO3
+
KOH
我们已经学过,盐能与金属发生置换反应,如:
Fe
+
CuSO4
=
Cu
+
FeSO4
今天学到了,盐能与酸发生复分解反应,如:
Na2CO3
+
2HCl
=
2NaCl
+
CO2↑
+H2O
盐能与碱发生复分解反应,如:
Na2CO3
+
Ca(OH)2
=
CaCO3↓
+
2NaOH
盐还能与盐发生复分解反应,如:
Na2SO4
+
BaCl2
=
BaSO4↓
+
2NaCl
湿法炼铜
小结
1.盐溶液的酸碱性不确定。(如NaCl溶液呈中性,Na2CO3溶液呈碱性,NH4Cl溶液呈酸性)
2.盐的四点化学性质
盐
+
金属
=
新盐
+
新金属
盐
+
酸
=
新盐
+
新酸
盐
+
碱
=
新盐
+
新碱
盐1
+
盐2
=
新盐1
+
新盐2
Fe
+
CuSO4
=
Cu
+
FeSO4
CaCO3
+
2HCl
=
CaCl2
+
H2O
+CO2↑
Na2CO3
+
Ca(OH)2
=
CaCO3↓+
2NaOH
AgNO3
+
NaCl
=
AgCl↓
+
NaNO3
3.复分解反应发生的条件
①生成水;②生成气体;③生成沉淀。(满足一条即可)
总结
酸的五点化学性质
?酸
+
指示剂
?酸
+
金属氧化物
=
盐
+
水
?酸
+
碱
=
盐
+
水
?酸
+
盐
=
新盐
+新酸
+紫色石蕊溶液
+无色酚酞溶液
无明显现象
?酸
+
金属
=
盐
+
氢气
2H2SO4
+
Zn
=
ZnSO4
+
2H2↑
置换反应
2HCl
+
CuO
=
CuCl2
+
H2O
复分解反应
HCl
+
NaOH
=
NaCl
+
H2O
复分解反应
2HCl
+
CaCO3
=
CaCl2
+
H2O
+CO2↑
复分解反应
紫色石蕊溶液变红
总结
碱的四点化学性质
?碱
+
指示剂
?碱
+
非金属氧化物
=
盐
+
水
?碱
+
盐
=
新碱
+
新盐
+紫色石蕊溶液
紫色石蕊溶液变蓝
+无色酚酞溶液
无色酚酞溶液变红
?碱
+
酸
=
盐
+水
Ba(OH)2
+
Na2CO3
=
2NaOH
+
BaCO3↓
Ca(OH)2
+
CO2
=
CaCO3↓
+
H2O
无
NaOH
+
HCl
=
NaCl
+
H2O
复分解反应
复分解反应
总结
盐的四点化学性质
?盐
+
金属
=
新盐
+
新金属
?盐
+
碱
=
新盐
+
新碱
?盐1
+
盐2
=
新盐1
+
新盐2
?盐
+
酸
=
新盐
+
新酸
复分解反应
复分解反应
CuSO4
+
Fe
=
FeSO4
+
Cu
置换反应
CaCO3
+
2HCl
=
CaCl2
+
H2O
+CO2↑
复分解反应
Na2CO3
+
Ca(OH)2
=
CaCO3↓+
2NaOH
AgNO3
+
NaCl
=
AgCl↓
+
NaNO3
酸五、碱四、盐四
简记
第十一单元
盐的序章
实验11-3
向两只分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表
CuSO4溶液+NaOH
CuSO4溶液+BaCl2溶液
现
象
化学方程式
有蓝色沉淀生成
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
有白色沉淀生成
CuSO4+BaCl2=BaSO4↓+CuCl2
资料卡片
石笋和钟乳石的形成
如果你参加过溶洞,一定会为溶洞中形态各异的石笋和钟乳石而惊叹。在赞叹大自然的鬼斧神工之余,你是否会想:这些石笋和钟乳石而惊叹。在赞叹大自然的鬼斧神工之余,你是否会想:这些石笋和钟乳石是怎样形成的?
溶洞都分布在石灰岩组成的山洞中,石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:
CaCO3
+
CO2
+
H2O
=
Ca(HCO3)2
溶有碳酸氢钙的水遇热或当压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来,同时放出二氧化碳
Ca(HCO3)2
=
CaCO3↓+
CO2↑+
H2O
洞顶的水在慢慢向下渗透时,水中的碳酸氢钙发生上述反应,有的沉积在洞顶,有的沉积在洞底。日久天长洞顶的形成钟乳石,洞底的形成石笋,当钟乳石与石笋相连时就形成了石柱。
类似的还有小苏打的受热分解
2NaHCO3
=
Na2CO3
+
H2O
+
CO2↑
再见?
同课章节目录
