重庆第八高级中学校2020-2021学年高一下学期期末考试化学试题 Word版含答案
文档属性
| 名称 | 重庆第八高级中学校2020-2021学年高一下学期期末考试化学试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 263.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-03 07:37:02 | ||
图片预览




文档简介
重庆八中2020—2021学年度(下)期末考试高一年级
化 学 试 题
注意事项:
1.本试题共8页,总分100分,考试时间75分钟。
2.请考生将答案写在答题卡上,写在本试卷上无效,选择题使用2B铅笔填涂,非选择题使用0.5 mm黑色签字笔书写。
可能用到的相对原子质量:H-1 C-12 O-16 F-19 K-39 Cu-64 Ag-108 I-127
第I卷(共42分)
一、选择题(本大题共14个小题,每题3分。在每小题给出的四个选项中,只有一项是符合题目要求的,共42分)
下列属于强电解质的是
A. 硫酸钡 B. 食盐水 C. 二氧化硅 D. 醋酸
运用相关化学知识进行判断,下列结论正确的是
A.燃烧热的都为负值
B.需要加热的反应都是吸热反应
C.有能量变化的过程一定是化学变化
D.中和热测定实验中,可以用铜棒代替环形玻璃搅拌棒
下列说法正确的是
A. 银质奖牌久置以后表面变暗是发生了电化学腐蚀
B. 用石墨电极电解饱和食盐水的过程中,溶液pH逐渐增大
C. 粗铜提纯工艺中,电解质溶液中铜离子浓度保持不变
D. 钢铁发生电化学腐蚀的正极反应为:
已知反应X(g) + 2Y(g)XY2(g) ΔH>0,下列说法错误的是
A.充入X(g),平衡正向移动,X的转化率降低
B.减小容器体积,正反应与逆反应速率均增大,平衡正移
C.加入正催化剂,反应活化能降低,正反应与逆反应速率均增大
D.升高温度,正反应速率加快,逆反应速率减缓,平衡正向移动
下列离子方程式书写错误的是
A. 实验室制备氨气:
B. 向稀硝酸中加入铜片:
C. 向氯化铁溶液通入SO2:
D. 向氢氧化钡溶液中加入硫酸铵:
对下列现象或事实的解释正确的是
选项
实验现象或化学事实
解释
A
将某气体通入品红溶液中褪色
该气体一定是SO2
B
蔗糖中加入浓硫酸,蔗糖逐渐变黑并有刺激性气味的气体产生
浓硫酸具有脱水性和氧化性
C
SiO2既能与HF溶液反应又能与NaOH溶液反应
SiO2属于两性氧化物
D
加热装有NH4Cl固体的试管,试管底部固体消失,试管口有晶体
NH4Cl固体易升华
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) 800 kJ/mol,部分键能数据如表所示:
键
C=O
C-H
O-H
O=O
键能(kJ/mol)
739
413
463
a
则a的值为
A. 439 B. 429 C. 1239 D. 345.5
3765550158115某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图。下列说法错误的是
A.向负极移动
B.a为CH4,b为O2
C.此电池在常温下不能工作
D.负极电极反应:CH48e-+4=5CO2+2H2O
在恒温恒容的条件下,加入等物质的量的A和B发生A(g) + B(g)2C(g) + D(s)反应,下列说法能作为该反应达到平衡状态的标志的是
①单位时间内消耗a mol A,同时生成2a mol C
②混合气体的密度不再变化
③A、B、C的浓度不再变化
④混合气体的总压强不再变化
①④ B.②③ C.①③ D.②④
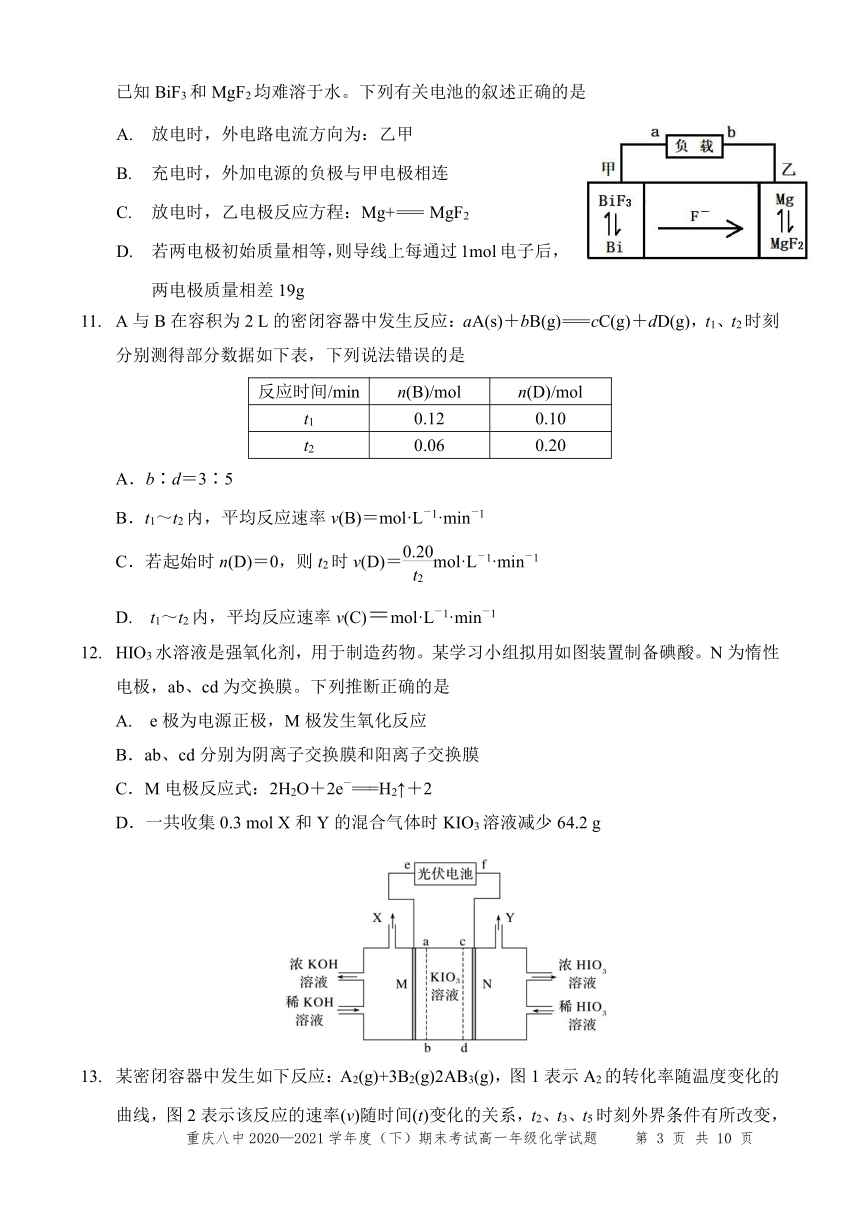
氟离子电池提供了一种前景广阔的新型电池化学物质,如图是氟离子电池工作示意图,已知BiF3和MgF2均难溶于水。下列有关电池的叙述正确的是
377444065405放电时,外电路电流方向为:乙甲
充电时,外加电源的负极与甲电极相连
放电时,乙电极反应方程:Mg+= MgF2
若两电极初始质量相等,则导线上每通过1mol电子后,两电极质量相差19g
A与B在容积为2 L的密闭容器中发生反应:aA(s)+bB(g)=cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表,下列说法错误的是
反应时间/min
n(B)/mol
n(D)/mol
t1
0.12
0.10
t2
0.06
0.20
A.b∶d=3∶5
B.t1~t2内,平均反应速率v(B)=mol·L-1·min-1
C.若起始时n(D)=0,则t2时v(D)=mol·L-1·min-1
D. t1~t2内,平均反应速率v(C)=mol·L-1·min-1
HIO3水溶液是强氧化剂,用于制造药物。某学习小组拟用如图装置制备碘酸。N为惰性电极,ab、cd为交换膜。下列推断正确的是
e极为电源正极,M极发生氧化反应
B.ab、cd分别为阴离子交换膜和阳离子交换膜
C.M电极反应式:2H2O+2e-===H2↑+2
D.一共收集0.3 mol X和Y的混合气体时KIO3溶液减少64.2 g
154940079375
某密闭容器中发生如下反应:A2(g)+3B2(g)2AB3(g),图1表示A2的转化率随温度变化的曲线,图2表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法正确的是
A.该反应的>0
B.反应开始后AB3的百分含量最低的时间是t6
C.t1?t2、t2?t3、t4?t5以及t>t6时间段均达到化学平衡,且平衡常数相等
D.t2、t3、t5时刻改变的条件依次是加入催化剂、减小压强、增大AB3的浓度
温度T时,在四个容积均1 L的恒容密闭容器中仅发生反应:2NO(g)+O2 (g)2NO2(g) ?H<0。实验测得: v正=k正c2 (NO)c(O2 ),v逆=k逆c2(NO2),k正、k逆为速率常数,仅受温度影响。
容器编号
物质的起始物质的量(mol)
平衡物质的量(mol)
c(NO )
c(O2 )
c(NO2 )
c(NO2 )
I
0.8
0.4
0
0.6
II
0.4
0.3
0.4
a
III
0
0
0.6
IV
0.2
0.2
0.2
下列说法错误的是
a0.6
B.平衡时,容器Ⅲ中 NO2的体积分数小于66.7%
C.K=90
D.?开始时,容器IV中v正v逆
第Ⅱ卷(共58分)
二、解答题(本大题共5个小题,共58分)
(12分)物质类别与元素化合价是研究物质性质的两个视角,下列是硫元素及其化合物的“价类二维图”。
根据要求回答下列问题:
写出图中A的化学式 。
SO2属于______(填“酸性”或“碱性”)氧化物,因此可与CaO、 (写出与CaO不同类别的一个具体物质)等反应。请写出CaO除去燃煤产生的SO2的化学方程式
(两个方程式)。
重庆八中小王同学预测SO2具有还原性,其理论依据是 ,将SO2通入酸性高锰酸钾溶液中,下列实验事实能够证实SO2具有还原性的是 (填序号)。
①反应后溶液由紫色变为无色
②取反应后的溶液少许,加入BaCl2溶液,产生白色沉淀
③取反应后的溶液少许,加入Ba(NO3)2溶液,产生白色沉淀。
硝酸是一种具有强氧化性、腐蚀性的强酸。已知25.6g Cu与过量的300 mL、6 mol/L硝酸充分反应,反应结束后,除了产生Cu(NO3)2以外,还产生了NO与NO2两种气体共13.44 L(标况下测定),请计算(忽略反应前后溶液体积的变化):
反应产生的混合气体中,产生NO气体的体积为______L(标准状况下测定)。
反应后,的物质的量浓度为______mol/L。
(12分)CO用途广泛,工业应用时离不开平衡思想的指导:
在某一容积为5 L的体积不变的密闭容器内,加入0.4 mol CO和0.4 molH2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如下表:
t/min
0
5
10
15
20
c(CO2)/(mol/L)
0
0.02
0.035
0.04
0.04
根据表上数据,该温度(800 ℃)下的平衡常数K=______________。
改变下列条件能增大化学反应速率同时提高CO的平衡转化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.加入水蒸气
若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.4 mol CO(g)和0.4molH2O(g),重新达到平衡后,CO的转化率________(填“升高”“降低”或“不变”)。
在催化剂存在和800 ℃的条件下,在某一时刻测得CO、H2O、CO2、H2的浓度分别为0.03、0.03、0.05、0.05,则此时正、逆反应速率的大小:v正 v逆(填“>”“<”或“=”)。
还原法炼铅,包含反应PbO(s)+CO(g)===Pb(s)+CO2(g) ΔH<0
当K=9,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为 ;若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的物质的量分数 (填“增大”“减小”或“不变”)。
(12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中 X 为阳离子交换膜。请按要求回答相关问题:
乙池中铁电极作 极,甲池中甲烷燃料电池中负极的电极反应式为 。
在标况下,若消耗4.48L氧气,则乙装置中石墨电极上生成的气体体积 L,乙池中的阳离子交换膜 (“能”或“不能”)换成阴离子交换膜,原因是 。
若丙中以稀 H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为 。
若丙中为CuSO4电解质溶液,a、b为惰性电极,当消耗2.24LCH4(标况下),丙中a电极析出12.8g的铜单质,则整个回路中转移的电子数目为 ,需加入复原 (填序号)。
A. 16gCuO B.19.6gCu(OH)2 C.24.8gCuCO3 D.22.2g Cu2(OH)2CO3
(10分)电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法。
某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下:
电解质溶液中H+离子向 (填“A极”或“B极”)移动。
请写出负极电极反应式____________________________________________________。
用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生4.48 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为 ,析出银的物质的量 。
该兴趣小组又以NO为原料,采用电化学方法制取NH4NO3溶液,装置如下:
阳极与阴极消耗NO物质的量之比为 ,物质A可为 。
(12分)用CO2和H2在一定条件下可转化生成甲醇蒸气和水蒸气:
CO2(g)+3H2(g)CH3OH(g)+H2O(g);ΔH=-akJ/mol
已知:① 3CO(g)+3H2(g)CH3OCH3(g) +CO2(g) ΔH=-247 kJ/mol
② 2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH=-24 kJ/mol
③ CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41 kJ/mol
则a=__________。
CO2在不同温度下的平衡转化率与压强的关系如下图所示。请写出T1、T2、T3三者的大小关系 ,实际生产条件控制在T1、1.3×104kPa左右,选择此压强的理由是 。
31527757937570485062230
【第(3)问图】
【第(2)问图】
一定条件下,在相同体积的恒容密闭容器中充入1.0 molCO2和3.0 molH2,相同时间段内测得CO2的转化率随温度变化如上图所示:b点v正________v逆(填“>”“<”或“=”);温度高于T4,CO2的转化率降低的原因是 。已知容器内的起始压强为200kPa,则图中d点对应温度下反应的平衡常数Kp=
(kPa)-2(结果保留两位有效数字)(KP为以分压表示的平衡常数, 分压=总压×物质的量分数)
用惰性电极电解强酸性的二氧化碳水溶液可得到甲醇,其原理如下图所示。
①b电极上的电极反应式为_________________________;
②该装置中使用的是_________________(填“阳”或“阴”)离子交换膜。
重庆八中2020—2021学年度(下)期末考试高一年级
化学参考答案
一、选择题
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A
A
B
D
C
B
A
B
B
C
C
C
B
D
二、简答题
(12分)
H2SO4(1分)
酸性(1分) NaOH(化学式也可)其他合理给分(1分)
(每个方程1分)
SO2中硫+4,化合价可以升高,故具有还原性。(合理叙述给分) (1分) ①②(2分)
2.24(2分) (5) 4(2分)
(12分,每空2分)
1 (2) AF (3) 不变 (4) < (5) 90% 不变
(12分)
阴(1分) CH48+10=+7H2O (2分)
8.96(1分) 不能(1分) 乙池中铁电极产生的向右移动,与石墨电极产生的氯气发生反应(1分)
2Al6+3H2O=Al2O3+6(2分) (4) 0.8NA (2分) B (2分)
(10分)
B极(1分) (2) SO22+2H2O=+4(2分)
0.2mol/L (2分) 0.4mol(1分) (4) 5:3(2分) 氨气或氨水(化学式也可)(2分)
(12分)
100 (2分)
T1<T2<T3或者T3>T2>T1(1分) 在此压强下CO2的平衡转化率较大,再增加压强对设备要求高,增大生产成本(1分)
>(1分) 已达到平衡,该反应是放热反应,升高温度向逆向移动,故CO2的转化率下降(2分) 0.0059或5.9×10-3(2分)
CO26+6=CH3OH+H2O(2分) 阳(1分)
化 学 试 题
注意事项:
1.本试题共8页,总分100分,考试时间75分钟。
2.请考生将答案写在答题卡上,写在本试卷上无效,选择题使用2B铅笔填涂,非选择题使用0.5 mm黑色签字笔书写。
可能用到的相对原子质量:H-1 C-12 O-16 F-19 K-39 Cu-64 Ag-108 I-127
第I卷(共42分)
一、选择题(本大题共14个小题,每题3分。在每小题给出的四个选项中,只有一项是符合题目要求的,共42分)
下列属于强电解质的是
A. 硫酸钡 B. 食盐水 C. 二氧化硅 D. 醋酸
运用相关化学知识进行判断,下列结论正确的是
A.燃烧热的都为负值
B.需要加热的反应都是吸热反应
C.有能量变化的过程一定是化学变化
D.中和热测定实验中,可以用铜棒代替环形玻璃搅拌棒
下列说法正确的是
A. 银质奖牌久置以后表面变暗是发生了电化学腐蚀
B. 用石墨电极电解饱和食盐水的过程中,溶液pH逐渐增大
C. 粗铜提纯工艺中,电解质溶液中铜离子浓度保持不变
D. 钢铁发生电化学腐蚀的正极反应为:
已知反应X(g) + 2Y(g)XY2(g) ΔH>0,下列说法错误的是
A.充入X(g),平衡正向移动,X的转化率降低
B.减小容器体积,正反应与逆反应速率均增大,平衡正移
C.加入正催化剂,反应活化能降低,正反应与逆反应速率均增大
D.升高温度,正反应速率加快,逆反应速率减缓,平衡正向移动
下列离子方程式书写错误的是
A. 实验室制备氨气:
B. 向稀硝酸中加入铜片:
C. 向氯化铁溶液通入SO2:
D. 向氢氧化钡溶液中加入硫酸铵:
对下列现象或事实的解释正确的是
选项
实验现象或化学事实
解释
A
将某气体通入品红溶液中褪色
该气体一定是SO2
B
蔗糖中加入浓硫酸,蔗糖逐渐变黑并有刺激性气味的气体产生
浓硫酸具有脱水性和氧化性
C
SiO2既能与HF溶液反应又能与NaOH溶液反应
SiO2属于两性氧化物
D
加热装有NH4Cl固体的试管,试管底部固体消失,试管口有晶体
NH4Cl固体易升华
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) 800 kJ/mol,部分键能数据如表所示:
键
C=O
C-H
O-H
O=O
键能(kJ/mol)
739
413
463
a
则a的值为
A. 439 B. 429 C. 1239 D. 345.5
3765550158115某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图。下列说法错误的是
A.向负极移动
B.a为CH4,b为O2
C.此电池在常温下不能工作
D.负极电极反应:CH48e-+4=5CO2+2H2O
在恒温恒容的条件下,加入等物质的量的A和B发生A(g) + B(g)2C(g) + D(s)反应,下列说法能作为该反应达到平衡状态的标志的是
①单位时间内消耗a mol A,同时生成2a mol C
②混合气体的密度不再变化
③A、B、C的浓度不再变化
④混合气体的总压强不再变化
①④ B.②③ C.①③ D.②④
氟离子电池提供了一种前景广阔的新型电池化学物质,如图是氟离子电池工作示意图,已知BiF3和MgF2均难溶于水。下列有关电池的叙述正确的是
377444065405放电时,外电路电流方向为:乙甲
充电时,外加电源的负极与甲电极相连
放电时,乙电极反应方程:Mg+= MgF2
若两电极初始质量相等,则导线上每通过1mol电子后,两电极质量相差19g
A与B在容积为2 L的密闭容器中发生反应:aA(s)+bB(g)=cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表,下列说法错误的是
反应时间/min
n(B)/mol
n(D)/mol
t1
0.12
0.10
t2
0.06
0.20
A.b∶d=3∶5
B.t1~t2内,平均反应速率v(B)=mol·L-1·min-1
C.若起始时n(D)=0,则t2时v(D)=mol·L-1·min-1
D. t1~t2内,平均反应速率v(C)=mol·L-1·min-1
HIO3水溶液是强氧化剂,用于制造药物。某学习小组拟用如图装置制备碘酸。N为惰性电极,ab、cd为交换膜。下列推断正确的是
e极为电源正极,M极发生氧化反应
B.ab、cd分别为阴离子交换膜和阳离子交换膜
C.M电极反应式:2H2O+2e-===H2↑+2
D.一共收集0.3 mol X和Y的混合气体时KIO3溶液减少64.2 g
154940079375
某密闭容器中发生如下反应:A2(g)+3B2(g)2AB3(g),图1表示A2的转化率随温度变化的曲线,图2表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法正确的是
A.该反应的>0
B.反应开始后AB3的百分含量最低的时间是t6
C.t1?t2、t2?t3、t4?t5以及t>t6时间段均达到化学平衡,且平衡常数相等
D.t2、t3、t5时刻改变的条件依次是加入催化剂、减小压强、增大AB3的浓度
温度T时,在四个容积均1 L的恒容密闭容器中仅发生反应:2NO(g)+O2 (g)2NO2(g) ?H<0。实验测得: v正=k正c2 (NO)c(O2 ),v逆=k逆c2(NO2),k正、k逆为速率常数,仅受温度影响。
容器编号
物质的起始物质的量(mol)
平衡物质的量(mol)
c(NO )
c(O2 )
c(NO2 )
c(NO2 )
I
0.8
0.4
0
0.6
II
0.4
0.3
0.4
a
III
0
0
0.6
IV
0.2
0.2
0.2
下列说法错误的是
a0.6
B.平衡时,容器Ⅲ中 NO2的体积分数小于66.7%
C.K=90
D.?开始时,容器IV中v正v逆
第Ⅱ卷(共58分)
二、解答题(本大题共5个小题,共58分)
(12分)物质类别与元素化合价是研究物质性质的两个视角,下列是硫元素及其化合物的“价类二维图”。
根据要求回答下列问题:
写出图中A的化学式 。
SO2属于______(填“酸性”或“碱性”)氧化物,因此可与CaO、 (写出与CaO不同类别的一个具体物质)等反应。请写出CaO除去燃煤产生的SO2的化学方程式
(两个方程式)。
重庆八中小王同学预测SO2具有还原性,其理论依据是 ,将SO2通入酸性高锰酸钾溶液中,下列实验事实能够证实SO2具有还原性的是 (填序号)。
①反应后溶液由紫色变为无色
②取反应后的溶液少许,加入BaCl2溶液,产生白色沉淀
③取反应后的溶液少许,加入Ba(NO3)2溶液,产生白色沉淀。
硝酸是一种具有强氧化性、腐蚀性的强酸。已知25.6g Cu与过量的300 mL、6 mol/L硝酸充分反应,反应结束后,除了产生Cu(NO3)2以外,还产生了NO与NO2两种气体共13.44 L(标况下测定),请计算(忽略反应前后溶液体积的变化):
反应产生的混合气体中,产生NO气体的体积为______L(标准状况下测定)。
反应后,的物质的量浓度为______mol/L。
(12分)CO用途广泛,工业应用时离不开平衡思想的指导:
在某一容积为5 L的体积不变的密闭容器内,加入0.4 mol CO和0.4 molH2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如下表:
t/min
0
5
10
15
20
c(CO2)/(mol/L)
0
0.02
0.035
0.04
0.04
根据表上数据,该温度(800 ℃)下的平衡常数K=______________。
改变下列条件能增大化学反应速率同时提高CO的平衡转化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.加入水蒸气
若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.4 mol CO(g)和0.4molH2O(g),重新达到平衡后,CO的转化率________(填“升高”“降低”或“不变”)。
在催化剂存在和800 ℃的条件下,在某一时刻测得CO、H2O、CO2、H2的浓度分别为0.03、0.03、0.05、0.05,则此时正、逆反应速率的大小:v正 v逆(填“>”“<”或“=”)。
还原法炼铅,包含反应PbO(s)+CO(g)===Pb(s)+CO2(g) ΔH<0
当K=9,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为 ;若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的物质的量分数 (填“增大”“减小”或“不变”)。
(12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中 X 为阳离子交换膜。请按要求回答相关问题:
乙池中铁电极作 极,甲池中甲烷燃料电池中负极的电极反应式为 。
在标况下,若消耗4.48L氧气,则乙装置中石墨电极上生成的气体体积 L,乙池中的阳离子交换膜 (“能”或“不能”)换成阴离子交换膜,原因是 。
若丙中以稀 H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为 。
若丙中为CuSO4电解质溶液,a、b为惰性电极,当消耗2.24LCH4(标况下),丙中a电极析出12.8g的铜单质,则整个回路中转移的电子数目为 ,需加入复原 (填序号)。
A. 16gCuO B.19.6gCu(OH)2 C.24.8gCuCO3 D.22.2g Cu2(OH)2CO3
(10分)电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法。
某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下:
电解质溶液中H+离子向 (填“A极”或“B极”)移动。
请写出负极电极反应式____________________________________________________。
用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生4.48 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为 ,析出银的物质的量 。
该兴趣小组又以NO为原料,采用电化学方法制取NH4NO3溶液,装置如下:
阳极与阴极消耗NO物质的量之比为 ,物质A可为 。
(12分)用CO2和H2在一定条件下可转化生成甲醇蒸气和水蒸气:
CO2(g)+3H2(g)CH3OH(g)+H2O(g);ΔH=-akJ/mol
已知:① 3CO(g)+3H2(g)CH3OCH3(g) +CO2(g) ΔH=-247 kJ/mol
② 2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH=-24 kJ/mol
③ CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41 kJ/mol
则a=__________。
CO2在不同温度下的平衡转化率与压强的关系如下图所示。请写出T1、T2、T3三者的大小关系 ,实际生产条件控制在T1、1.3×104kPa左右,选择此压强的理由是 。
31527757937570485062230
【第(3)问图】
【第(2)问图】
一定条件下,在相同体积的恒容密闭容器中充入1.0 molCO2和3.0 molH2,相同时间段内测得CO2的转化率随温度变化如上图所示:b点v正________v逆(填“>”“<”或“=”);温度高于T4,CO2的转化率降低的原因是 。已知容器内的起始压强为200kPa,则图中d点对应温度下反应的平衡常数Kp=
(kPa)-2(结果保留两位有效数字)(KP为以分压表示的平衡常数, 分压=总压×物质的量分数)
用惰性电极电解强酸性的二氧化碳水溶液可得到甲醇,其原理如下图所示。
①b电极上的电极反应式为_________________________;
②该装置中使用的是_________________(填“阳”或“阴”)离子交换膜。
重庆八中2020—2021学年度(下)期末考试高一年级
化学参考答案
一、选择题
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A
A
B
D
C
B
A
B
B
C
C
C
B
D
二、简答题
(12分)
H2SO4(1分)
酸性(1分) NaOH(化学式也可)其他合理给分(1分)
(每个方程1分)
SO2中硫+4,化合价可以升高,故具有还原性。(合理叙述给分) (1分) ①②(2分)
2.24(2分) (5) 4(2分)
(12分,每空2分)
1 (2) AF (3) 不变 (4) < (5) 90% 不变
(12分)
阴(1分) CH48+10=+7H2O (2分)
8.96(1分) 不能(1分) 乙池中铁电极产生的向右移动,与石墨电极产生的氯气发生反应(1分)
2Al6+3H2O=Al2O3+6(2分) (4) 0.8NA (2分) B (2分)
(10分)
B极(1分) (2) SO22+2H2O=+4(2分)
0.2mol/L (2分) 0.4mol(1分) (4) 5:3(2分) 氨气或氨水(化学式也可)(2分)
(12分)
100 (2分)
T1<T2<T3或者T3>T2>T1(1分) 在此压强下CO2的平衡转化率较大,再增加压强对设备要求高,增大生产成本(1分)
>(1分) 已达到平衡,该反应是放热反应,升高温度向逆向移动,故CO2的转化率下降(2分) 0.0059或5.9×10-3(2分)
CO26+6=CH3OH+H2O(2分) 阳(1分)
同课章节目录
