生活中常见的两种有机物
图片预览






文档简介
(共33张PPT)
好好学习,天天向上!
第三章 有机化合物
对酒当歌, 人生几何;
譬如朝露, 去日苦多.
慨当以慷, 忧思难忘;
何以解忧, 唯有杜康.
-------曹操《短歌行》
……
乙醇
学习目标:
1.掌握乙醇的组成和结构
2.掌握乙醇的化学性质(与钠反应, 氧化反应等),并能了解其断键位置
3.了解乙醇的物理性质
重难点: 乙醇的结构和性质
让我
好好想想
???
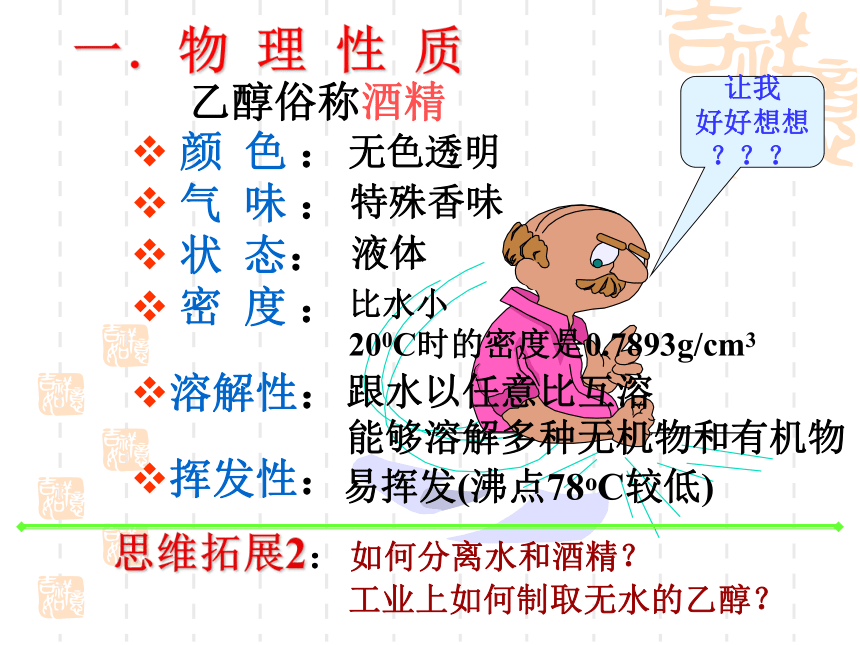
一.物 理 性 质
颜 色 :
气 味 :
状 态:
密 度 :
溶解性:
挥发性:
无色透明
特殊香味
液体
比水小
200C时的密度是0.7893g/cm3
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发(沸点78oC较低)
乙醇俗称酒精
思维拓展2:如何分离水和酒精?
工业上如何制取无水的乙醇?
如何分离水和酒精?
工业上如何制取无水的乙醇?
参考:由于水和酒精是互溶的,所以通常用蒸馏的方法分离水和酒精。
参考:先加生石灰,生石灰与水反应生成氢氧化钙,然后加热蒸馏分离乙醇。
思 考 题
C—C—O—H
H
H
H
H
H
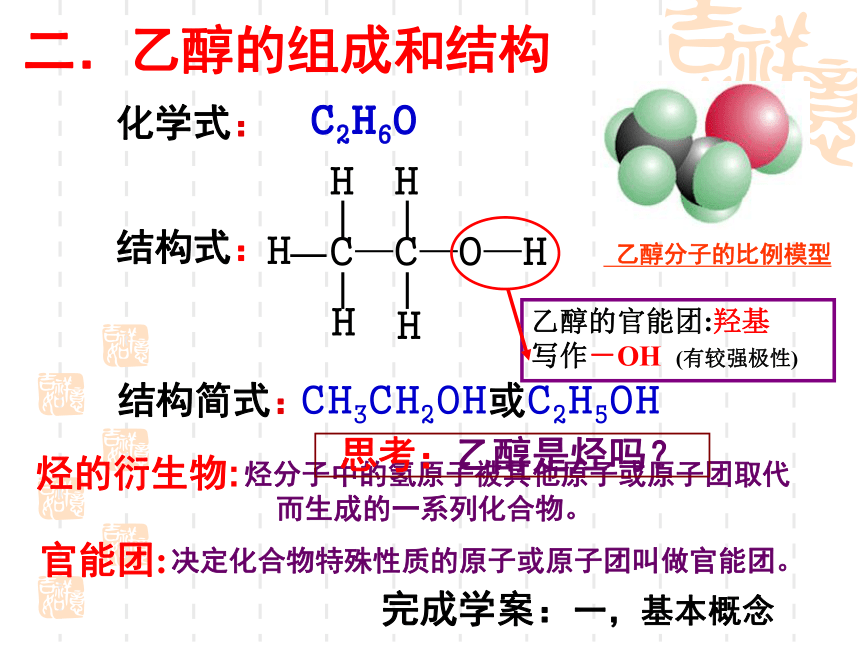
结构式:
CH3CH2OH或C2H5OH
乙醇的官能团:羟基
写作-OH (有较强极性)
乙醇分子的比例模型
化学式:
二.乙醇的组成和结构
C2H6O
结构简式:
烃的衍生物:
烃分子中的氢原子被其他原子或原子团取代而生成的一系列化合物。
官能团:
决定化合物特殊性质的原子或原子团叫做官能团。
完成学案:一,基本概念
思考:乙醇是烃吗?
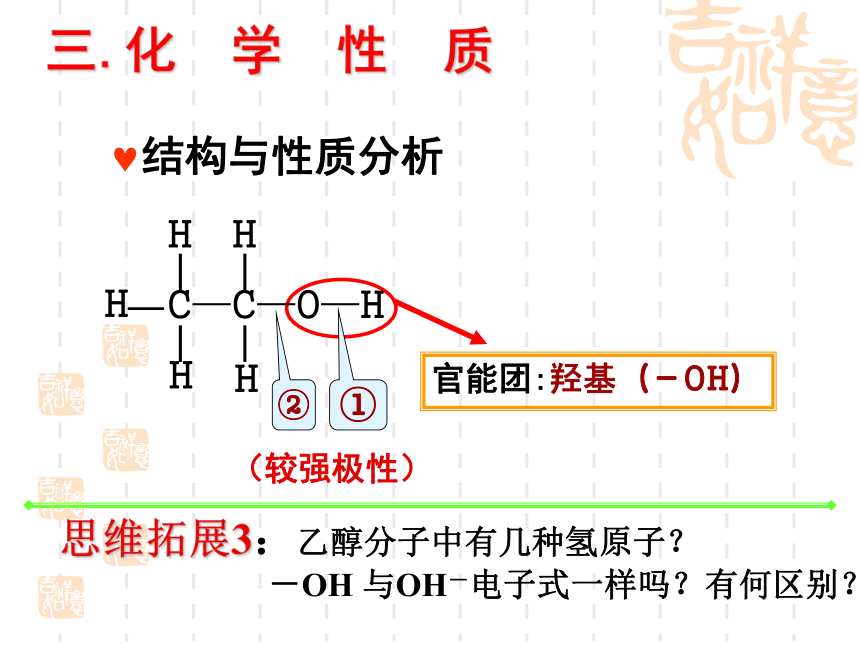
三.化 学 性 质
结构与性质分析
官能团:羟基(-OH)
①
②
(较强极性)
思维拓展3:乙醇分子中有几种氢原子?
-OH 与OH-电子式一样吗?有何区别?
C—C—O—H
H
H
H
H
H
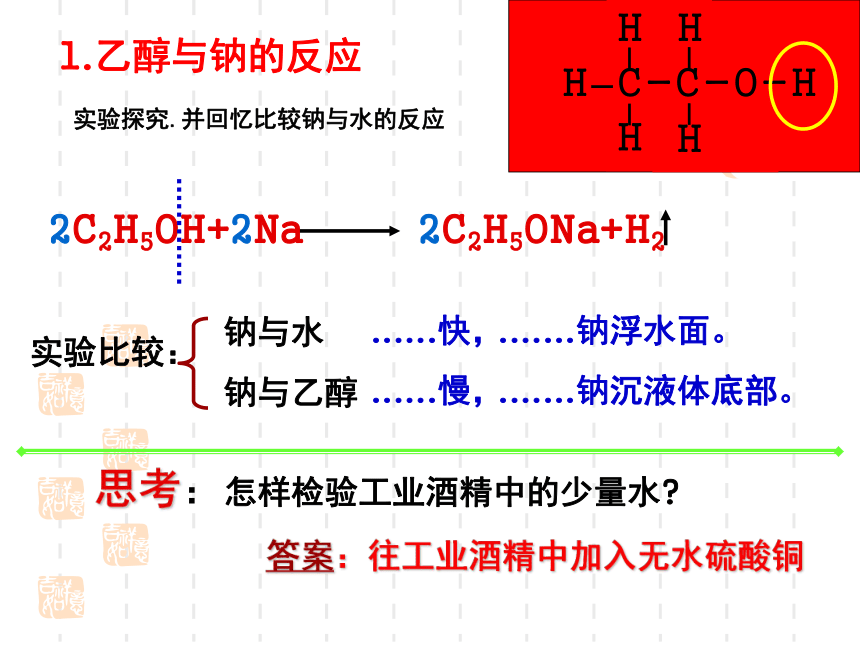
2C2H5OH+2Na 2C2H5ONa+H2
1.乙醇与钠的反应
思考:怎样检验工业酒精中的少量水
实验探究.并回忆比较钠与水的反应
实验比较:
钠与水
钠与乙醇
......快,
......慢,
.......钠浮水面。
.......钠沉液体底部。
C-C-O-H
H
H
H
H
H
答案:往工业酒精中加入无水硫酸铜
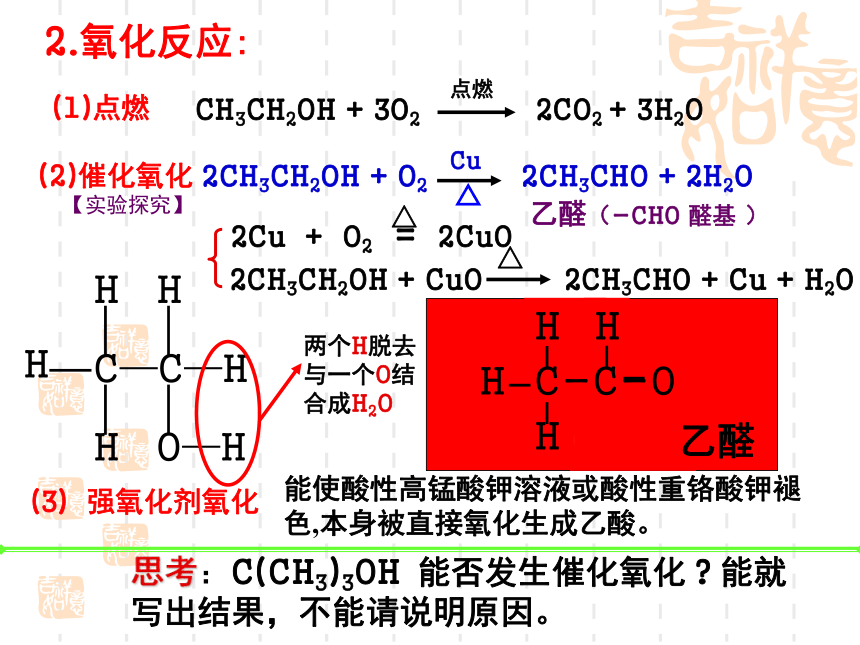
2.氧化反应:
C—C—H
H
H
H
H
O—H
两个H脱去与一个O结合成H2O
思考:C(CH3)3OH 能否发生催化氧化?能就写出结果,不能请说明原因。
(1)点燃
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
(2)催化氧化
CH3CH2OH + 3O2 2CO2 + 3H2O
点燃
2CH3CH2OH + CuO 2CH3CHO + Cu + H2O
△
2Cu + O2 = 2CuO
△
(3)强氧化剂氧化
能使酸性高锰酸钾溶液或酸性重铬酸钾褪色,本身被直接氧化生成乙酸。
【实验探究】
乙醛(-CHO 醛基 )
C-C-O-H
H
H
H
H
H
乙醛
四.乙 醇 用 途
乙醇有相当广泛的用途:
用作燃料,如酒精灯,环保汽车等
制造饮料和香精外,食品加工业
一种重要的有机化工原料,如制造乙酸、乙醚等。
乙醇又是一种有机溶剂,用于溶解树脂,制造涂料。
医疗上常用75%(体积分数)的酒精作消毒剂。
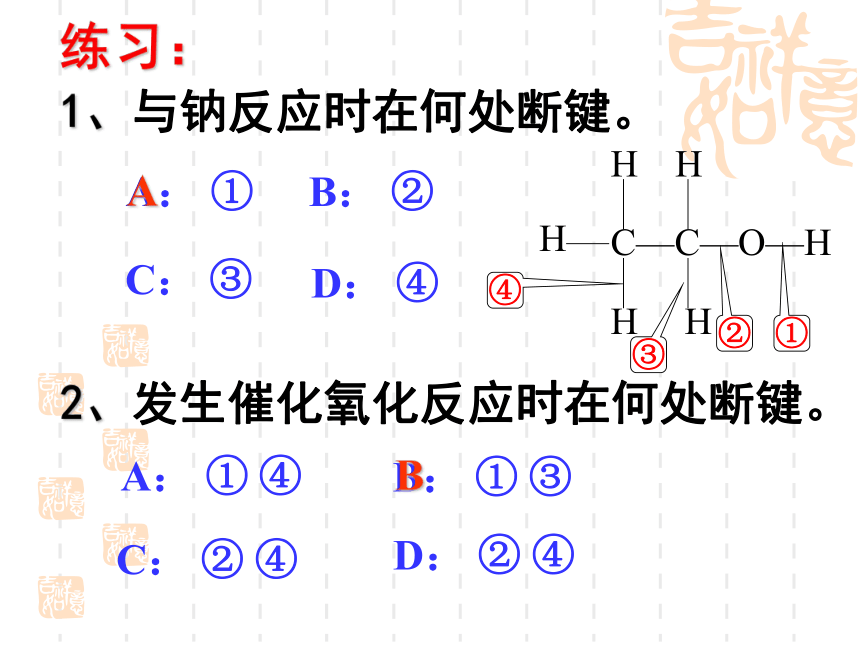
练习:
C—C—O—H
H
H
H
H
H
①
②
④
③
1、与钠反应时在何处断键。
A: ①
2、发生催化氧化反应时在何处断键。
A: ① ④
B: ②
B: ① ③
C: ③
C: ② ④
D: ④
D: ② ④
A
B
知 识 总 结
乙醇结构:化学式、结构式和结构简式。
物理性质:色、味、态、溶解度和挥发性
化学性质:
乙醇用途:
(较强极性)
C
H
H
H
C
H
H
O H
①
取代
去掉
②
与金属钠
C2H5ONa + H2 ↑
去氢氧化
乙醛(CH3CHO)
与浓硫酸
1700C 生成乙烯
1400C生成乙醚
C2H5-O-C2H5
( 消去反应 )
(取代反应)
1.将等质量的铜片在酒精灯上加热后,分别插入溶液中,放置片刻,铜片质量增加的是:
A. 硝酸 B. 酒精 C. 石灰水 D. 盐酸
2.能证明乙醇分子中有一个羟基的事实是
A. 乙醇完全燃烧生成CO2和H2O
B. 0.1mol 乙醇与足量的Na反应生成0.05mol氢气
C. 乙醇能溶于水
D. 乙醇能脱水
当堂训练:
√
√
Wan?
完≠玩
3.脱水反应(这不是反应类型,只是反应过程)
浓H2SO4
1700C
H C C H CH2=CH2 +H2O
H
H
H
OH
羟基和氢脱去结合成水
⑴ 分子内脱水
⑵ 分子间脱水
C2H5 —OH
+ HO — C2H5
浓H2SO4
1400C
C2H5-O-C2H5 + H2O
(乙醚)
启迪思考:
通过分子内脱水反应和分子间脱水反应,试比较这两个反应的异同点,有什么心得?
参考:
它们都是脱去一个水分子;
不同的是:分子内脱水反应属于消去反应,而分子间反应属于取代反应;反应条件也不同。
所以,我们可以根据物质的化学性质,按照实际需要,控制反应条件,使化学反应朝着我们所需要的方向进行。
通过分子内脱水反应和分子间脱水反应,试比较这两个反应的异同点,有什么心得?
启 迪 思 考 题
、
右式:6个氢完全等同;左式:有1个氢与另5个氢结构不同
取一定量的乙醇,
比如 1 mol(46g)。
在一定条件(如足量的Na存在)下,
取代出乙醇中的氢,
并测定氢气的量。
若1mol乙醇在同一条件下能产生3molH2,
......说明乙醇是右式。
若1mol乙醇在同一条件下能产生0.5mol或2.5molH2,
.....说明乙醇是左式
H
乙醇分子式为C2H6O,请用实验证明乙醇的结构式是:
而不是
H
H
C
H
H
C
H
O H
C
H
H
H
C
H
O
H
[思路]
Wan?
完≠玩
第三章 有机化合物
*
乙酸
学习目标:
1.掌握乙酸的组成、结构和主要性质。
2.通过实验设计探究乙酸的酸性强弱,学会科学探究的一般方法(怎样提出问题;怎样设计方案;怎样验证猜想和假设。
3.初步学会制备乙酸乙酯的实验技能。
4.会书写乙酸与乙醇反应的化学方程式。
5.了解酯的用途。
重难点: 乙酸的结构和性质
官能团:
C2H4O2
CH3COOH
结构简式:
分子式:
结构式:
一、乙酸的组成和结构
乙酸分子模型
请大家阅读教材P75页的相关内容,了解并掌握乙酸分子的结构特征,完成“学案:一,1”
C
H
H
H
C
O
O
H
O
羧基: —C—O—H(或 —COOH)
二、乙酸的物理性质
颜色、状态:
无色液体
气味:
有强烈刺激性气味
沸点:
117.9℃ (易挥发)
熔点:
16.6℃
溶解性:
易溶于水、乙醇等溶剂
1 、酸的通性:
2.能与活泼金属发生置换反应
5.能与某些盐发生反应
1.能使指示剂变色
3.能与碱发生中和反应
4.能与碱性氧化物反应
三、乙酸的化学性质
O
羧基: C O H
完成:思维拓展2
CH3COOH → CH3COO-+H+
→
结论:CH3COOH的酸性强于H2CO3
1 、酯化反应:
三、乙酸的化学性质
O
羧基: C O H
实验步骤:
(1)向大试管中加入几片碎瓷片;
(2)再向试管中加入约3mL乙醇;
(3)然后边振荡试管边慢慢加入约2mL浓硫酸,最后边振荡边加入约2mL的乙酸;
(4)在另一支小试管中加入约2mL饱和的碳酸钠溶液;
(5)组装好仪器,点燃酒精灯,开始实验。
实验探究:乙酸和乙醇反应
乙酸和乙醇反应的化学方程式:
O
CH3C—O—C2H5 + H2 O
O
CH3C— OH +
H—O—C2H5
浓H2SO4
(乙酸乙酯)
酯化反应:
酸和醇反应生成酯和水的反应。 (可逆反应)
O
CH3C— O—H +
H—O—C2H5
O
CH3C—O—C2H5 + H2 O
浓H2SO4
18
18
同位素示踪法:
酯化反应中,酸脱羟基醇脱(羟基)氢
a.浓加硫酸的顺序和作用是?
b.制得的乙酸乙酯中可能混有什么杂质?(提示:考虑乙醇、乙酸的沸点)
c.从乙酸乙酯所含杂质的角度思考,饱和碳酸钠溶液的作用是什么?
浓硫酸的作用:催化剂,吸水剂
有乙醇,乙酸 等杂质
1.除杂,即吸收乙醇,乙酸;
2.利于乙酸乙酯分层
三、乙酸的用途
2.乙酸是一种重要的有机化工原料
可用于生产醋酸纤维、合成纤维、喷漆溶剂、 香料、燃料、医药和农药等。
1.在日常生活中也有广泛的用途
可用于调味品、除水垢等
酯化反应产物---酯
1.概念
含有 结构的有机物叫做酯类
C O
O
官能团:
C O
O
2.性质
(1).物理性质:不溶于水,密度比水小,具有水果香味
(2).化学性质:能发生水解反应(酯化反应的逆反应)
3.存在及用途
简写为 R1COOR2
练习:学案 第8题 乳酸性质
好好学习,天天向上!
第三章 有机化合物
对酒当歌, 人生几何;
譬如朝露, 去日苦多.
慨当以慷, 忧思难忘;
何以解忧, 唯有杜康.
-------曹操《短歌行》
……
乙醇
学习目标:
1.掌握乙醇的组成和结构
2.掌握乙醇的化学性质(与钠反应, 氧化反应等),并能了解其断键位置
3.了解乙醇的物理性质
重难点: 乙醇的结构和性质
让我
好好想想
???
一.物 理 性 质
颜 色 :
气 味 :
状 态:
密 度 :
溶解性:
挥发性:
无色透明
特殊香味
液体
比水小
200C时的密度是0.7893g/cm3
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发(沸点78oC较低)
乙醇俗称酒精
思维拓展2:如何分离水和酒精?
工业上如何制取无水的乙醇?
如何分离水和酒精?
工业上如何制取无水的乙醇?
参考:由于水和酒精是互溶的,所以通常用蒸馏的方法分离水和酒精。
参考:先加生石灰,生石灰与水反应生成氢氧化钙,然后加热蒸馏分离乙醇。
思 考 题
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH或C2H5OH
乙醇的官能团:羟基
写作-OH (有较强极性)
乙醇分子的比例模型
化学式:
二.乙醇的组成和结构
C2H6O
结构简式:
烃的衍生物:
烃分子中的氢原子被其他原子或原子团取代而生成的一系列化合物。
官能团:
决定化合物特殊性质的原子或原子团叫做官能团。
完成学案:一,基本概念
思考:乙醇是烃吗?
三.化 学 性 质
结构与性质分析
官能团:羟基(-OH)
①
②
(较强极性)
思维拓展3:乙醇分子中有几种氢原子?
-OH 与OH-电子式一样吗?有何区别?
C—C—O—H
H
H
H
H
H
2C2H5OH+2Na 2C2H5ONa+H2
1.乙醇与钠的反应
思考:怎样检验工业酒精中的少量水
实验探究.并回忆比较钠与水的反应
实验比较:
钠与水
钠与乙醇
......快,
......慢,
.......钠浮水面。
.......钠沉液体底部。
C-C-O-H
H
H
H
H
H
答案:往工业酒精中加入无水硫酸铜
2.氧化反应:
C—C—H
H
H
H
H
O—H
两个H脱去与一个O结合成H2O
思考:C(CH3)3OH 能否发生催化氧化?能就写出结果,不能请说明原因。
(1)点燃
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
(2)催化氧化
CH3CH2OH + 3O2 2CO2 + 3H2O
点燃
2CH3CH2OH + CuO 2CH3CHO + Cu + H2O
△
2Cu + O2 = 2CuO
△
(3)强氧化剂氧化
能使酸性高锰酸钾溶液或酸性重铬酸钾褪色,本身被直接氧化生成乙酸。
【实验探究】
乙醛(-CHO 醛基 )
C-C-O-H
H
H
H
H
H
乙醛
四.乙 醇 用 途
乙醇有相当广泛的用途:
用作燃料,如酒精灯,环保汽车等
制造饮料和香精外,食品加工业
一种重要的有机化工原料,如制造乙酸、乙醚等。
乙醇又是一种有机溶剂,用于溶解树脂,制造涂料。
医疗上常用75%(体积分数)的酒精作消毒剂。
练习:
C—C—O—H
H
H
H
H
H
①
②
④
③
1、与钠反应时在何处断键。
A: ①
2、发生催化氧化反应时在何处断键。
A: ① ④
B: ②
B: ① ③
C: ③
C: ② ④
D: ④
D: ② ④
A
B
知 识 总 结
乙醇结构:化学式、结构式和结构简式。
物理性质:色、味、态、溶解度和挥发性
化学性质:
乙醇用途:
(较强极性)
C
H
H
H
C
H
H
O H
①
取代
去掉
②
与金属钠
C2H5ONa + H2 ↑
去氢氧化
乙醛(CH3CHO)
与浓硫酸
1700C 生成乙烯
1400C生成乙醚
C2H5-O-C2H5
( 消去反应 )
(取代反应)
1.将等质量的铜片在酒精灯上加热后,分别插入溶液中,放置片刻,铜片质量增加的是:
A. 硝酸 B. 酒精 C. 石灰水 D. 盐酸
2.能证明乙醇分子中有一个羟基的事实是
A. 乙醇完全燃烧生成CO2和H2O
B. 0.1mol 乙醇与足量的Na反应生成0.05mol氢气
C. 乙醇能溶于水
D. 乙醇能脱水
当堂训练:
√
√
Wan?
完≠玩
3.脱水反应(这不是反应类型,只是反应过程)
浓H2SO4
1700C
H C C H CH2=CH2 +H2O
H
H
H
OH
羟基和氢脱去结合成水
⑴ 分子内脱水
⑵ 分子间脱水
C2H5 —OH
+ HO — C2H5
浓H2SO4
1400C
C2H5-O-C2H5 + H2O
(乙醚)
启迪思考:
通过分子内脱水反应和分子间脱水反应,试比较这两个反应的异同点,有什么心得?
参考:
它们都是脱去一个水分子;
不同的是:分子内脱水反应属于消去反应,而分子间反应属于取代反应;反应条件也不同。
所以,我们可以根据物质的化学性质,按照实际需要,控制反应条件,使化学反应朝着我们所需要的方向进行。
通过分子内脱水反应和分子间脱水反应,试比较这两个反应的异同点,有什么心得?
启 迪 思 考 题
、
右式:6个氢完全等同;左式:有1个氢与另5个氢结构不同
取一定量的乙醇,
比如 1 mol(46g)。
在一定条件(如足量的Na存在)下,
取代出乙醇中的氢,
并测定氢气的量。
若1mol乙醇在同一条件下能产生3molH2,
......说明乙醇是右式。
若1mol乙醇在同一条件下能产生0.5mol或2.5molH2,
.....说明乙醇是左式
H
乙醇分子式为C2H6O,请用实验证明乙醇的结构式是:
而不是
H
H
C
H
H
C
H
O H
C
H
H
H
C
H
O
H
[思路]
Wan?
完≠玩
第三章 有机化合物
*
乙酸
学习目标:
1.掌握乙酸的组成、结构和主要性质。
2.通过实验设计探究乙酸的酸性强弱,学会科学探究的一般方法(怎样提出问题;怎样设计方案;怎样验证猜想和假设。
3.初步学会制备乙酸乙酯的实验技能。
4.会书写乙酸与乙醇反应的化学方程式。
5.了解酯的用途。
重难点: 乙酸的结构和性质
官能团:
C2H4O2
CH3COOH
结构简式:
分子式:
结构式:
一、乙酸的组成和结构
乙酸分子模型
请大家阅读教材P75页的相关内容,了解并掌握乙酸分子的结构特征,完成“学案:一,1”
C
H
H
H
C
O
O
H
O
羧基: —C—O—H(或 —COOH)
二、乙酸的物理性质
颜色、状态:
无色液体
气味:
有强烈刺激性气味
沸点:
117.9℃ (易挥发)
熔点:
16.6℃
溶解性:
易溶于水、乙醇等溶剂
1 、酸的通性:
2.能与活泼金属发生置换反应
5.能与某些盐发生反应
1.能使指示剂变色
3.能与碱发生中和反应
4.能与碱性氧化物反应
三、乙酸的化学性质
O
羧基: C O H
完成:思维拓展2
CH3COOH → CH3COO-+H+
→
结论:CH3COOH的酸性强于H2CO3
1 、酯化反应:
三、乙酸的化学性质
O
羧基: C O H
实验步骤:
(1)向大试管中加入几片碎瓷片;
(2)再向试管中加入约3mL乙醇;
(3)然后边振荡试管边慢慢加入约2mL浓硫酸,最后边振荡边加入约2mL的乙酸;
(4)在另一支小试管中加入约2mL饱和的碳酸钠溶液;
(5)组装好仪器,点燃酒精灯,开始实验。
实验探究:乙酸和乙醇反应
乙酸和乙醇反应的化学方程式:
O
CH3C—O—C2H5 + H2 O
O
CH3C— OH +
H—O—C2H5
浓H2SO4
(乙酸乙酯)
酯化反应:
酸和醇反应生成酯和水的反应。 (可逆反应)
O
CH3C— O—H +
H—O—C2H5
O
CH3C—O—C2H5 + H2 O
浓H2SO4
18
18
同位素示踪法:
酯化反应中,酸脱羟基醇脱(羟基)氢
a.浓加硫酸的顺序和作用是?
b.制得的乙酸乙酯中可能混有什么杂质?(提示:考虑乙醇、乙酸的沸点)
c.从乙酸乙酯所含杂质的角度思考,饱和碳酸钠溶液的作用是什么?
浓硫酸的作用:催化剂,吸水剂
有乙醇,乙酸 等杂质
1.除杂,即吸收乙醇,乙酸;
2.利于乙酸乙酯分层
三、乙酸的用途
2.乙酸是一种重要的有机化工原料
可用于生产醋酸纤维、合成纤维、喷漆溶剂、 香料、燃料、医药和农药等。
1.在日常生活中也有广泛的用途
可用于调味品、除水垢等
酯化反应产物---酯
1.概念
含有 结构的有机物叫做酯类
C O
O
官能团:
C O
O
2.性质
(1).物理性质:不溶于水,密度比水小,具有水果香味
(2).化学性质:能发生水解反应(酯化反应的逆反应)
3.存在及用途
简写为 R1COOR2
练习:学案 第8题 乳酸性质
