化学:《物质的制备、检验、分离和提纯》综合训练指导课件(人教版选修6)(共39张PPT)
文档属性
| 名称 | 化学:《物质的制备、检验、分离和提纯》综合训练指导课件(人教版选修6)(共39张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 868.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-25 00:00:00 | ||
图片预览









文档简介
(共41张PPT)
化学:《物质的制备、检验、分离和提纯》
综合训练指导课件(人教版选修6)
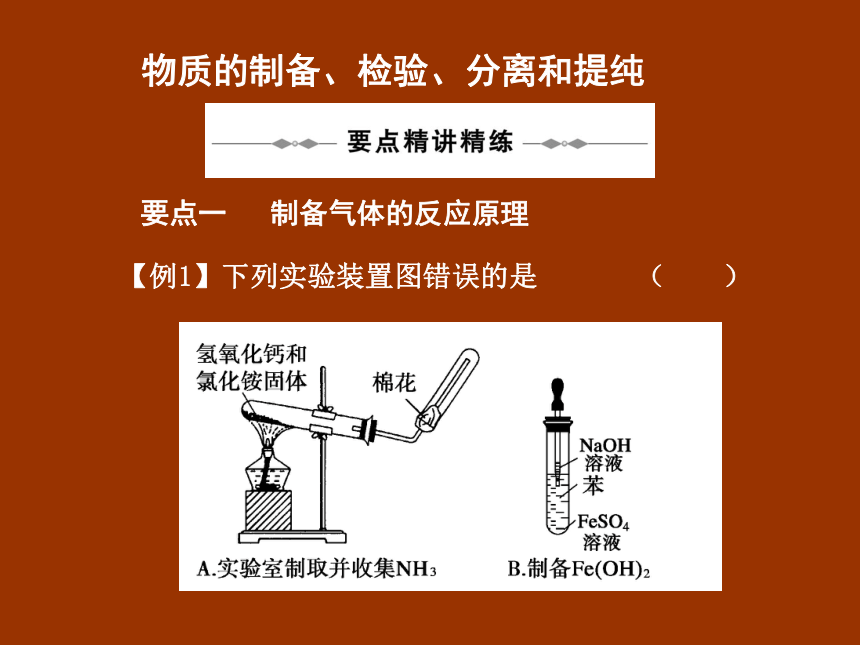
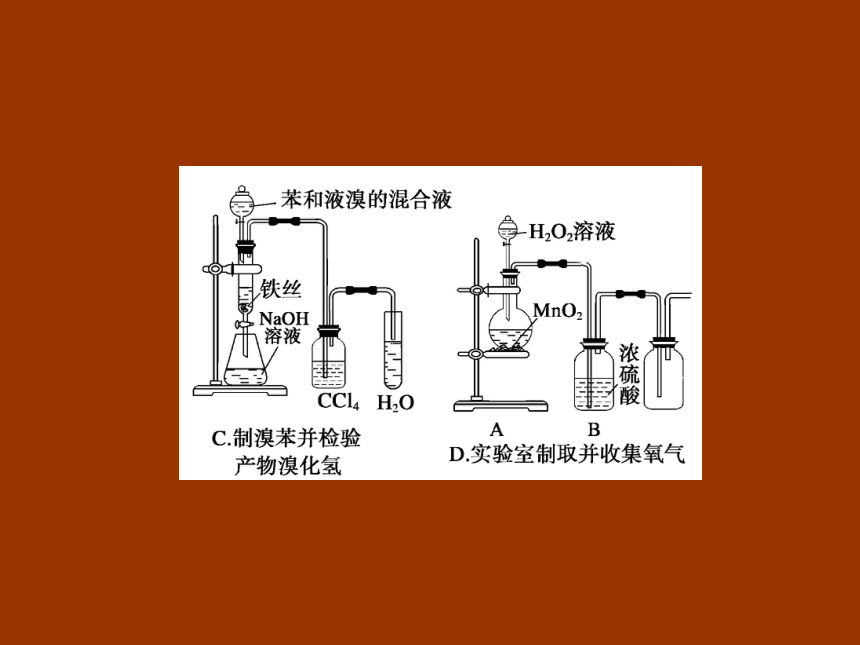
【例1】下列实验装置图错误的是 ( )
物质的制备、检验、分离和提纯
要点一 制备气体的反应原理
解析 实验室常用加热氢氧化钙和氯化铵的混合物,制取氨气,棉花的作用是减慢NH3和空气的对流,提高收集到的氨气的纯度,A正确;为了防止生成的氢氧化亚铁被空气中的氧气氧化,用苯覆盖在FeSO4溶液上,并将滴管插入FeSO4溶液中加入氢氧化钠溶液,B错误;苯和液溴在铁的催化作用下得到溴苯,生成的溴化氢气体可能含有溴单质,先用四氯化碳吸收溴单质,再检验溴化氢,C正确;收集氧气应长管进,短管出,D正确。
答案 D
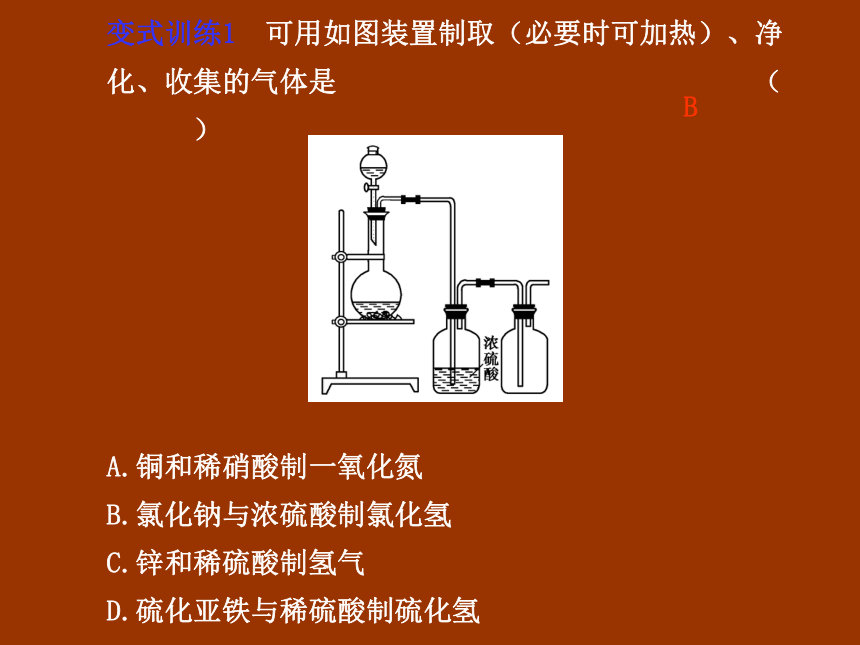
变式训练1 可用如图装置制取(必要时可加热)、净化、收集的气体是 ( )
A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢
B
【例2】为提纯下列物质(括号内为少量杂质),所
选用的除杂试剂和分离方法正确的是 ( )
要点二 物质的分离与提纯
提纯物质 除杂试剂 分离方法
A KCl溶液(FeCl3) 氨水 过滤
B 乙酸乙酯(乙酸) 乙醇和浓
硫酸 分液
C NaCl溶液(Na2S) AgCl 过滤
D 乙醇(H2O) 金属钠 蒸馏
解析 A项的除杂试剂应选用氢氧化钾溶液,不应选用氨水,否则会引进氯化铵新杂质,A项错误;B项的除杂试剂应选用饱和Na2CO3溶液,B项错误;C项的除杂原理是利用了溶解平衡的原理,由于Ag2S的溶解度比AgCl小许多,向混合溶液中加入氯化银粉末,会使溶液中的硫离子逐渐转化成更难溶解的硫化银,再经过滤除去,C项正确;D项不应选用金属钠作除杂试剂,因为钠也与乙醇反应,应选用加入生石灰(氧化钙)以蒸馏的方法来除去混在乙醇中的少量水,D项错误。
答案 C
变式训练2 提纯含有少量Ba(NO3)2杂质的KNO3溶液,可使用的方法为 ( )
A.加入过量Na2CO3溶液,过滤,除去沉淀,溶液中
补加适量HNO3
B.加入过量K2SO4溶液,过滤,除去沉淀,溶液中补
加适量HNO3
C.加入过量Na2SO4溶液,过滤,除去沉淀,溶液中补
加适量HNO3
D.加入过量K2CO3溶液,过滤,除去沉淀,溶液中补
加适量HNO3
D
【例3】有五瓶失去标签的溶液,它们分别为:
①Ba(NO3)2 ②KCl ③NaOH ④CuSO4 ⑤Na2SO4
中的一种。如果不用其他任何试剂(包括试 纸),
用最简便的方法将它们鉴别开来,则在下列的鉴
别顺序中,最合理的是 ( )
A.④③①⑤② B.④①③⑤②
C.①⑤③④② D.③④①⑤②
要点三 物质的鉴别
解析 本题中的物质只有CuSO4溶液是有颜色的,因此,通过观察首先确定CuSO4溶液,由于Ba(NO3)2与CuSO4能产生白色BaSO4沉淀,NaOH与CuSO4产生蓝色沉淀,KCl和Na2SO4与CuSO4不反应,故可以确定出Ba(NO3)2和NaOH;最后利用Ba(NO3)2与Na2SO4产生沉淀,与KCl不反应,可以确定KCl和Na2SO4。所以首先通过物理方法,观察颜色,呈蓝色的原溶液为CuSO4溶液;然后再用CuSO4溶液作试剂,可鉴别出NaOH溶液和Ba(NO3)2溶液;接下来再用Ba(NO3)2溶液作试剂可鉴别出Na2SO4溶液,最后剩下的为KCl溶液。
答案 AB
变式训练3 下列各组溶液,不用任何其他试剂就能鉴别的是 ( )
A.Na2SO4、H2SO4、AlCl3、BaCl2
B.HCl、NaOH、K2SO4、Na2SO4
C.NaAlO2、KHCO3、NaCl、NaHSO4
D.NaOH、FeCl3、MgCl2、K2SO4
CD
【例4】今有一混合物的水溶液,只可能含有以下离
子中的若干种:K+、NH 、Cl-、Mg2+、Ba2+、
CO 、SO ,现取三份各100 mL该溶液进行
如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加入足量NaOH溶液加热后,收集到气
体0.04 mol。
③第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,
经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
要点四 溶液中常见离子的检验
根据上述实验,回答下列问题:
(1)一定不存在的离子是 。
(2)确定溶液中肯定存在的阴离子及浓度(可不填 满):
离子符号 ,浓度 ;
离子符号 ,浓度 ;
离子符号 ,浓度 。
(3)试确定K+是否存在? (填“是”或“否”),判断的理由是
。
NH 、 CO 和SO 。经计算,NH 的物质的量为
Mg2+、Ba2+
CO
0.2 mol/L
SO
0.1 mol/L
是
溶液中肯定存在的离子是
0.04 mol,CO 、SO 的物质的量分别为
0.02 mol
和0.01 mol,
根据溶液整体呈中性,K+一定存在
解析 (1)首先考虑离子间的共存:CO 、SO 与Ba2+,CO 与Mg2+间不能大量共存。据实验①推测原溶液中至少含有Cl-、CO 、SO 中的一种;据实验②推测原溶液中含有NH ;据实验③推测原溶液中含有CO 和SO ,则一定不含Mg2+、Ba2+。而仅据题意无法判断原溶液中是否含有Cl-。
(2)由题意知:NH 的物质的量等于NH3的物质的量,为0.04 mol;实验③中的沉淀6.27 g为BaCO3和BaSO4的混合物,其中BaSO4的质量为2.33 g,即为0.01 mol,则SO 的物质的量为0.01 mol;其中BaCO3的质量为6.27 g-2.33 g=3.94 g,即为0.02 mol;故可计算出CO 的浓度为0.2 mol/L,SO 的浓度为0.1 mol/L。
(3)可根据溶液中所有阴、阳离子的总电荷代数和为零予以判断,K+一定存在。
变式训练4 某溶液中含有SO 、CO 、OH-、Cl-四种阴离子,若只允许取一次该溶液而把四种离子分别检验出来,则应采取什么样的措施(能写出离子方程式的,写出每检验出一种离子时的离子方程式,若不能写出离子方程式,请写“无”)。
(1)先检验 ;加入 试剂。
离子方程式:无。
(2)然后检验 ;加入 试剂。
离子方程式:
。
(3)再检验 ;加入 试剂。
离子方程式: 。
(4)最后检验 ;加入 试剂。
离子方程式: 。
H++OH- H2O,CO +2H+
OH-
酚酞
HNO3
H2O+CO2↑
SO
CO
Ba(NO3)2
SO +Ba2+ BaSO4↓
Cl-
AgNO3
Ag++Cl- AgCl↓
1.下列各组物质中,仅用水及物质间相互反应不能一
一区别的一组是 ( )
A.Na2O2、Al2(SO4)3、MgCl2、K2CO3
B.BaCl2、Na2SO4、(NH4)2SO4、KOH
C.AgNO3、NaCl、KCl、CuCl2
D.Fe2(SO4)3、K2CO3、KHSO4、NH4Cl
解析 A选项可按下列顺序区别:Na2O2(淡黄色)→生成白色沉淀且不溶解的为MgCl2,生成白色沉淀又溶解的为Al2(SO4)3,最后剩余K2CO3;B选项可用两两相混的方法来区别;D选项的检出顺序为:Fe2(SO4)3→K2CO3→KHSO4→NH4Cl;C选项不能区别,故正确答案为C项。
C
2.下述实验能达到预期目的的是 ( )
解析 A选项可证明SO2的还原性,不能达到目的;
B选项可达到目的;由于乙酸和乙醇的反应为可逆反应,故C选项不能达到目的;NH 、Fe3+皆可与碱作用,故D选项不能达到目的,本题答案为B项。
B
编号 实验内容 实验目的
A 将SO2通入溴水中 验证SO2具有漂白性
B 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去 验证Na2CO3溶液中存在水解平衡
C 加入乙醇和浓硫酸,加热、静置、分液 除去乙酸乙酯中混有的少量乙酸
D 向溶液中滴加适量氢氧化钠溶液,过滤 除去氯化铵溶液中的氯化铁
3.现有含NaCl、Na2SO4和NaNO3的混合溶液,选择
适当的试剂将其转化为相应的沉淀或固体,从而实
现Cl-和NO 的相互分离。相应的实验过程如下:
下列关于四种试剂顺序正确的是 ( )
A.氯化钡溶液、硝酸银溶液、碳酸钠溶液、硝酸溶液
B.硝酸银溶液、氯化钡溶液、碳酸钠溶液、硝酸溶液
C.氯化钡溶液、硝酸银溶液、硝酸溶液、碳酸钠溶液
D.硝酸银溶液、碳酸钠溶液、氯化钡溶液、硝酸溶液
解析 Cl-可用AgNO3沉淀,SO 可用Ba2+沉淀,由于Ag2SO4微溶于水,故SO 的除去应在Cl-之前;由于加入的试剂是过量的,所以过量的AgNO3、BaCl2必须除去,可选用Na2CO3,而过量的Na2CO3可用稀HNO3来除去,所以正确答案为A项。
答案 A
4.某澄清溶液中可能含有①H+、②Na+、③Fe3+、
④NO 、⑤I-中的某几种,若向此溶液中加
AgNO3溶液有不溶性物质析出;若向此溶液中加
铜片和浓H2SO4并加热,有红棕色气体放出,则此
溶液中肯定不存在的离子是 ( )
A.②③ B.①② C.①③ D.②⑤
C
5.化学实验中的很多气体是用盐酸来制取的,
这就导致了制取的气体中往往含有HCl杂
质,要除去HCl杂质而得到纯净的目标气
体,可用图示装置。如果广口瓶盛装的是
饱和NaHCO3溶液,则可以用于下列哪种气
体的除杂装置 ( )
A.H2 B.Cl2 C.H2S D.CO2
D
6.在进行化学实验和科学探究时,下列叙述中正确的
是 ( )
A.欲配制质量分数为10%的CuSO4溶液,可将10 g
CuSO4·5H2O溶解在90 g水中
B.用托盘天平称取8.75 g食盐
C.用洗气瓶中的NaHCO3溶液除去CO2中混有的SO2
气体
D.向某溶液中加入氯化钡溶液有白色沉淀产生,再
加盐酸,沉淀不消失,该溶液中一定含有SO
C
7.下表为各物质中所含有的少量杂质,以及除去杂质
所选用的试剂或操作方法:
序号 物质 杂质 除杂质应选用的试剂
或操作方法
① KNO3溶液 KOH 加入FeCl3溶液,并过滤
② FeSO4溶液 CuSO4 加入过量铁粉,并过滤
③ H2 CO2 通过盛有NaOH溶液的洗
气瓶,再通过盛有浓硫酸
的洗气瓶
④ NaNO3 CaCO3 溶解、过滤、蒸发
正确的一组为 ( )
A.①②③④ B.③④ C.②③④ D.①②③
解析 KNO3中的KOH应用稀HNO3除去,①不正确;②③④各项皆正确。
C
8.某钠盐溶液可能含有阴离子NO 、CO 、SO 、SO 、
Cl-、Br-、I-,为鉴别这些离子,分别取少量溶液进
行以下实验:①测得混合液呈碱性;②加HCl后,生
成无色无味气体,该气体能使澄清石灰水变浑浊;
③加CCl4后,滴加少量氯水,振荡后CCl4层未变
色;④加BaCl2溶液产生白色沉淀,分离,在沉淀中
加入足量盐酸,沉淀不能完全溶解;⑤加HNO3酸化
后,再加过量AgNO3溶液,溶液中析出白色沉淀。
下列说法正确的是 ( )
A.溶液中肯定含有CO 、SO 、SO
B.溶液肯定不含有Br-、I-、Cl-
C.溶液中可能含有NO
D.以上说法均不正确
C
9.实验室有一份混有少量碳酸
钙杂质的碳酸钡样品[Ba(OH)2
和Ca(OH)2的溶解度曲线如图所
示]。分离并提纯碳酸钡的实
验步骤如下:①高温灼烧碳酸
钡和碳酸钙的混合物,直至分解。②将灼烧后的固
体混合物置于80℃的热水中,制成氢氧化钡的热饱
和溶液,趁热过滤。③冷却结晶,将滤液过滤,得
到的Ba(OH)2固体溶于水制成溶液。④通入二氧化
碳,滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净
的碳酸钡。下列叙述有错误的是 ( )
A.高温灼烧所需的仪器有坩埚、泥三角、玻璃棒、
三脚架、坩埚钳、酒精喷灯
B.步骤②中趁热过滤的目的是减少Ba(OH)2的损失并
除去不溶物
C.过滤过程中所需要的玻璃仪器有玻璃棒、漏斗、
烧杯
D.步骤④中可加入石蕊溶液,通过观察溶液颜色变
化判断是否需要继续通入二氧化碳
答案 D
10.硫酸铜在加热条件下发生分解反应,生成氧化铜、
二氧化硫、三氧化硫和氧气。某探究性学习小组
设计了如下实验装置检验硫酸铜的分解产物并测
定硫酸铜的分解率。
试填写下列空白:
(1)按装置从左至右排列,实验时各仪器接口的排列顺序为 。
(2)装置F的作用是 ,发生反应的化学方程式为 。
(3)装置D的作用是 。
(4)实验开始前,准确称量无水硫酸铜9.6 g,实验结束后,装置F质量减少了0.48 g,干燥管C质量增加2.56 g,量筒中收集到224 mL水的体积(折算成标准状况)。则硫酸铜在加热条件下发生分解反应的化学方程式为 ,其分解率为 。
①⑨⑩⑥⑤③④⑧⑦②
吸收SO3
2NaHSO3+SO3 Na2SO4+2SO2+H2O
干燥SO2和O2
3CuSO4 3CuO+SO3↑+O2↑+2SO2↑
50%
解析 根据2NaHSO3+SO3 Na2SO4+2SO2+H2O;Δm=48,则n(SO3)= mol=0.01 mol,生成的n(SO2) =0.02 mol,干燥管中增重的质量为SO2的质量,包括装置A中分解的和通过F中新生成的,n(SO2)=
=0.04 mol,则分解产生的n(SO2)=0.02 mol。B中排出水的体积为O2的体积,n(O2)= =0.01 mol。则从①出来的气体中n(SO2)∶n(O2)∶n(SO3)=0.02 ∶0.01∶0.01
=2∶1∶1,CuSO4的分解率为 ×100%=50%。
11.某无色透明溶液可能含有下列离子:K+、Al3+、
Fe3+、Ba2+、NO 、SO 、HCO 、Cl-,取该溶液
进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无
色气体,该气体遇空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续
加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生
白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是 (填代号)。
BD
(2)根据上述实验判断原溶液中肯定存在的离子是
,肯定不存在的离子是
。
(3)写出与②③两个实验有关的离子方程式:
② ;
③ 。
Al3++3NH3·H2O Al(OH)3↓+3NH
Al3+、NO 、SO
Fe3+ 、
Ba2+、HCO
3Cu+8H++2NO 3Cu2++2NO↑+4H2O
12.某同学在探究废干电池内的黑色固体的回收利用
时,进行如图所示实验:
查阅教材可知,普通锌锰电池的黑色物质主要成
分为MnO2、NH4Cl、ZnCl2等物质。请回答以下
问题:
(1)操作①的名称是 ;操作②的名称是 ;
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、 和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为 。
(3)操作④的试管中加入③所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
溶解
过滤
坩埚
泥三角
碳
MnO2(或二氧化锰)
取少许滤液于试管中,加入
取少许滤液于试管中,加入
NaOH溶液,并
将湿润的红色石
蕊试纸置于试管
口附近
酸化的AgNO3
含有Zn2+
先产生白色沉淀,继续加入氨水,沉淀又溶解
取少许滤液于试管中,加入稀氨水
3.检验
Zn2+
含有NH
2.检验
NH
含有Cl-
1.检验
Cl-
结论
实验现象
操作
实验目的
HNO3
溶液
有白色沉淀产生
红色石蕊试纸变蓝
浓
(5)根据以上的实验报告,关于滤液的成分,他的结论是:滤液中含有氯化铵和氯化锌。若想从滤液中得到溶质固体,还应进行的操作是 、
、 。若要将所得的溶质固体中的物质加以分离,可用 法。
加热蒸发
冷却结晶
过滤
加热
13.下图虚线框中的装置可用来检验浓硫酸与木炭粉
在加热条件下反应产生的所有气体产物,填写下
列空白:
(1)如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检验出的物质是 ;不能检出的物质是 。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是 ;不能检出的物质是 。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是 ;不能检出的物质是 。
SO2、CO2
H2O
H2O
CO2、SO2
SO2、CO2
H2O
解析 浓硫酸与木炭加热发生反应的化学方程式为2H2SO4(浓)+C CO2↑+2SO2↑+2H2O。纵观整套装置,①用于检验水蒸气(使无水硫酸铜变蓝);
②用于检验SO2气体(品红溶液褪色、酸性KMnO4溶液褪色或颜色变浅,再通过品红溶液验证SO2是否已经除净);③用于检验CO2气体(澄清石灰水变浑浊)。(1)当顺序改为②、①、③时,由于气体先
经②装置,必然带出洗气瓶中的水蒸气,故难以肯定①中无水硫酸铜变蓝是由浓硫酸与木炭反应所产生的H2O造成的。(2)当顺序改变为①、③、②时,足量澄清石灰水变浑浊究竟是由CO2还是由SO2与Ca(OH)2反应造成的,无法肯定,所以CO2与SO2都无法一一鉴别。(3)当顺序改为②、③、①时,出现与(1)中同样的问题。
返回
化学:《物质的制备、检验、分离和提纯》
综合训练指导课件(人教版选修6)
【例1】下列实验装置图错误的是 ( )
物质的制备、检验、分离和提纯
要点一 制备气体的反应原理
解析 实验室常用加热氢氧化钙和氯化铵的混合物,制取氨气,棉花的作用是减慢NH3和空气的对流,提高收集到的氨气的纯度,A正确;为了防止生成的氢氧化亚铁被空气中的氧气氧化,用苯覆盖在FeSO4溶液上,并将滴管插入FeSO4溶液中加入氢氧化钠溶液,B错误;苯和液溴在铁的催化作用下得到溴苯,生成的溴化氢气体可能含有溴单质,先用四氯化碳吸收溴单质,再检验溴化氢,C正确;收集氧气应长管进,短管出,D正确。
答案 D
变式训练1 可用如图装置制取(必要时可加热)、净化、收集的气体是 ( )
A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢
B
【例2】为提纯下列物质(括号内为少量杂质),所
选用的除杂试剂和分离方法正确的是 ( )
要点二 物质的分离与提纯
提纯物质 除杂试剂 分离方法
A KCl溶液(FeCl3) 氨水 过滤
B 乙酸乙酯(乙酸) 乙醇和浓
硫酸 分液
C NaCl溶液(Na2S) AgCl 过滤
D 乙醇(H2O) 金属钠 蒸馏
解析 A项的除杂试剂应选用氢氧化钾溶液,不应选用氨水,否则会引进氯化铵新杂质,A项错误;B项的除杂试剂应选用饱和Na2CO3溶液,B项错误;C项的除杂原理是利用了溶解平衡的原理,由于Ag2S的溶解度比AgCl小许多,向混合溶液中加入氯化银粉末,会使溶液中的硫离子逐渐转化成更难溶解的硫化银,再经过滤除去,C项正确;D项不应选用金属钠作除杂试剂,因为钠也与乙醇反应,应选用加入生石灰(氧化钙)以蒸馏的方法来除去混在乙醇中的少量水,D项错误。
答案 C
变式训练2 提纯含有少量Ba(NO3)2杂质的KNO3溶液,可使用的方法为 ( )
A.加入过量Na2CO3溶液,过滤,除去沉淀,溶液中
补加适量HNO3
B.加入过量K2SO4溶液,过滤,除去沉淀,溶液中补
加适量HNO3
C.加入过量Na2SO4溶液,过滤,除去沉淀,溶液中补
加适量HNO3
D.加入过量K2CO3溶液,过滤,除去沉淀,溶液中补
加适量HNO3
D
【例3】有五瓶失去标签的溶液,它们分别为:
①Ba(NO3)2 ②KCl ③NaOH ④CuSO4 ⑤Na2SO4
中的一种。如果不用其他任何试剂(包括试 纸),
用最简便的方法将它们鉴别开来,则在下列的鉴
别顺序中,最合理的是 ( )
A.④③①⑤② B.④①③⑤②
C.①⑤③④② D.③④①⑤②
要点三 物质的鉴别
解析 本题中的物质只有CuSO4溶液是有颜色的,因此,通过观察首先确定CuSO4溶液,由于Ba(NO3)2与CuSO4能产生白色BaSO4沉淀,NaOH与CuSO4产生蓝色沉淀,KCl和Na2SO4与CuSO4不反应,故可以确定出Ba(NO3)2和NaOH;最后利用Ba(NO3)2与Na2SO4产生沉淀,与KCl不反应,可以确定KCl和Na2SO4。所以首先通过物理方法,观察颜色,呈蓝色的原溶液为CuSO4溶液;然后再用CuSO4溶液作试剂,可鉴别出NaOH溶液和Ba(NO3)2溶液;接下来再用Ba(NO3)2溶液作试剂可鉴别出Na2SO4溶液,最后剩下的为KCl溶液。
答案 AB
变式训练3 下列各组溶液,不用任何其他试剂就能鉴别的是 ( )
A.Na2SO4、H2SO4、AlCl3、BaCl2
B.HCl、NaOH、K2SO4、Na2SO4
C.NaAlO2、KHCO3、NaCl、NaHSO4
D.NaOH、FeCl3、MgCl2、K2SO4
CD
【例4】今有一混合物的水溶液,只可能含有以下离
子中的若干种:K+、NH 、Cl-、Mg2+、Ba2+、
CO 、SO ,现取三份各100 mL该溶液进行
如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加入足量NaOH溶液加热后,收集到气
体0.04 mol。
③第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,
经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
要点四 溶液中常见离子的检验
根据上述实验,回答下列问题:
(1)一定不存在的离子是 。
(2)确定溶液中肯定存在的阴离子及浓度(可不填 满):
离子符号 ,浓度 ;
离子符号 ,浓度 ;
离子符号 ,浓度 。
(3)试确定K+是否存在? (填“是”或“否”),判断的理由是
。
NH 、 CO 和SO 。经计算,NH 的物质的量为
Mg2+、Ba2+
CO
0.2 mol/L
SO
0.1 mol/L
是
溶液中肯定存在的离子是
0.04 mol,CO 、SO 的物质的量分别为
0.02 mol
和0.01 mol,
根据溶液整体呈中性,K+一定存在
解析 (1)首先考虑离子间的共存:CO 、SO 与Ba2+,CO 与Mg2+间不能大量共存。据实验①推测原溶液中至少含有Cl-、CO 、SO 中的一种;据实验②推测原溶液中含有NH ;据实验③推测原溶液中含有CO 和SO ,则一定不含Mg2+、Ba2+。而仅据题意无法判断原溶液中是否含有Cl-。
(2)由题意知:NH 的物质的量等于NH3的物质的量,为0.04 mol;实验③中的沉淀6.27 g为BaCO3和BaSO4的混合物,其中BaSO4的质量为2.33 g,即为0.01 mol,则SO 的物质的量为0.01 mol;其中BaCO3的质量为6.27 g-2.33 g=3.94 g,即为0.02 mol;故可计算出CO 的浓度为0.2 mol/L,SO 的浓度为0.1 mol/L。
(3)可根据溶液中所有阴、阳离子的总电荷代数和为零予以判断,K+一定存在。
变式训练4 某溶液中含有SO 、CO 、OH-、Cl-四种阴离子,若只允许取一次该溶液而把四种离子分别检验出来,则应采取什么样的措施(能写出离子方程式的,写出每检验出一种离子时的离子方程式,若不能写出离子方程式,请写“无”)。
(1)先检验 ;加入 试剂。
离子方程式:无。
(2)然后检验 ;加入 试剂。
离子方程式:
。
(3)再检验 ;加入 试剂。
离子方程式: 。
(4)最后检验 ;加入 试剂。
离子方程式: 。
H++OH- H2O,CO +2H+
OH-
酚酞
HNO3
H2O+CO2↑
SO
CO
Ba(NO3)2
SO +Ba2+ BaSO4↓
Cl-
AgNO3
Ag++Cl- AgCl↓
1.下列各组物质中,仅用水及物质间相互反应不能一
一区别的一组是 ( )
A.Na2O2、Al2(SO4)3、MgCl2、K2CO3
B.BaCl2、Na2SO4、(NH4)2SO4、KOH
C.AgNO3、NaCl、KCl、CuCl2
D.Fe2(SO4)3、K2CO3、KHSO4、NH4Cl
解析 A选项可按下列顺序区别:Na2O2(淡黄色)→生成白色沉淀且不溶解的为MgCl2,生成白色沉淀又溶解的为Al2(SO4)3,最后剩余K2CO3;B选项可用两两相混的方法来区别;D选项的检出顺序为:Fe2(SO4)3→K2CO3→KHSO4→NH4Cl;C选项不能区别,故正确答案为C项。
C
2.下述实验能达到预期目的的是 ( )
解析 A选项可证明SO2的还原性,不能达到目的;
B选项可达到目的;由于乙酸和乙醇的反应为可逆反应,故C选项不能达到目的;NH 、Fe3+皆可与碱作用,故D选项不能达到目的,本题答案为B项。
B
编号 实验内容 实验目的
A 将SO2通入溴水中 验证SO2具有漂白性
B 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去 验证Na2CO3溶液中存在水解平衡
C 加入乙醇和浓硫酸,加热、静置、分液 除去乙酸乙酯中混有的少量乙酸
D 向溶液中滴加适量氢氧化钠溶液,过滤 除去氯化铵溶液中的氯化铁
3.现有含NaCl、Na2SO4和NaNO3的混合溶液,选择
适当的试剂将其转化为相应的沉淀或固体,从而实
现Cl-和NO 的相互分离。相应的实验过程如下:
下列关于四种试剂顺序正确的是 ( )
A.氯化钡溶液、硝酸银溶液、碳酸钠溶液、硝酸溶液
B.硝酸银溶液、氯化钡溶液、碳酸钠溶液、硝酸溶液
C.氯化钡溶液、硝酸银溶液、硝酸溶液、碳酸钠溶液
D.硝酸银溶液、碳酸钠溶液、氯化钡溶液、硝酸溶液
解析 Cl-可用AgNO3沉淀,SO 可用Ba2+沉淀,由于Ag2SO4微溶于水,故SO 的除去应在Cl-之前;由于加入的试剂是过量的,所以过量的AgNO3、BaCl2必须除去,可选用Na2CO3,而过量的Na2CO3可用稀HNO3来除去,所以正确答案为A项。
答案 A
4.某澄清溶液中可能含有①H+、②Na+、③Fe3+、
④NO 、⑤I-中的某几种,若向此溶液中加
AgNO3溶液有不溶性物质析出;若向此溶液中加
铜片和浓H2SO4并加热,有红棕色气体放出,则此
溶液中肯定不存在的离子是 ( )
A.②③ B.①② C.①③ D.②⑤
C
5.化学实验中的很多气体是用盐酸来制取的,
这就导致了制取的气体中往往含有HCl杂
质,要除去HCl杂质而得到纯净的目标气
体,可用图示装置。如果广口瓶盛装的是
饱和NaHCO3溶液,则可以用于下列哪种气
体的除杂装置 ( )
A.H2 B.Cl2 C.H2S D.CO2
D
6.在进行化学实验和科学探究时,下列叙述中正确的
是 ( )
A.欲配制质量分数为10%的CuSO4溶液,可将10 g
CuSO4·5H2O溶解在90 g水中
B.用托盘天平称取8.75 g食盐
C.用洗气瓶中的NaHCO3溶液除去CO2中混有的SO2
气体
D.向某溶液中加入氯化钡溶液有白色沉淀产生,再
加盐酸,沉淀不消失,该溶液中一定含有SO
C
7.下表为各物质中所含有的少量杂质,以及除去杂质
所选用的试剂或操作方法:
序号 物质 杂质 除杂质应选用的试剂
或操作方法
① KNO3溶液 KOH 加入FeCl3溶液,并过滤
② FeSO4溶液 CuSO4 加入过量铁粉,并过滤
③ H2 CO2 通过盛有NaOH溶液的洗
气瓶,再通过盛有浓硫酸
的洗气瓶
④ NaNO3 CaCO3 溶解、过滤、蒸发
正确的一组为 ( )
A.①②③④ B.③④ C.②③④ D.①②③
解析 KNO3中的KOH应用稀HNO3除去,①不正确;②③④各项皆正确。
C
8.某钠盐溶液可能含有阴离子NO 、CO 、SO 、SO 、
Cl-、Br-、I-,为鉴别这些离子,分别取少量溶液进
行以下实验:①测得混合液呈碱性;②加HCl后,生
成无色无味气体,该气体能使澄清石灰水变浑浊;
③加CCl4后,滴加少量氯水,振荡后CCl4层未变
色;④加BaCl2溶液产生白色沉淀,分离,在沉淀中
加入足量盐酸,沉淀不能完全溶解;⑤加HNO3酸化
后,再加过量AgNO3溶液,溶液中析出白色沉淀。
下列说法正确的是 ( )
A.溶液中肯定含有CO 、SO 、SO
B.溶液肯定不含有Br-、I-、Cl-
C.溶液中可能含有NO
D.以上说法均不正确
C
9.实验室有一份混有少量碳酸
钙杂质的碳酸钡样品[Ba(OH)2
和Ca(OH)2的溶解度曲线如图所
示]。分离并提纯碳酸钡的实
验步骤如下:①高温灼烧碳酸
钡和碳酸钙的混合物,直至分解。②将灼烧后的固
体混合物置于80℃的热水中,制成氢氧化钡的热饱
和溶液,趁热过滤。③冷却结晶,将滤液过滤,得
到的Ba(OH)2固体溶于水制成溶液。④通入二氧化
碳,滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净
的碳酸钡。下列叙述有错误的是 ( )
A.高温灼烧所需的仪器有坩埚、泥三角、玻璃棒、
三脚架、坩埚钳、酒精喷灯
B.步骤②中趁热过滤的目的是减少Ba(OH)2的损失并
除去不溶物
C.过滤过程中所需要的玻璃仪器有玻璃棒、漏斗、
烧杯
D.步骤④中可加入石蕊溶液,通过观察溶液颜色变
化判断是否需要继续通入二氧化碳
答案 D
10.硫酸铜在加热条件下发生分解反应,生成氧化铜、
二氧化硫、三氧化硫和氧气。某探究性学习小组
设计了如下实验装置检验硫酸铜的分解产物并测
定硫酸铜的分解率。
试填写下列空白:
(1)按装置从左至右排列,实验时各仪器接口的排列顺序为 。
(2)装置F的作用是 ,发生反应的化学方程式为 。
(3)装置D的作用是 。
(4)实验开始前,准确称量无水硫酸铜9.6 g,实验结束后,装置F质量减少了0.48 g,干燥管C质量增加2.56 g,量筒中收集到224 mL水的体积(折算成标准状况)。则硫酸铜在加热条件下发生分解反应的化学方程式为 ,其分解率为 。
①⑨⑩⑥⑤③④⑧⑦②
吸收SO3
2NaHSO3+SO3 Na2SO4+2SO2+H2O
干燥SO2和O2
3CuSO4 3CuO+SO3↑+O2↑+2SO2↑
50%
解析 根据2NaHSO3+SO3 Na2SO4+2SO2+H2O;Δm=48,则n(SO3)= mol=0.01 mol,生成的n(SO2) =0.02 mol,干燥管中增重的质量为SO2的质量,包括装置A中分解的和通过F中新生成的,n(SO2)=
=0.04 mol,则分解产生的n(SO2)=0.02 mol。B中排出水的体积为O2的体积,n(O2)= =0.01 mol。则从①出来的气体中n(SO2)∶n(O2)∶n(SO3)=0.02 ∶0.01∶0.01
=2∶1∶1,CuSO4的分解率为 ×100%=50%。
11.某无色透明溶液可能含有下列离子:K+、Al3+、
Fe3+、Ba2+、NO 、SO 、HCO 、Cl-,取该溶液
进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无
色气体,该气体遇空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续
加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生
白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是 (填代号)。
BD
(2)根据上述实验判断原溶液中肯定存在的离子是
,肯定不存在的离子是
。
(3)写出与②③两个实验有关的离子方程式:
② ;
③ 。
Al3++3NH3·H2O Al(OH)3↓+3NH
Al3+、NO 、SO
Fe3+ 、
Ba2+、HCO
3Cu+8H++2NO 3Cu2++2NO↑+4H2O
12.某同学在探究废干电池内的黑色固体的回收利用
时,进行如图所示实验:
查阅教材可知,普通锌锰电池的黑色物质主要成
分为MnO2、NH4Cl、ZnCl2等物质。请回答以下
问题:
(1)操作①的名称是 ;操作②的名称是 ;
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、 和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为 。
(3)操作④的试管中加入③所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
溶解
过滤
坩埚
泥三角
碳
MnO2(或二氧化锰)
取少许滤液于试管中,加入
取少许滤液于试管中,加入
NaOH溶液,并
将湿润的红色石
蕊试纸置于试管
口附近
酸化的AgNO3
含有Zn2+
先产生白色沉淀,继续加入氨水,沉淀又溶解
取少许滤液于试管中,加入稀氨水
3.检验
Zn2+
含有NH
2.检验
NH
含有Cl-
1.检验
Cl-
结论
实验现象
操作
实验目的
HNO3
溶液
有白色沉淀产生
红色石蕊试纸变蓝
浓
(5)根据以上的实验报告,关于滤液的成分,他的结论是:滤液中含有氯化铵和氯化锌。若想从滤液中得到溶质固体,还应进行的操作是 、
、 。若要将所得的溶质固体中的物质加以分离,可用 法。
加热蒸发
冷却结晶
过滤
加热
13.下图虚线框中的装置可用来检验浓硫酸与木炭粉
在加热条件下反应产生的所有气体产物,填写下
列空白:
(1)如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检验出的物质是 ;不能检出的物质是 。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是 ;不能检出的物质是 。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是 ;不能检出的物质是 。
SO2、CO2
H2O
H2O
CO2、SO2
SO2、CO2
H2O
解析 浓硫酸与木炭加热发生反应的化学方程式为2H2SO4(浓)+C CO2↑+2SO2↑+2H2O。纵观整套装置,①用于检验水蒸气(使无水硫酸铜变蓝);
②用于检验SO2气体(品红溶液褪色、酸性KMnO4溶液褪色或颜色变浅,再通过品红溶液验证SO2是否已经除净);③用于检验CO2气体(澄清石灰水变浑浊)。(1)当顺序改为②、①、③时,由于气体先
经②装置,必然带出洗气瓶中的水蒸气,故难以肯定①中无水硫酸铜变蓝是由浓硫酸与木炭反应所产生的H2O造成的。(2)当顺序改变为①、③、②时,足量澄清石灰水变浑浊究竟是由CO2还是由SO2与Ca(OH)2反应造成的,无法肯定,所以CO2与SO2都无法一一鉴别。(3)当顺序改为②、③、①时,出现与(1)中同样的问题。
返回
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
