化学精品课件:专题5课题1《原电池》(苏教版选修6)(共23张PPT)
文档属性
| 名称 | 化学精品课件:专题5课题1《原电池》(苏教版选修6)(共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-25 00:00:00 | ||
图片预览







文档简介
(共26张PPT)
专题5课题1《原电池》
(苏教版选修6)
生活中我们常使用各种各样的电池
用于“神七”的太阳能电池
笔记本电脑专用电池
手机专用电池
原电池的工作原理
温故知新
1、原电池:把化学能转化为电能的装置。
2、构成原电池的条件
(1)有二种活泼性不同的金属(或金属与非金属) 做电极;
(2)两电极在电解质溶液中;
(3)形成闭合回路;
(4)有自发的氧化还原反应。
(极、电、路、自发)
原电池的工作原理
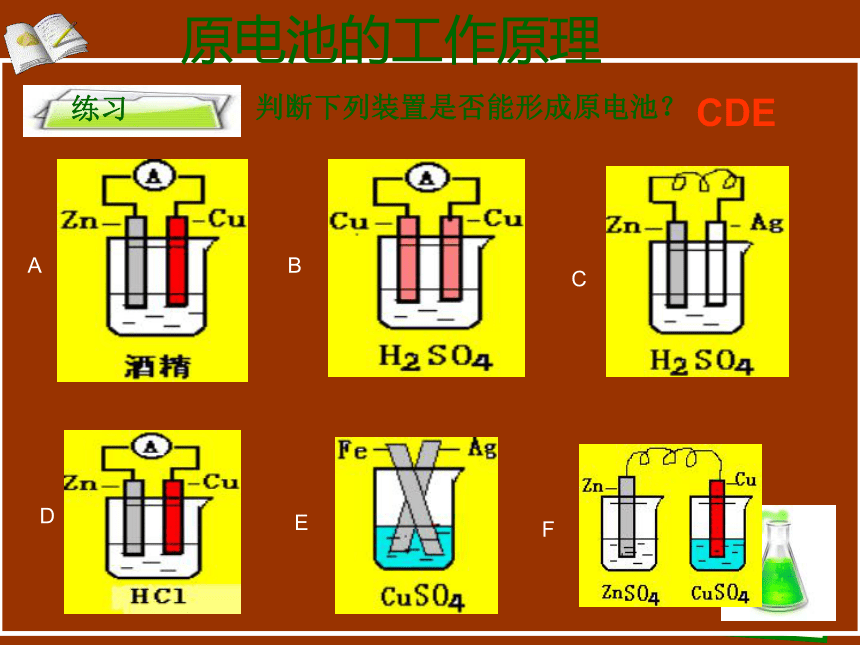
练习
判断下列装置是否能形成原电池?
A
B
C
D
E
F
CDE
原电池的工作原理
自主探究1
实验1. 将锌片加入CuSO4溶液中,测量溶液温度的变化,分析能量变化的情况。记录实验1的现象和结论。
现象:
锌片溶解,有红色物质析出,温度计显示温度迅速上升.
结论(反应的实质):
Zn+ Cu2+ = Zn2+ + Cu
化学能 热能
原电池的工作原理
自主探究1
实验2. 如果锌片加入CuSO4溶液的反应是放热反应,
请设计实验将该反应释放的能量转化为电能并
实施你所设计的实验。
试剂和仪器:CuSO4溶液,锌片,铜片,温度
计,检流计,导线,大烧杯。
思考并设计实验方案,预测实验2的现象和结论。
原电池的工作原理
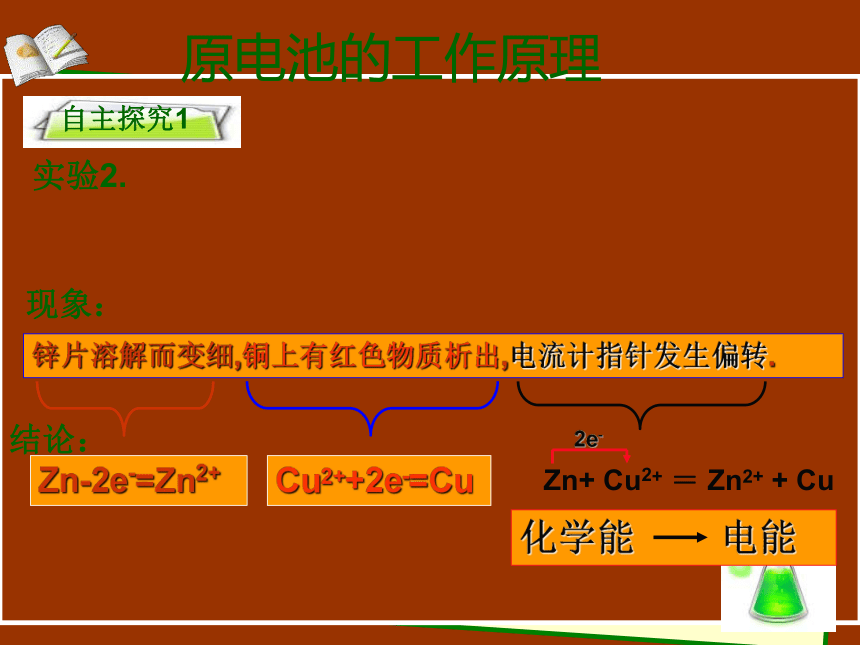
实验2.
自主探究1
现象:
结论:
锌片溶解而变细,铜上有红色物质析出,电流计指针发生偏转.
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+ Cu2+ = Zn2+ + Cu
2e-
化学能 电能
原电池的工作原理
A
锌
e-
e-
—
铜
SO42-
Cu2+
SO42-
Cu2+
Cu2+
Zn2+
Cu2+
Cu2+
SO42-
CuSO4溶液
Cu2+
SO42-
e-
e-
e-
e-
+
思考与讨论
该电池的电子流向?电极反应?
原电池的工作原理
原理分析:
负极: 氧化反应
正极: 还原反应
1、电极反应
Zn-2e- Zn2+
Cu2++2e- Cu
锌片失去电子,铜离子得到电子,两极之间溶液离子的定向移动和外部导线中电子的定向移动,构成闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流。
总反应:Zn+ Cu2+ = Zn2+ + Cu
原电池的工作原理
A
锌
镁
ZnSO4溶液
如果用比锌活泼的金属镁代替铜片,用ZnSO4溶液代替CuSO4溶液与锌组成原电池,如何判断正负极?锌片上将发生什么电极反应?
思考
原电池的工作原理
电极反应式:
Mg-2e-+2OH- Mg(OH)2
2H2O+2e- H2 ↑+2 OH-
负极(—):失去电子——氧化反应
正极( + ):得到电子——还原反应
思考
原电池中电极反应的反应物一定来源于电极材料和电解质溶液吗?
原电池的工作原理
思考:
Cu
Zn
下列装置能否实现化学能向电能的转化?如果不行,将如何改进使其形成原电池?
ZnSO4溶液
CuSO4溶液
原电池的工作原理
思考:
Cu
Zn
ZnSO4溶液
CuSO4溶液
盐桥:在U形管中装满用饱和KCl溶液和琼胶作成的冻胶。
改进的装置:
原电池的工作原理
交流研讨:
1、在盐桥插入之前,检流计指针是否发生偏转?
2、在盐桥插入之后,检流计指针是否发生偏转?
3、左右烧杯中各发生了什么反应?
4、该装置与普通锌铜原电池相比,有什么不同的地方?
半电池:包括电极材料和电解质溶液,两个隔离的半电池通过盐桥连接起来。
原电池的工作原理
盐桥的作用:使Cl-向锌盐方向移动,K+向铜盐方向移
动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子
不断从Zn极流向Cu极,使电流持续传导。
Zn-2e-=Zn2+
Cu2++2e-=Cu
总反应:Zn+ Cu2+ = Zn2+ + Cu
原电池的氧化反应和还原反应分别在两个电极上进行,两个原电池装置本质上是完全相同的。
原电池的工作原理
练习:
为获得较长时间的稳定电流,如何将由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?
Cu
Zn
H2SO4
A
ZnSO4
H2SO4
A
Zn
Cu
你知道了吗
随堂检测
1、把金属甲和乙分别插入稀硫酸中,观察到金属甲表面有气泡产生,金属乙表面无气泡产生,此实验说明甲的金属活动性比乙的 ;若把这两种金属用导线连接后平行插入稀硫酸中,则可观察到金属 的表面有气泡产生,一段时间后金属 的质量减少。
强
乙
甲
2、已知氧化还原反应
Cu + 2FeCl3 = 2FeCl2 + CuCl2,
利用这一反应设计一个原电池,画出示意图,
标出电极材料,电解质溶液,写出电极反应式。
CuCl2
FeCl3
A
Cu
C
正极:
负极:
总反应:
Cu Cu2+ +2e-
2Fe3++2e- 2Fe2+
2Fe3++Cu=2Fe2++Cu2+
Cu
Zn
2e-
Cu2+
2e-
Cu2+
Cu
Cu
Zn2+
CuSO4溶液
Zn2+
Cu
Zn
2e-
Cu2+
2e-
Cu2+
Cu
Cu
Zn2+
CuSO4溶液
Zn2+
专题5课题1《原电池》
(苏教版选修6)
生活中我们常使用各种各样的电池
用于“神七”的太阳能电池
笔记本电脑专用电池
手机专用电池
原电池的工作原理
温故知新
1、原电池:把化学能转化为电能的装置。
2、构成原电池的条件
(1)有二种活泼性不同的金属(或金属与非金属) 做电极;
(2)两电极在电解质溶液中;
(3)形成闭合回路;
(4)有自发的氧化还原反应。
(极、电、路、自发)
原电池的工作原理
练习
判断下列装置是否能形成原电池?
A
B
C
D
E
F
CDE
原电池的工作原理
自主探究1
实验1. 将锌片加入CuSO4溶液中,测量溶液温度的变化,分析能量变化的情况。记录实验1的现象和结论。
现象:
锌片溶解,有红色物质析出,温度计显示温度迅速上升.
结论(反应的实质):
Zn+ Cu2+ = Zn2+ + Cu
化学能 热能
原电池的工作原理
自主探究1
实验2. 如果锌片加入CuSO4溶液的反应是放热反应,
请设计实验将该反应释放的能量转化为电能并
实施你所设计的实验。
试剂和仪器:CuSO4溶液,锌片,铜片,温度
计,检流计,导线,大烧杯。
思考并设计实验方案,预测实验2的现象和结论。
原电池的工作原理
实验2.
自主探究1
现象:
结论:
锌片溶解而变细,铜上有红色物质析出,电流计指针发生偏转.
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+ Cu2+ = Zn2+ + Cu
2e-
化学能 电能
原电池的工作原理
A
锌
e-
e-
—
铜
SO42-
Cu2+
SO42-
Cu2+
Cu2+
Zn2+
Cu2+
Cu2+
SO42-
CuSO4溶液
Cu2+
SO42-
e-
e-
e-
e-
+
思考与讨论
该电池的电子流向?电极反应?
原电池的工作原理
原理分析:
负极: 氧化反应
正极: 还原反应
1、电极反应
Zn-2e- Zn2+
Cu2++2e- Cu
锌片失去电子,铜离子得到电子,两极之间溶液离子的定向移动和外部导线中电子的定向移动,构成闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流。
总反应:Zn+ Cu2+ = Zn2+ + Cu
原电池的工作原理
A
锌
镁
ZnSO4溶液
如果用比锌活泼的金属镁代替铜片,用ZnSO4溶液代替CuSO4溶液与锌组成原电池,如何判断正负极?锌片上将发生什么电极反应?
思考
原电池的工作原理
电极反应式:
Mg-2e-+2OH- Mg(OH)2
2H2O+2e- H2 ↑+2 OH-
负极(—):失去电子——氧化反应
正极( + ):得到电子——还原反应
思考
原电池中电极反应的反应物一定来源于电极材料和电解质溶液吗?
原电池的工作原理
思考:
Cu
Zn
下列装置能否实现化学能向电能的转化?如果不行,将如何改进使其形成原电池?
ZnSO4溶液
CuSO4溶液
原电池的工作原理
思考:
Cu
Zn
ZnSO4溶液
CuSO4溶液
盐桥:在U形管中装满用饱和KCl溶液和琼胶作成的冻胶。
改进的装置:
原电池的工作原理
交流研讨:
1、在盐桥插入之前,检流计指针是否发生偏转?
2、在盐桥插入之后,检流计指针是否发生偏转?
3、左右烧杯中各发生了什么反应?
4、该装置与普通锌铜原电池相比,有什么不同的地方?
半电池:包括电极材料和电解质溶液,两个隔离的半电池通过盐桥连接起来。
原电池的工作原理
盐桥的作用:使Cl-向锌盐方向移动,K+向铜盐方向移
动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子
不断从Zn极流向Cu极,使电流持续传导。
Zn-2e-=Zn2+
Cu2++2e-=Cu
总反应:Zn+ Cu2+ = Zn2+ + Cu
原电池的氧化反应和还原反应分别在两个电极上进行,两个原电池装置本质上是完全相同的。
原电池的工作原理
练习:
为获得较长时间的稳定电流,如何将由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?
Cu
Zn
H2SO4
A
ZnSO4
H2SO4
A
Zn
Cu
你知道了吗
随堂检测
1、把金属甲和乙分别插入稀硫酸中,观察到金属甲表面有气泡产生,金属乙表面无气泡产生,此实验说明甲的金属活动性比乙的 ;若把这两种金属用导线连接后平行插入稀硫酸中,则可观察到金属 的表面有气泡产生,一段时间后金属 的质量减少。
强
乙
甲
2、已知氧化还原反应
Cu + 2FeCl3 = 2FeCl2 + CuCl2,
利用这一反应设计一个原电池,画出示意图,
标出电极材料,电解质溶液,写出电极反应式。
CuCl2
FeCl3
A
Cu
C
正极:
负极:
总反应:
Cu Cu2+ +2e-
2Fe3++2e- 2Fe2+
2Fe3++Cu=2Fe2++Cu2+
Cu
Zn
2e-
Cu2+
2e-
Cu2+
Cu
Cu
Zn2+
CuSO4溶液
Zn2+
Cu
Zn
2e-
Cu2+
2e-
Cu2+
Cu
Cu
Zn2+
CuSO4溶液
Zn2+
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
