[举一反三]多方面考察“中和反应”
图片预览


文档简介
[举一反三]多方面考察“中和反应”
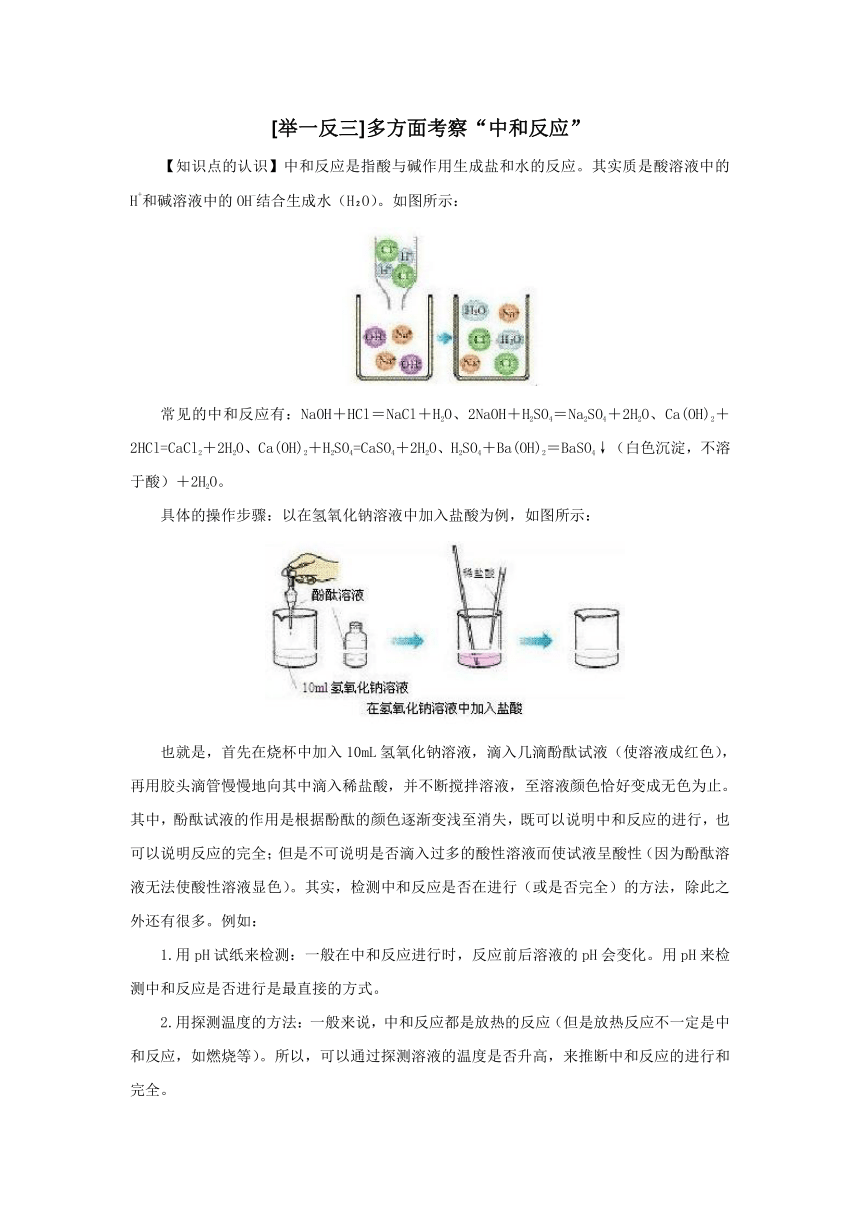
【知识点的认识】中和反应是指酸与碱作用生成盐和水的反应。其实质是酸溶液中的H+和碱溶液中的OH-结合生成水(H O)。如图所示:
常见的中和反应有:NaOH+HCl=NaCl+H2O、2NaOH+H2SO4=Na2SO4+2H2O、Ca(OH)2+2HCl=CaCl2+2H2O、Ca(OH)2+H2SO4=CaSO4+2H2O、H2SO4+Ba(OH)2=BaSO4↓(白色沉淀,不溶于酸)+2H2O。
具体的操作步骤:以在氢氧化钠溶液中加入盐酸为例,如图所示:
也就是,首先在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液(使溶液成红色),再用胶头滴管慢慢地向其中滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。其中,酚酞试液的作用是根据酚酞的颜色逐渐变浅至消失,既可以说明中和反应的进行,也可以说明反应的完全;但是不可说明是否滴入过多的酸性溶液而使试液呈酸性(因为酚酞溶液无法使酸性溶液显色)。其实,检测中和反应是否在进行(或是否完全)的方法,除此之外还有很多。例如:
1.用pH试纸来检测:一般在中和反应进行时,反应前后溶液的pH会变化。用pH来检测中和反应是否进行是最直接的方式。
2.用探测温度的方法:一般来说,中和反应都是放热的反应(但是放热反应不一定是中和反应,如燃烧等)。所以,可以通过探测溶液的温度是否升高,来推断中和反应的进行和完全。
至于中和反应的应用,主要有如下四点:
1.改变土壤的酸碱性:根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,以调节土壤的酸碱性,利于植物生长。例如,近年来由于空气污染造成酸雨,还有有机物在分解的过程中会生成有机酸,并且矿物的风化也可能产生酸性物质,导致一些地方的土壤呈酸性,不利于作物的生长;于是人们将适量的熟石灰撒入土壤中,以中和其酸性。同时,促进微生物的繁殖,并且土壤中的钙离子增加后,能促使土壤胶体凝结,有利于形成团粒,还可供给植物生长所需的钙元素。如图所示:
2.处理工厂的废水:工厂里的废水常呈现酸性或碱性,若直接排放将会造成水污染,所以需进行一系列的处理。碱性污水需用酸来中和,酸性污水需用碱来中和。例如,硫酸厂的污水中含有硫酸等杂质,可以用适量的熟石灰来进行中和处理(生成硫酸钙沉淀和水)。
3.用于医药:人的胃液里含有适量的盐酸(即胃液的pH值为0.9~1.5),可以帮助消化食物;但是如果饮食过量时,胃会分泌出大量胃酸,反而造成消化不良,会使人感到不适,这时医生就会让你口服一些碱性药物,使碱与过多胃酸反应生成无毒的中性物质。例如,用含氢氧化铝的药片可治疗胃酸过多,生成氯化铝和水。 另外,被蚊虫叮咬后,蚊虫能在人的皮肤内分泌出蚁酸,从而使皮肤肿痛。如果在患处涂一些含有碱性物质(如NH3 H2O)的药水,来中和蚊虫分泌出的蚁酸,就可减轻痛痒。
4.调节溶液酸碱性:在科学实验时,经常要把溶液的pH控制在一定范围内,如果溶液的酸性或碱性太强,就可以用适当的碱或酸调节溶液的pH。
【命题方向】该考点的命题方向主要是通过创设相关实验、问题情景或图表信息等,来考查学生对中和反应及其应用的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力。并且,经常将其与“酸碱指示剂及其性质、酸的化学性质及其用途、碱的化学性质及其用途、溶液pH的测定、化学反应时的能量变化、复分解反应及其发生的条件、物质的推断和鉴别、化学方程式的书写、有关实验操作(或现象、结论)”等相关知识联系起来,进行综合考查。当然,有时也单独考查之。题型有选择题、填空题、实验探究题和计算题。中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对中和反应及其应用等相关知识的理解和掌握情况,以及运用它们来分析、解答相关的实际问题的能力等。当然,有时还会根据所给的有关的表达,来评价表达的正误,或者注意事项等。特别是,对中和反应的定义及其操作过程(包括判断反应是否进行和完全)、有关的反应现象及化学方程式的书写、前三个应用,以及知识的迁移能力的考查,是近几年中考命题的热点,并且还是中考考查这块知识的重中之重。
母题:我市捞刀河某化工厂发生硫酸泄漏事件。为了减少硫酸对环境的污染,有关部门采取了紧急措施,在泄漏的硫酸上面喷洒了一种化学试剂,你认为这种试剂是
A.熟石灰 B.硫酸铜
C.食盐 D.干冰
解析 硫酸为酸性物质,泄漏后易渗入土壤,使土壤酸化,不利于农作物的生成,污染地下水,要减少硫酸对环境的污染,就要降低他的酸性,如我们可以在硫酸上面喷洒熟石水,中和硫酸的酸性。
答案:A
变式题一:小华同学用右图所示装置进行中和反应实验,反应后为确定硫酸和氢氧化钠是否刚好完全反应,他取出一定量反应后的溶液于一支试管中,向其中滴入几滴无色酚酞试液,振荡,观察到酚酞试液不变色,于是他得出“两种物质已恰好完全中和”的结论。
(1)写出该中和反应的化学方程式 。
(2)小亮认为小华的结论不准确,他认为除了“恰好中和”外还有第二种可能性,这种可能性是 。
(3)请你另外设计一个实验,探究上述烧杯中的溶液是否恰好完全中和。填写下表(选择甲、乙中的一个作答):
实验 实验操作 实验现象 实验结论
甲 恰好中和
乙 第二种可能性
解析:该题考察中和反应的产物。酸碱中和生成盐和水,硫酸和氢氧化钠发生的反应为:H2SO4+2NaOH===Na2SO4+2H2O。酚酞试液遇碱变红,遇中性和酸性溶液不变色,反应后的溶液中滴入酚酞试液不变色,则说明反应后的溶液不显碱性,则可能是恰好完全中和,也可能硫酸过量显酸性。为了确定反应属于哪种情况,其实质是验证硫酸的存在,根据酸的性质可分别加入指示剂、活泼金属、金属氧化物、碳酸盐等物质。
答案:(1)2NaOH+H2SO4=Na2SO4+2H2O (2)硫酸过量
(3)选择甲:取样,滴加紫色石蕊试液 试液不变色(或:取样,加入碳酸钠溶液 无气泡产生 或:取样,加入锌粒等活泼金属 无气泡产生)
选择乙:取样,滴加紫色石蕊试液 试液变红色(或:取样,加入碳酸钠溶液 有气泡产生 或:取样,加入锌粒等活泼金属 有气泡产生)
变式题二:中和反应在日常生活和工农业生产中有广泛的应用。某化学兴趣小组的同学在老师的指导下对酸碱中和反应进行了探究。
提示问题:能否用碳酸钾溶液验证硫酸与氢氧化钠溶液发生了中和反应?
实验药品:稀硫酸、稀氢氧化钠溶液、碳酸钾溶液。
实验仪器:试管、滴管、100mL量筒等。
设计方案并实验:小江同学的实验:在试管中加入2mL稀硫酸,逐滴加入①溶液,振荡后,再滴入②溶液,实验过程中无气泡逸出。反应的化学方程式为 ③ 。
小伟同学的实验:在试管中加入2mL稀硫酸,逐滴加入氢氧化钠溶液,振荡后,再滴入碳酸钾溶液,有气泡逸出,继续滴加碳酸钾溶液至恰好无气泡时,共消耗碳酸钾溶液。
小明同学的判断:小江的实验说明能用碳酸钾溶液来验证:小伟的实验还不能,需再做一个实验才能说明。
实验并判断:另取一支试管,加入2mL稀硫酸, ④ (写出实验步骤、现象和判断依据)。
结论:能用碳酸钾溶液验证硫酸与氢氧化钠溶液发生了中和反应。
反思:在小江的实验中,碳酸钾溶液的作用是 ⑤ (填字母)。
A、仅是反应物
B、相当于指示剂
C、作催化剂
分析:此题是一道关于中和反应的综合性实验探究题。在小江同学的实验中,先向稀硫酸中逐滴加入氢氧化钠溶液,再滴入碳酸钾溶液,实验过程中无气泡逸出,说明加入氢氧化钠溶液后的溶液中已经没有稀硫酸,则证明稀硫酸与氢氧化钠溶液发生了中和反应,在此实验中碳酸钾溶液起到了指示剂的作用。在小伟的实验中,加入碳酸钾溶液时有气泡逸出,说明溶液中稀硫酸,因此,该实验不能证明稀硫酸与氢氧化钠溶液发生了中和反应。要证明稀硫酸与氢氧化钠溶液发生了中和反应,需补充如下实验:向2mL稀硫酸中直接滴加碳酸钾溶液至无气泡产生,记录消耗碳酸钾溶液的体积,若此体积大于小伟的实验中消耗的碳酸钾溶液的体积,则证明在小伟的实验中稀硫酸与氢氧化钠溶液发生了中和反应。
答案:① ② ③ ④逐滴加入碳酸钾溶液至无气泡产生,记录消耗的碳酸钾溶液的体积为,⑤B
点评:此题在以往对中和反应探究考查的基础上又有所拓展,从定量研究的角度对同学们提出了要求。很多同学由于基础知识掌握不牢固,心理素质较差,缺乏分析推理和实验探究能力而不能顺利解答此类综合性问题。
【解题方法点拨】要想解答好这类题目,首先,要理解和熟记中和反应及其应用等相关知识。然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。同时,还需要注意以下三点:
1.中和反应是指酸与碱作用生成盐和水的反应。但是,不能反过来说生成盐和水的反应是中和反应。因为非金属氧化物与碱作用也能生成盐和水(如二氧化碳与澄清的石灰水的反应),可它就不是中和反应;还有酸与金属氧化物作用也能生成盐和水(如用稀盐酸出铁锈的反应),可它也不是中和反应。
2.中和反应一定是复分解反应,但是复分解反应不一定是中和反应;只有酸和碱之间的反应才是中和反应。
3. 在做中和反应的实验时,由于酸和碱的溶液一般是无色,二者反应时的现象不明显,所以往往借助于一些试剂或仪器等(如酸碱指示剂、pH试纸、温度计等),来帮助我们判断反应是否进行或恰好完全。
【知识点的认识】中和反应是指酸与碱作用生成盐和水的反应。其实质是酸溶液中的H+和碱溶液中的OH-结合生成水(H O)。如图所示:
常见的中和反应有:NaOH+HCl=NaCl+H2O、2NaOH+H2SO4=Na2SO4+2H2O、Ca(OH)2+2HCl=CaCl2+2H2O、Ca(OH)2+H2SO4=CaSO4+2H2O、H2SO4+Ba(OH)2=BaSO4↓(白色沉淀,不溶于酸)+2H2O。
具体的操作步骤:以在氢氧化钠溶液中加入盐酸为例,如图所示:
也就是,首先在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液(使溶液成红色),再用胶头滴管慢慢地向其中滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。其中,酚酞试液的作用是根据酚酞的颜色逐渐变浅至消失,既可以说明中和反应的进行,也可以说明反应的完全;但是不可说明是否滴入过多的酸性溶液而使试液呈酸性(因为酚酞溶液无法使酸性溶液显色)。其实,检测中和反应是否在进行(或是否完全)的方法,除此之外还有很多。例如:
1.用pH试纸来检测:一般在中和反应进行时,反应前后溶液的pH会变化。用pH来检测中和反应是否进行是最直接的方式。
2.用探测温度的方法:一般来说,中和反应都是放热的反应(但是放热反应不一定是中和反应,如燃烧等)。所以,可以通过探测溶液的温度是否升高,来推断中和反应的进行和完全。
至于中和反应的应用,主要有如下四点:
1.改变土壤的酸碱性:根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,以调节土壤的酸碱性,利于植物生长。例如,近年来由于空气污染造成酸雨,还有有机物在分解的过程中会生成有机酸,并且矿物的风化也可能产生酸性物质,导致一些地方的土壤呈酸性,不利于作物的生长;于是人们将适量的熟石灰撒入土壤中,以中和其酸性。同时,促进微生物的繁殖,并且土壤中的钙离子增加后,能促使土壤胶体凝结,有利于形成团粒,还可供给植物生长所需的钙元素。如图所示:
2.处理工厂的废水:工厂里的废水常呈现酸性或碱性,若直接排放将会造成水污染,所以需进行一系列的处理。碱性污水需用酸来中和,酸性污水需用碱来中和。例如,硫酸厂的污水中含有硫酸等杂质,可以用适量的熟石灰来进行中和处理(生成硫酸钙沉淀和水)。
3.用于医药:人的胃液里含有适量的盐酸(即胃液的pH值为0.9~1.5),可以帮助消化食物;但是如果饮食过量时,胃会分泌出大量胃酸,反而造成消化不良,会使人感到不适,这时医生就会让你口服一些碱性药物,使碱与过多胃酸反应生成无毒的中性物质。例如,用含氢氧化铝的药片可治疗胃酸过多,生成氯化铝和水。 另外,被蚊虫叮咬后,蚊虫能在人的皮肤内分泌出蚁酸,从而使皮肤肿痛。如果在患处涂一些含有碱性物质(如NH3 H2O)的药水,来中和蚊虫分泌出的蚁酸,就可减轻痛痒。
4.调节溶液酸碱性:在科学实验时,经常要把溶液的pH控制在一定范围内,如果溶液的酸性或碱性太强,就可以用适当的碱或酸调节溶液的pH。
【命题方向】该考点的命题方向主要是通过创设相关实验、问题情景或图表信息等,来考查学生对中和反应及其应用的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力。并且,经常将其与“酸碱指示剂及其性质、酸的化学性质及其用途、碱的化学性质及其用途、溶液pH的测定、化学反应时的能量变化、复分解反应及其发生的条件、物质的推断和鉴别、化学方程式的书写、有关实验操作(或现象、结论)”等相关知识联系起来,进行综合考查。当然,有时也单独考查之。题型有选择题、填空题、实验探究题和计算题。中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对中和反应及其应用等相关知识的理解和掌握情况,以及运用它们来分析、解答相关的实际问题的能力等。当然,有时还会根据所给的有关的表达,来评价表达的正误,或者注意事项等。特别是,对中和反应的定义及其操作过程(包括判断反应是否进行和完全)、有关的反应现象及化学方程式的书写、前三个应用,以及知识的迁移能力的考查,是近几年中考命题的热点,并且还是中考考查这块知识的重中之重。
母题:我市捞刀河某化工厂发生硫酸泄漏事件。为了减少硫酸对环境的污染,有关部门采取了紧急措施,在泄漏的硫酸上面喷洒了一种化学试剂,你认为这种试剂是
A.熟石灰 B.硫酸铜
C.食盐 D.干冰
解析 硫酸为酸性物质,泄漏后易渗入土壤,使土壤酸化,不利于农作物的生成,污染地下水,要减少硫酸对环境的污染,就要降低他的酸性,如我们可以在硫酸上面喷洒熟石水,中和硫酸的酸性。
答案:A
变式题一:小华同学用右图所示装置进行中和反应实验,反应后为确定硫酸和氢氧化钠是否刚好完全反应,他取出一定量反应后的溶液于一支试管中,向其中滴入几滴无色酚酞试液,振荡,观察到酚酞试液不变色,于是他得出“两种物质已恰好完全中和”的结论。
(1)写出该中和反应的化学方程式 。
(2)小亮认为小华的结论不准确,他认为除了“恰好中和”外还有第二种可能性,这种可能性是 。
(3)请你另外设计一个实验,探究上述烧杯中的溶液是否恰好完全中和。填写下表(选择甲、乙中的一个作答):
实验 实验操作 实验现象 实验结论
甲 恰好中和
乙 第二种可能性
解析:该题考察中和反应的产物。酸碱中和生成盐和水,硫酸和氢氧化钠发生的反应为:H2SO4+2NaOH===Na2SO4+2H2O。酚酞试液遇碱变红,遇中性和酸性溶液不变色,反应后的溶液中滴入酚酞试液不变色,则说明反应后的溶液不显碱性,则可能是恰好完全中和,也可能硫酸过量显酸性。为了确定反应属于哪种情况,其实质是验证硫酸的存在,根据酸的性质可分别加入指示剂、活泼金属、金属氧化物、碳酸盐等物质。
答案:(1)2NaOH+H2SO4=Na2SO4+2H2O (2)硫酸过量
(3)选择甲:取样,滴加紫色石蕊试液 试液不变色(或:取样,加入碳酸钠溶液 无气泡产生 或:取样,加入锌粒等活泼金属 无气泡产生)
选择乙:取样,滴加紫色石蕊试液 试液变红色(或:取样,加入碳酸钠溶液 有气泡产生 或:取样,加入锌粒等活泼金属 有气泡产生)
变式题二:中和反应在日常生活和工农业生产中有广泛的应用。某化学兴趣小组的同学在老师的指导下对酸碱中和反应进行了探究。
提示问题:能否用碳酸钾溶液验证硫酸与氢氧化钠溶液发生了中和反应?
实验药品:稀硫酸、稀氢氧化钠溶液、碳酸钾溶液。
实验仪器:试管、滴管、100mL量筒等。
设计方案并实验:小江同学的实验:在试管中加入2mL稀硫酸,逐滴加入①溶液,振荡后,再滴入②溶液,实验过程中无气泡逸出。反应的化学方程式为 ③ 。
小伟同学的实验:在试管中加入2mL稀硫酸,逐滴加入氢氧化钠溶液,振荡后,再滴入碳酸钾溶液,有气泡逸出,继续滴加碳酸钾溶液至恰好无气泡时,共消耗碳酸钾溶液。
小明同学的判断:小江的实验说明能用碳酸钾溶液来验证:小伟的实验还不能,需再做一个实验才能说明。
实验并判断:另取一支试管,加入2mL稀硫酸, ④ (写出实验步骤、现象和判断依据)。
结论:能用碳酸钾溶液验证硫酸与氢氧化钠溶液发生了中和反应。
反思:在小江的实验中,碳酸钾溶液的作用是 ⑤ (填字母)。
A、仅是反应物
B、相当于指示剂
C、作催化剂
分析:此题是一道关于中和反应的综合性实验探究题。在小江同学的实验中,先向稀硫酸中逐滴加入氢氧化钠溶液,再滴入碳酸钾溶液,实验过程中无气泡逸出,说明加入氢氧化钠溶液后的溶液中已经没有稀硫酸,则证明稀硫酸与氢氧化钠溶液发生了中和反应,在此实验中碳酸钾溶液起到了指示剂的作用。在小伟的实验中,加入碳酸钾溶液时有气泡逸出,说明溶液中稀硫酸,因此,该实验不能证明稀硫酸与氢氧化钠溶液发生了中和反应。要证明稀硫酸与氢氧化钠溶液发生了中和反应,需补充如下实验:向2mL稀硫酸中直接滴加碳酸钾溶液至无气泡产生,记录消耗碳酸钾溶液的体积,若此体积大于小伟的实验中消耗的碳酸钾溶液的体积,则证明在小伟的实验中稀硫酸与氢氧化钠溶液发生了中和反应。
答案:① ② ③ ④逐滴加入碳酸钾溶液至无气泡产生,记录消耗的碳酸钾溶液的体积为,⑤B
点评:此题在以往对中和反应探究考查的基础上又有所拓展,从定量研究的角度对同学们提出了要求。很多同学由于基础知识掌握不牢固,心理素质较差,缺乏分析推理和实验探究能力而不能顺利解答此类综合性问题。
【解题方法点拨】要想解答好这类题目,首先,要理解和熟记中和反应及其应用等相关知识。然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。同时,还需要注意以下三点:
1.中和反应是指酸与碱作用生成盐和水的反应。但是,不能反过来说生成盐和水的反应是中和反应。因为非金属氧化物与碱作用也能生成盐和水(如二氧化碳与澄清的石灰水的反应),可它就不是中和反应;还有酸与金属氧化物作用也能生成盐和水(如用稀盐酸出铁锈的反应),可它也不是中和反应。
2.中和反应一定是复分解反应,但是复分解反应不一定是中和反应;只有酸和碱之间的反应才是中和反应。
3. 在做中和反应的实验时,由于酸和碱的溶液一般是无色,二者反应时的现象不明显,所以往往借助于一些试剂或仪器等(如酸碱指示剂、pH试纸、温度计等),来帮助我们判断反应是否进行或恰好完全。
同课章节目录
