第一章 酸碱盐-计算题专练(含解析)
图片预览




文档简介
中小学教育资源及组卷应用平台
酸碱盐-计算题
(2020·萧山区朝晖初级中学九年级月考)把盛有5g16%的NaOH溶液的短试管放入盛有l0g16%的CuSO4溶液的锥形瓶里,如图所示。倾斜锥形瓶直到使两溶液充分混合,混合后不可能的是(
)
A.产生蓝色沉淀0.98g
B.锥形瓶内物质总质量不变
C.所得溶液的Na2SO4质量分数大于9.5%
D.所得的Na2SO4溶液质量与原CuSO4溶液质量相等
(2020·杭州市开元中学九年级月考)食品保鲜可以防止食品变质、保持食品的营养和味道。食品保鲜的措施有低温、添加防腐剂、充填气体、放置干燥剂和脱氧保鲜剂等。
(1)丙酸钠是一种常用的防腐剂,化学式为C3H5O2Na,它属于________(选填“氧化物”或“酸”或“碱”或“盐”);
(2)某脱氧保鲜剂的主要成分为活性铁粉,利用铁与氧气、水反应生成氢氧化铁(4Fe+3O2+6H2O=4Fe(OH)3)。已知该脱氧保鲜剂中活性铁粉的质量为5.6克,计算该脱氧保鲜剂最多能吸收氧气的质量________。
(2020·浙江杭州市·九年级期末)为了抗击疫情,我区某校收到疫情防疫物资有:口罩、额温枪、消毒酒精、84消毒液等。其中84消毒液的有效成分是次氯酸钠(NaClO),可用电解氯化钠稀溶液制备,同时生成的产物还有氢气。
(1)请写出制备方程式______________________。
(2)现有1000千克的11.7%的氯化钠稀溶液,可以制得次氯酸钠的质量是多少千克?_________
(2020·杭州市三墩中学九年级期中)近年来,青海旅游因为抖音视频的宣传火爆一时,其中一个著名的景点就是茶卡盐湖,该盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计)。为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸。当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g,(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如下图所示。试计算:
(1)A点产生气体的质量m=____。
(2)试样中碳酸钠的质量分数(结果精确至0.1%)。_____
(3)B点时,烧杯内溶液中的溶质是____(写出化学式)。
(2020·浙江杭州市·九年级月考)科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。
(1)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是____________________。
(2)用乙装置完成“制取并检验CO2”的实验,消耗了0.73克10%的盐酸。请计算实验过程中产生CO2的质量是多少克?________
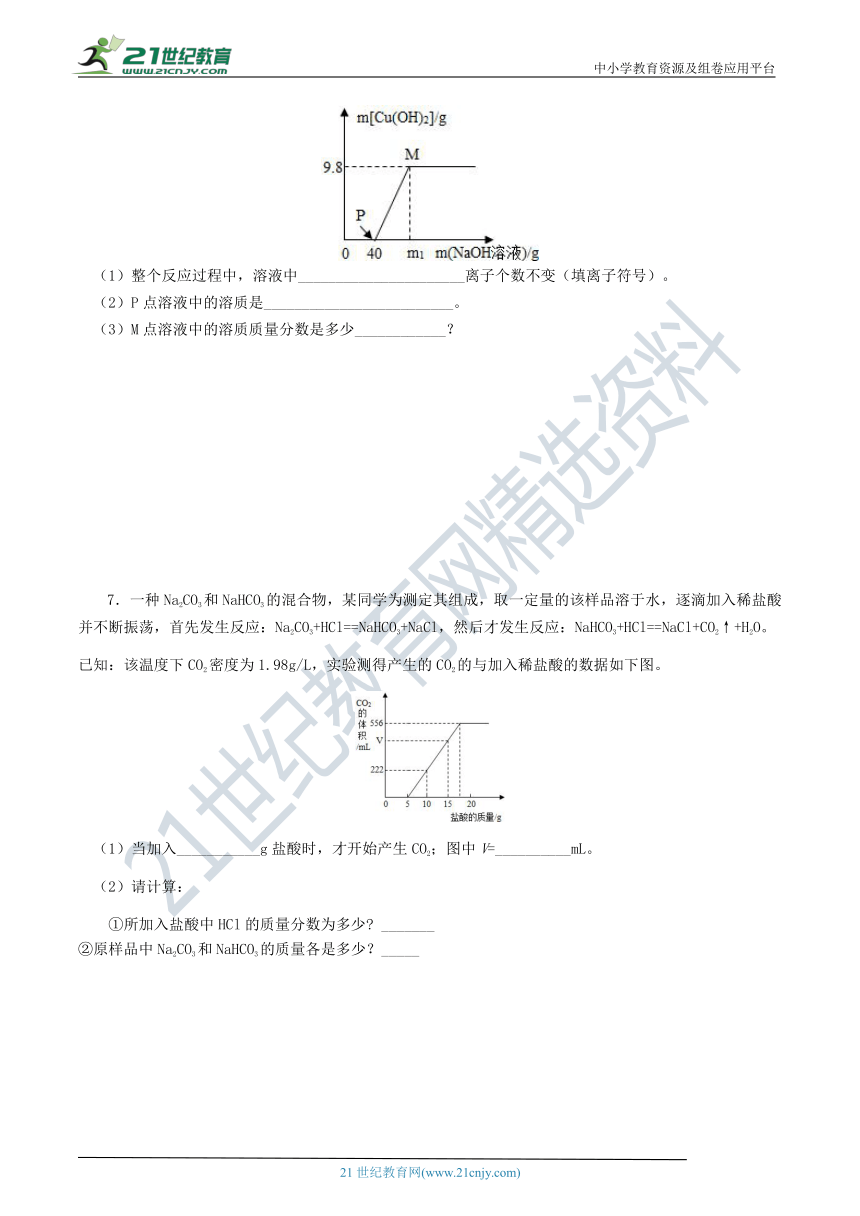
向含CuCl2和HCl的100
g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图。
据图回答:
(1)整个反应过程中,溶液中______________________离子个数不变(填离子符号)。
(2)P点溶液中的溶质是_________________________。
(3)M点溶液中的溶质质量分数是多少____________?
一种Na2CO3和NaHCO3的混合物,某同学为测定其组成,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl==NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl==NaCl+CO2↑+H2O。
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2的与加入稀盐酸的数据如下图。
(1)当加入___________g盐酸时,才开始产生CO2;图中V=__________mL。
(2)请计算:
①所加入盐酸中HCl的质量分数为多少?
_______
②原样品中Na2CO3和NaHCO3的质量各是多少?_____
酸碱盐-计算题
(2020·萧山区朝晖初级中学九年级月考)把盛有5g16%的NaOH溶液的短试管放入盛有l0g16%的CuSO4溶液的锥形瓶里,如图所示。倾斜锥形瓶直到使两溶液充分混合,混合后不可能的是(
)
A.产生蓝色沉淀0.98g
B.锥形瓶内物质总质量不变
C.所得溶液的Na2SO4质量分数大于9.5%
D.所得的Na2SO4溶液质量与原CuSO4溶液质量相等
【答案】D
【分析】
通过化学方程式可以看出,硫酸铜和氢氧化钠反应是按照质量比2:1的进行,
【详解】A、由分析可知,氢氧化钠和硫酸铜完全反应,生成氢氧化铜沉淀是0.98g,故A正确;B、反应后没有气体生成,所以锥形瓶内物质总质量不变,故B正确;C、反应后的溶液质量是10g+5g-0.98g=14.02g,硫酸钠为1.42g,所得溶液的Na2SO4质量分数为:×100%=10.4%,故C正确;D、硫酸钠溶液的质量为14.02g,原硫酸铜溶液的质量为10g,不相等,故D错误;
故选D。
(2020·杭州市开元中学九年级月考)食品保鲜可以防止食品变质、保持食品的营养和味道。食品保鲜的措施有低温、添加防腐剂、充填气体、放置干燥剂和脱氧保鲜剂等。
(1)丙酸钠是一种常用的防腐剂,化学式为C3H5O2Na,它属于________(选填“氧化物”或“酸”或“碱”或“盐”);
(2)某脱氧保鲜剂的主要成分为活性铁粉,利用铁与氧气、水反应生成氢氧化铁(4Fe+3O2+6H2O=4Fe(OH)3)。已知该脱氧保鲜剂中活性铁粉的质量为5.6克,计算该脱氧保鲜剂最多能吸收氧气的质量________。
【答案】盐
2.4g
【详解】(1)丙酸钠是由钠离子和丙酸根离子结合形成的化合物,属于盐类物质。故答案为:盐;(2)设该脱氧保鲜剂最多能够吸收氧气的质量为x。
解得x=2.4g
所以该脱氧保鲜剂最多能吸收氧气的质量为2.4g。
(2020·浙江杭州市·九年级期末)为了抗击疫情,我区某校收到疫情防疫物资有:口罩、额温枪、消毒酒精、84消毒液等。其中84消毒液的有效成分是次氯酸钠(NaClO),可用电解氯化钠稀溶液制备,同时生成的产物还有氢气。
(1)请写出制备方程式______________________。
(2)现有1000千克的11.7%的氯化钠稀溶液,可以制得次氯酸钠的质量是多少千克?_________
【答案】NaCl+H2ONaClO+H2↑
解:参加反应的氯化钠的质量=1000kg×11.7%=117kg
设制得次氯酸钠的质量为x
=
x=149kg
答:制得次氯酸钠的质量为149kg。
【详解】(1)氯化钠和水在通电的条件下反应生成次氯酸钠和氢气,故反应的化学方程式写为:NaCl+H2ONaClO+H2↑。(2)见答案。
(2020·杭州市三墩中学九年级期中)近年来,青海旅游因为抖音视频的宣传火爆一时,其中一个著名的景点就是茶卡盐湖,该盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计)。为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸。当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g,(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如下图所示。试计算:
(1)A点产生气体的质量m=____。
(2)试样中碳酸钠的质量分数(结果精确至0.1%)。_____
(3)B点时,烧杯内溶液中的溶质是____(写出化学式)。
【答案】2.2
设样品中碳酸钠的质量为x,
x=5.3g试样中碳酸钠的质量分数=×100%≈88.3%。
NaCl、HCl
【详解】(1)根据质量守恒定律,A点产生气体的质量=36.5g+6g-40.3g=2.2g;(2)见答案;
(3)B点时所加稀盐酸过量,所得溶液为氯化钠与稀盐酸的混合溶液,其中溶质为NaCl、HCl。
(2020·浙江杭州市·九年级月考)科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。
(1)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是____________________。
(2)用乙装置完成“制取并检验CO2”的实验,消耗了0.73克10%的盐酸。请计算实验过程中产生CO2的质量是多少克?________
【答案】(1)药品用量少,产生的废弃物也少,方便操作(2)设生成二氧化碳的质量为x,
x=0.044g答:实验过程中产生CO2的质量是0.044g。
【详解】(1)采用“微型”实验装置具有的优点是药品用量少,产生的废弃物也少,方便操作;(2)见答案。
向含CuCl2和HCl的100
g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图。
据图回答:
(1)整个反应过程中,溶液中______________________离子个数不变(填离子符号)。
(2)P点溶液中的溶质是_________________________。
(3)M点溶液中的溶质质量分数是多少____________?
【答案】Cl-
NaCl、CuCl2
8.35%
【详解】(1)CuCl2和HCl的混合溶液中,逐滴加入NaOH溶液,氯化氢先与氢氧化钠反应生成氯化钠和水,然后氯化铜再与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式为:NaOH+HCl═NaCl+H2O;CuCl2+2NaOH═Cu(OH)2↓+2NaCl,由化学方程式可以看出,在此整个过程中,氯离子不变,其符号为:Cl-;(2)P点表示氯化氢和氢氧化钠恰好完全反应,此时氯化铜还没和氢氧化钠反应,故溶液中的溶质为NaCl、CuCl2;(3)设生成9.8g氢氧化铜沉淀需氢氧化钠溶液的质量为x,生成氯化钠的质量为氯化氢和氢氧化钠反应时消耗的氢氧化钠溶液的质量为40g,所以设氯化氢与氢氧化钠反应生成氯化钠的质量为y
M点溶液中的溶质氯化钠的质量为
M点溶液的溶质质量分数为
答:M点溶液的溶质质量分数为8.35%。
一种Na2CO3和NaHCO3的混合物,某同学为测定其组成,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl==NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl==NaCl+CO2↑+H2O。
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2的与加入稀盐酸的数据如下图。
(1)当加入___________g盐酸时,才开始产生CO2;图中V=__________mL。
(2)请计算:
①所加入盐酸中HCl的质量分数为多少?
_______
②原样品中Na2CO3和NaHCO3的质量各是多少?_____
【答案】5
444
7.3%
Na2CO3:1.06g、NaHCO3:1.26g
【详解】解:(1)从图象可以看出,加入5克盐酸后开始有二氧化碳气体出现。从图象可以看出,加入(10-5)克盐酸放出二氧化碳的体积是222毫升;加入(15-5)克盐酸放出二氧化碳气体的体积是V毫升,所以V=222×2=444毫升。故答案为5;444。(2)①444?mLCO2的质量=
×1.98g/L=0.88克,设产生0.88gCO2时,消耗HCl的质量为X。
得:x=0.73g∴盐酸溶液中溶质的质量分数=
×100%=7.3%。②设加入5g盐酸时,参加反应的碳酸钠的质量为Y,生成碳酸氢钠的质量为Z。5克盐酸中溶质的质量=5克×7.3%=0.365克。
?解得:Y=1.06克、Z=0.84克556mLCO2的质量=556mL÷1000×1.98g/L=1.10克,设放出556mLCO2时反应的NaHCO3质量为m。
得:m=2.10克∴原样品中NaHCO3的质量=2.1克-0.84克=1.26克。答:①盐酸中HCl的质量分数为7.3%;②原样品中有Na2CO31.06g;NaHCO3?1.26g
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
酸碱盐-计算题
(2020·萧山区朝晖初级中学九年级月考)把盛有5g16%的NaOH溶液的短试管放入盛有l0g16%的CuSO4溶液的锥形瓶里,如图所示。倾斜锥形瓶直到使两溶液充分混合,混合后不可能的是(
)
A.产生蓝色沉淀0.98g
B.锥形瓶内物质总质量不变
C.所得溶液的Na2SO4质量分数大于9.5%
D.所得的Na2SO4溶液质量与原CuSO4溶液质量相等
(2020·杭州市开元中学九年级月考)食品保鲜可以防止食品变质、保持食品的营养和味道。食品保鲜的措施有低温、添加防腐剂、充填气体、放置干燥剂和脱氧保鲜剂等。
(1)丙酸钠是一种常用的防腐剂,化学式为C3H5O2Na,它属于________(选填“氧化物”或“酸”或“碱”或“盐”);
(2)某脱氧保鲜剂的主要成分为活性铁粉,利用铁与氧气、水反应生成氢氧化铁(4Fe+3O2+6H2O=4Fe(OH)3)。已知该脱氧保鲜剂中活性铁粉的质量为5.6克,计算该脱氧保鲜剂最多能吸收氧气的质量________。
(2020·浙江杭州市·九年级期末)为了抗击疫情,我区某校收到疫情防疫物资有:口罩、额温枪、消毒酒精、84消毒液等。其中84消毒液的有效成分是次氯酸钠(NaClO),可用电解氯化钠稀溶液制备,同时生成的产物还有氢气。
(1)请写出制备方程式______________________。
(2)现有1000千克的11.7%的氯化钠稀溶液,可以制得次氯酸钠的质量是多少千克?_________
(2020·杭州市三墩中学九年级期中)近年来,青海旅游因为抖音视频的宣传火爆一时,其中一个著名的景点就是茶卡盐湖,该盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计)。为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸。当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g,(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如下图所示。试计算:
(1)A点产生气体的质量m=____。
(2)试样中碳酸钠的质量分数(结果精确至0.1%)。_____
(3)B点时,烧杯内溶液中的溶质是____(写出化学式)。
(2020·浙江杭州市·九年级月考)科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。
(1)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是____________________。
(2)用乙装置完成“制取并检验CO2”的实验,消耗了0.73克10%的盐酸。请计算实验过程中产生CO2的质量是多少克?________
向含CuCl2和HCl的100
g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图。
据图回答:
(1)整个反应过程中,溶液中______________________离子个数不变(填离子符号)。
(2)P点溶液中的溶质是_________________________。
(3)M点溶液中的溶质质量分数是多少____________?
一种Na2CO3和NaHCO3的混合物,某同学为测定其组成,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl==NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl==NaCl+CO2↑+H2O。
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2的与加入稀盐酸的数据如下图。
(1)当加入___________g盐酸时,才开始产生CO2;图中V=__________mL。
(2)请计算:
①所加入盐酸中HCl的质量分数为多少?
_______
②原样品中Na2CO3和NaHCO3的质量各是多少?_____
酸碱盐-计算题
(2020·萧山区朝晖初级中学九年级月考)把盛有5g16%的NaOH溶液的短试管放入盛有l0g16%的CuSO4溶液的锥形瓶里,如图所示。倾斜锥形瓶直到使两溶液充分混合,混合后不可能的是(
)
A.产生蓝色沉淀0.98g
B.锥形瓶内物质总质量不变
C.所得溶液的Na2SO4质量分数大于9.5%
D.所得的Na2SO4溶液质量与原CuSO4溶液质量相等
【答案】D
【分析】
通过化学方程式可以看出,硫酸铜和氢氧化钠反应是按照质量比2:1的进行,
【详解】A、由分析可知,氢氧化钠和硫酸铜完全反应,生成氢氧化铜沉淀是0.98g,故A正确;B、反应后没有气体生成,所以锥形瓶内物质总质量不变,故B正确;C、反应后的溶液质量是10g+5g-0.98g=14.02g,硫酸钠为1.42g,所得溶液的Na2SO4质量分数为:×100%=10.4%,故C正确;D、硫酸钠溶液的质量为14.02g,原硫酸铜溶液的质量为10g,不相等,故D错误;
故选D。
(2020·杭州市开元中学九年级月考)食品保鲜可以防止食品变质、保持食品的营养和味道。食品保鲜的措施有低温、添加防腐剂、充填气体、放置干燥剂和脱氧保鲜剂等。
(1)丙酸钠是一种常用的防腐剂,化学式为C3H5O2Na,它属于________(选填“氧化物”或“酸”或“碱”或“盐”);
(2)某脱氧保鲜剂的主要成分为活性铁粉,利用铁与氧气、水反应生成氢氧化铁(4Fe+3O2+6H2O=4Fe(OH)3)。已知该脱氧保鲜剂中活性铁粉的质量为5.6克,计算该脱氧保鲜剂最多能吸收氧气的质量________。
【答案】盐
2.4g
【详解】(1)丙酸钠是由钠离子和丙酸根离子结合形成的化合物,属于盐类物质。故答案为:盐;(2)设该脱氧保鲜剂最多能够吸收氧气的质量为x。
解得x=2.4g
所以该脱氧保鲜剂最多能吸收氧气的质量为2.4g。
(2020·浙江杭州市·九年级期末)为了抗击疫情,我区某校收到疫情防疫物资有:口罩、额温枪、消毒酒精、84消毒液等。其中84消毒液的有效成分是次氯酸钠(NaClO),可用电解氯化钠稀溶液制备,同时生成的产物还有氢气。
(1)请写出制备方程式______________________。
(2)现有1000千克的11.7%的氯化钠稀溶液,可以制得次氯酸钠的质量是多少千克?_________
【答案】NaCl+H2ONaClO+H2↑
解:参加反应的氯化钠的质量=1000kg×11.7%=117kg
设制得次氯酸钠的质量为x
=
x=149kg
答:制得次氯酸钠的质量为149kg。
【详解】(1)氯化钠和水在通电的条件下反应生成次氯酸钠和氢气,故反应的化学方程式写为:NaCl+H2ONaClO+H2↑。(2)见答案。
(2020·杭州市三墩中学九年级期中)近年来,青海旅游因为抖音视频的宣传火爆一时,其中一个著名的景点就是茶卡盐湖,该盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计)。为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸。当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g,(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如下图所示。试计算:
(1)A点产生气体的质量m=____。
(2)试样中碳酸钠的质量分数(结果精确至0.1%)。_____
(3)B点时,烧杯内溶液中的溶质是____(写出化学式)。
【答案】2.2
设样品中碳酸钠的质量为x,
x=5.3g试样中碳酸钠的质量分数=×100%≈88.3%。
NaCl、HCl
【详解】(1)根据质量守恒定律,A点产生气体的质量=36.5g+6g-40.3g=2.2g;(2)见答案;
(3)B点时所加稀盐酸过量,所得溶液为氯化钠与稀盐酸的混合溶液,其中溶质为NaCl、HCl。
(2020·浙江杭州市·九年级月考)科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。
(1)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是____________________。
(2)用乙装置完成“制取并检验CO2”的实验,消耗了0.73克10%的盐酸。请计算实验过程中产生CO2的质量是多少克?________
【答案】(1)药品用量少,产生的废弃物也少,方便操作(2)设生成二氧化碳的质量为x,
x=0.044g答:实验过程中产生CO2的质量是0.044g。
【详解】(1)采用“微型”实验装置具有的优点是药品用量少,产生的废弃物也少,方便操作;(2)见答案。
向含CuCl2和HCl的100
g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图。
据图回答:
(1)整个反应过程中,溶液中______________________离子个数不变(填离子符号)。
(2)P点溶液中的溶质是_________________________。
(3)M点溶液中的溶质质量分数是多少____________?
【答案】Cl-
NaCl、CuCl2
8.35%
【详解】(1)CuCl2和HCl的混合溶液中,逐滴加入NaOH溶液,氯化氢先与氢氧化钠反应生成氯化钠和水,然后氯化铜再与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式为:NaOH+HCl═NaCl+H2O;CuCl2+2NaOH═Cu(OH)2↓+2NaCl,由化学方程式可以看出,在此整个过程中,氯离子不变,其符号为:Cl-;(2)P点表示氯化氢和氢氧化钠恰好完全反应,此时氯化铜还没和氢氧化钠反应,故溶液中的溶质为NaCl、CuCl2;(3)设生成9.8g氢氧化铜沉淀需氢氧化钠溶液的质量为x,生成氯化钠的质量为氯化氢和氢氧化钠反应时消耗的氢氧化钠溶液的质量为40g,所以设氯化氢与氢氧化钠反应生成氯化钠的质量为y
M点溶液中的溶质氯化钠的质量为
M点溶液的溶质质量分数为
答:M点溶液的溶质质量分数为8.35%。
一种Na2CO3和NaHCO3的混合物,某同学为测定其组成,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl==NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl==NaCl+CO2↑+H2O。
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2的与加入稀盐酸的数据如下图。
(1)当加入___________g盐酸时,才开始产生CO2;图中V=__________mL。
(2)请计算:
①所加入盐酸中HCl的质量分数为多少?
_______
②原样品中Na2CO3和NaHCO3的质量各是多少?_____
【答案】5
444
7.3%
Na2CO3:1.06g、NaHCO3:1.26g
【详解】解:(1)从图象可以看出,加入5克盐酸后开始有二氧化碳气体出现。从图象可以看出,加入(10-5)克盐酸放出二氧化碳的体积是222毫升;加入(15-5)克盐酸放出二氧化碳气体的体积是V毫升,所以V=222×2=444毫升。故答案为5;444。(2)①444?mLCO2的质量=
×1.98g/L=0.88克,设产生0.88gCO2时,消耗HCl的质量为X。
得:x=0.73g∴盐酸溶液中溶质的质量分数=
×100%=7.3%。②设加入5g盐酸时,参加反应的碳酸钠的质量为Y,生成碳酸氢钠的质量为Z。5克盐酸中溶质的质量=5克×7.3%=0.365克。
?解得:Y=1.06克、Z=0.84克556mLCO2的质量=556mL÷1000×1.98g/L=1.10克,设放出556mLCO2时反应的NaHCO3质量为m。
得:m=2.10克∴原样品中NaHCO3的质量=2.1克-0.84克=1.26克。答:①盐酸中HCl的质量分数为7.3%;②原样品中有Na2CO31.06g;NaHCO3?1.26g
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
