粤教版九年级上册化学2.3--构成物质的微粒(‖)-原子和离子 课件(32张ppt)
文档属性
| 名称 | 粤教版九年级上册化学2.3--构成物质的微粒(‖)-原子和离子 课件(32张ppt) |
|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-04 11:15:53 | ||
图片预览









文档简介
质子、中子、电子的电性和电量怎样?
原子很小,让我们看看一个原子有多重:
什 么 是 原 子
原子内部的奥秘
2.3 构成物质的微粒(‖)—
原子和离子
原子
复习:
1、分子的概念
2、分子性质
分子是构成物质的一种微粒,也是保持物质化学性质的一种微粒。
1、构成物质的分子体积和质量小,且在不断的运动
2、分子之间有间隔
复习:
3、从分子角度认识纯净物和混合物
4、用分子的观点说物理变化、化学变化
由分子构成的物质中,由不同种分子构成的物质是混合物。
由一种分子构成的物质是纯净物。
由分子构成的物质,
在物理变化中,分子本身不发生改变,仍然保持该物质的化学性质;
在化学变化中,分子本身发生改变,生成新的分子,新分子不再保
持原物质的化学性质。
一、原子是什么
氧化汞受热分解
现象:试管内壁上出现银光闪闪的水银(又名汞),并能收集到能支持可燃物燃烧的氧气。
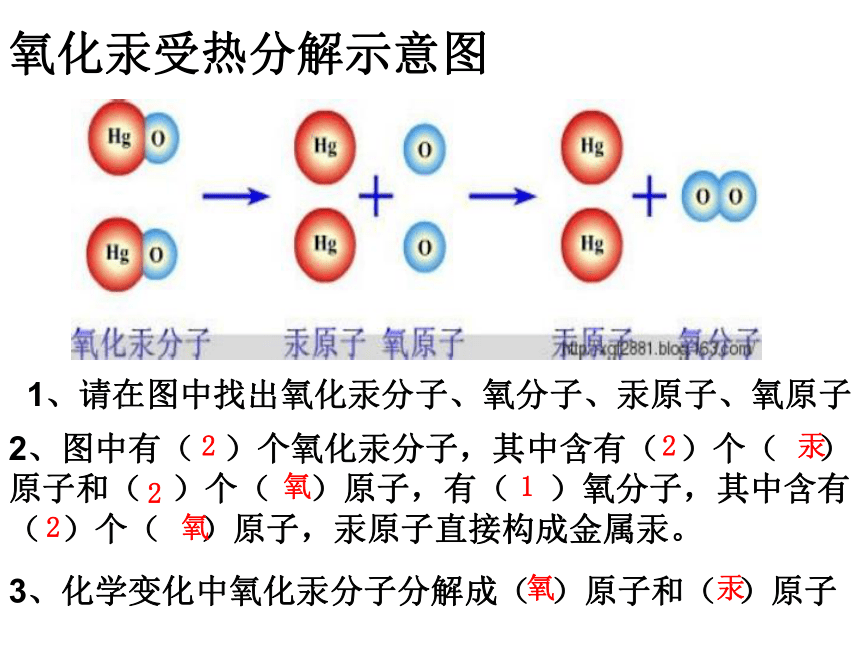
氧化汞受热分解示意图
1、请在图中找出氧化汞分子、氧分子、汞原子、氧原子
2、图中有( )个氧化汞分子,其中含有( )个( )原子和( )个( )原子,有( )氧分子,其中含有( )个( )原子,汞原子直接构成金属汞。
3、化学变化中氧化汞分子分解成( )原子和( )原子
2
2
汞
2
氧
1
2
氧
氧
汞
1.原子是构成物质的另一种微粒。原子构成分子,原子也可以直接构成物质。
2.在化学变化中分子本身发生变化,而原子本身没有变化(在化学变化中分子可分原子不可分)只是重新组合成新分子,构成新物质。原子是化学变化中最小的微粒。
一.原子的概念:
二.原子的特性:
是化学变化中的最小微粒。
1.原子也在不断运动着。
2.原子之间有间隙。
3.原子的体积和质量都非常小。
总结:
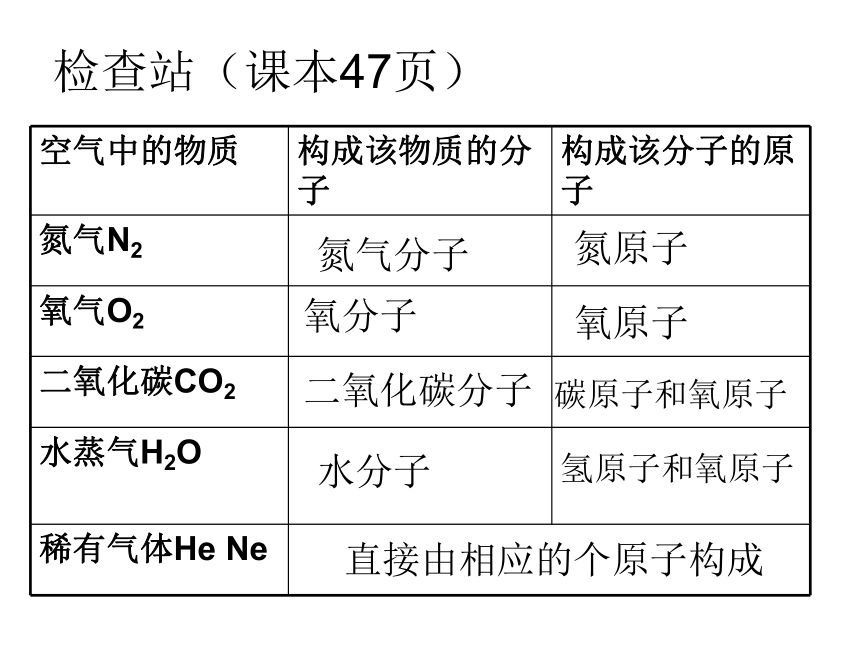
检查站(课本47页)
空气中的物质
构成该物质的分子
构成该分子的原子
氮气N2
氧气O2
二氧化碳CO2
水蒸气H2O
稀有气体He Ne
氮气分子
氮原子
氧分子
氧原子
二氧化碳分子
水分子
碳原子和氧原子
氢原子和氧原子
直接由相应的个原子构成
原子是化学变化中的最小微粒,
原子还能再分吗?
问题:
原子的内部有何奥秘
科学史话——原子结构的探索历程
英国化学家道尔顿
实心球 模型
英国物理学家
汤姆森
枣糕模型
1897年,汤姆森在原子内部发现了电子,摧毁了“原子不可再分”的观点,并建立了新的原子结构模型--“枣糕模型”。
1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
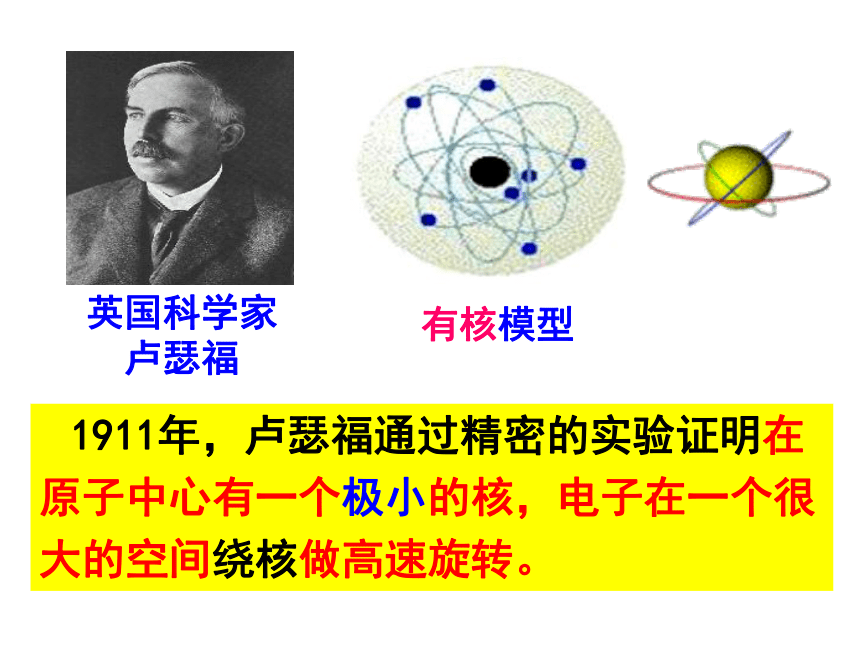
英国科学家
卢瑟福
有核模型
1911年,卢瑟福通过精密的实验证明在原子中心有一个极小的核,电子在一个很大的空间绕核做高速旋转。
原子是怎样构成的?
【智慧阅读】阅读课本48--49页并讨论:
1. 原子是实心球体吗?抛开化学变化能否将原子再分下去?若能,它可以分为哪几部分?
2. 原子核还能再分吗?如果能再分,它又是由什么微粒构成的呢?
3.原子中各种粒子带电情况如何?
4.什么叫核电荷数?它与质子数有什么关系?
+
+
+
合作学习:
1个质子带一个单位正电荷;
1个电子带一个单位负电荷。
中子不带电;
原子核带正电荷
原子核所带的正电荷数目叫做核电荷数
核电荷数=核内质子数
强化提升
17
18
17
氯
11
12
11
钠
8
8
8
氧
6
6
6
碳
1
0
1
氢
核外电子数
中子数
质子数
原子种类
观察下表不同原子中各微粒的数目,思考讨论下列问题:(或看书49页表格)
【观察讨论】
1、原子中还有哪些微粒的数目是一定相等的?
2、构成原子的微粒一般有 、 和 。
3、同种原子核内的质子数和中子数有何关系?
4、原子是否带电?为什么?
5、不同种类的原子,主要是因为其核内哪种微粒数不同?
质子
中子
电子
并不是所有的原子都有中子(氢原子内没有中子)
质子数不一定等于中子数。
不同种类的原子,其核内质子数不同。 (即原子的种类由质子数决定)
原子不显电性的原因:
由于同一原子中,原子核里的质子和核外电子所带电荷数相等,且电性相反,所以整个原子不显电性。
2、原子中:核电荷数=质子数=核外电子数
1、原子
原子核(+)
核外电子( )
质子(+)
中子(不带电)
(电中性)
三.原子的结构:
所带正电荷数称为核电荷数
11
12
钠
16
16
硫
8
8
氧
核外电子数
中子数
质子数
核电荷数
原子种类
1. 填写下表中的空格。
8
8
16
16
11
11
核电荷数=质子数=核外电子数=原子序数
心中有数
2.化学变化中的最小粒子是( )
A.原子 B.分子 C.质子 D.中子
3.氡原子的质子数为86,中子数为136,这种氡原子核外电子数为( )
A.50 B.86 C.136 D.222
4.有一种元素原子的核电荷数为49,中子数为66,则这种元素的原子的质子数和核外电子数分别为( )
A 49 66 B 66 49
C 66 66 D 49 49
A
B
D
下图有18种元素,她们分成了几类?
你能说出其中的道理吗?
金属原子、非金属原子和稀有气体原子
的最外层电子数有什么特点?
1-18号元素原子结构示意图
J
F
X
H
He
氢
氦
Be
Li
B
C
N
O
F
Ne
锂
铍
硼
碳
氮
氧
氟
氖
Ar
Cl
S
P
Si
Al
Mg
Na
钠
镁
铝
硅
磷
硫
氯
氩
1.第一层最多排2个电子,
2.第二层最多排8个电子。
3.最外层不超过8个(第一层2个)
4.最外层达到8个电子的状态是稳定结构。(第一层两个电子也为稳定结构)
核外电子排步规律:
最 外 层 电 子 数 特 点
1.金属元素最外层电子数一般<4个;
2.非金属元素最外层电子数一般≥4个;
3.稀有气体元素最外层电子数是8(He是2个)。
原子核(蚂蚁)
原子(体育场 )
原子核比原子小得多
一个碳原子的质量是:
0.00000000000000000000000001993千克
即1.993×10-26千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个铁原子的质量是:
0.00000000000000000000000009288千克
即9.288×10-26千克
原子的质量很小,记忆、计算都很不方便,怎么办?
原子很小,原子核更小
四、原子的质量
1.实际质量
2.相对质量
相对原子质量——以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的数值,就是这种原子的相对原子质量。
②相对原子质量是一个比值,有单位
③相对原子质量≈质子数+ 中子数。
1 个 X原子的实际质量
一个碳-12原子的实际质量/12
①X原子的相对原子质量 =
④原子的相对原子质量越大其实际质量就越大。
⑤原子的相对原子质量之比等于其实际质量之比。
构成原子的粒子的质量
1.008
1.007
1/1836
相对质量
1.675×10-27
1.673×10-27
9.109×10-31
质量/kg
中子
质子
原子核
电子
构成原子的粒子
可以说原子的质量全部集中在原子核上即:相对原子质量=质子数+中子数
几种原子的质量
1. 674×10-27
氢原子
1.993×10-26
碳原子
9.288×10-26
铁原子
2.657×10-26
氧原子
相对原子质量
实际质量/kg
几种常见原子
1
12
16
56
7
6
6
6
中子数
质子数
原子
碳-12
碳-13
碳原子
1、原子是由_________和_________构成的。
2、构成原子的粒子有_____、_____、_______。其中,______带正电,_______带负电,_______不带电,________绕着________做高速运动。________占据体积很小,却集中了原子的主要质量。
综合应用
原子核
核外电子
质子
电子
中子
质子
电子
中子
电子
原子核
原子核
综合应用
3、将①分子②原子③质子④中子⑤电子等粒子用序号分别填 入下列适当空格中:
(1)构成物质的基本粒子是________
(2)构成原子的基本粒子是_______
(3)显电中性(不带电)的粒子是_________
(4)带正电的粒子是______
(5)化学变化中种类一定改变的粒子是______,决定原子种类的粒子是 。
(6)原子中数目一定相等的粒子是________
①②
③④⑤
①②④
③
①
③⑤
③
1. 英国科学家道尔顿于19世纪初提出了近代原子学说。他认为物质是由原子构成的,这些原子是微小的、不可分割的实心球体。请你指出道尔顿原子学说中与现代科学实验证明的事实不相符的地方:
(1)________________________________
(2)________________________________
(3)________________________________
物质并不都是由原子构成的,分子、离子也可以构成物质。
原子可分为原子核和核外电子。
原子不是实心球体,原子内部有很大空间。
物质都是由原子构成的
不可分割
实心球体
拓展延伸
原子很小,让我们看看一个原子有多重:
什 么 是 原 子
原子内部的奥秘
2.3 构成物质的微粒(‖)—
原子和离子
原子
复习:
1、分子的概念
2、分子性质
分子是构成物质的一种微粒,也是保持物质化学性质的一种微粒。
1、构成物质的分子体积和质量小,且在不断的运动
2、分子之间有间隔
复习:
3、从分子角度认识纯净物和混合物
4、用分子的观点说物理变化、化学变化
由分子构成的物质中,由不同种分子构成的物质是混合物。
由一种分子构成的物质是纯净物。
由分子构成的物质,
在物理变化中,分子本身不发生改变,仍然保持该物质的化学性质;
在化学变化中,分子本身发生改变,生成新的分子,新分子不再保
持原物质的化学性质。
一、原子是什么
氧化汞受热分解
现象:试管内壁上出现银光闪闪的水银(又名汞),并能收集到能支持可燃物燃烧的氧气。
氧化汞受热分解示意图
1、请在图中找出氧化汞分子、氧分子、汞原子、氧原子
2、图中有( )个氧化汞分子,其中含有( )个( )原子和( )个( )原子,有( )氧分子,其中含有( )个( )原子,汞原子直接构成金属汞。
3、化学变化中氧化汞分子分解成( )原子和( )原子
2
2
汞
2
氧
1
2
氧
氧
汞
1.原子是构成物质的另一种微粒。原子构成分子,原子也可以直接构成物质。
2.在化学变化中分子本身发生变化,而原子本身没有变化(在化学变化中分子可分原子不可分)只是重新组合成新分子,构成新物质。原子是化学变化中最小的微粒。
一.原子的概念:
二.原子的特性:
是化学变化中的最小微粒。
1.原子也在不断运动着。
2.原子之间有间隙。
3.原子的体积和质量都非常小。
总结:
检查站(课本47页)
空气中的物质
构成该物质的分子
构成该分子的原子
氮气N2
氧气O2
二氧化碳CO2
水蒸气H2O
稀有气体He Ne
氮气分子
氮原子
氧分子
氧原子
二氧化碳分子
水分子
碳原子和氧原子
氢原子和氧原子
直接由相应的个原子构成
原子是化学变化中的最小微粒,
原子还能再分吗?
问题:
原子的内部有何奥秘
科学史话——原子结构的探索历程
英国化学家道尔顿
实心球 模型
英国物理学家
汤姆森
枣糕模型
1897年,汤姆森在原子内部发现了电子,摧毁了“原子不可再分”的观点,并建立了新的原子结构模型--“枣糕模型”。
1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
英国科学家
卢瑟福
有核模型
1911年,卢瑟福通过精密的实验证明在原子中心有一个极小的核,电子在一个很大的空间绕核做高速旋转。
原子是怎样构成的?
【智慧阅读】阅读课本48--49页并讨论:
1. 原子是实心球体吗?抛开化学变化能否将原子再分下去?若能,它可以分为哪几部分?
2. 原子核还能再分吗?如果能再分,它又是由什么微粒构成的呢?
3.原子中各种粒子带电情况如何?
4.什么叫核电荷数?它与质子数有什么关系?
+
+
+
合作学习:
1个质子带一个单位正电荷;
1个电子带一个单位负电荷。
中子不带电;
原子核带正电荷
原子核所带的正电荷数目叫做核电荷数
核电荷数=核内质子数
强化提升
17
18
17
氯
11
12
11
钠
8
8
8
氧
6
6
6
碳
1
0
1
氢
核外电子数
中子数
质子数
原子种类
观察下表不同原子中各微粒的数目,思考讨论下列问题:(或看书49页表格)
【观察讨论】
1、原子中还有哪些微粒的数目是一定相等的?
2、构成原子的微粒一般有 、 和 。
3、同种原子核内的质子数和中子数有何关系?
4、原子是否带电?为什么?
5、不同种类的原子,主要是因为其核内哪种微粒数不同?
质子
中子
电子
并不是所有的原子都有中子(氢原子内没有中子)
质子数不一定等于中子数。
不同种类的原子,其核内质子数不同。 (即原子的种类由质子数决定)
原子不显电性的原因:
由于同一原子中,原子核里的质子和核外电子所带电荷数相等,且电性相反,所以整个原子不显电性。
2、原子中:核电荷数=质子数=核外电子数
1、原子
原子核(+)
核外电子( )
质子(+)
中子(不带电)
(电中性)
三.原子的结构:
所带正电荷数称为核电荷数
11
12
钠
16
16
硫
8
8
氧
核外电子数
中子数
质子数
核电荷数
原子种类
1. 填写下表中的空格。
8
8
16
16
11
11
核电荷数=质子数=核外电子数=原子序数
心中有数
2.化学变化中的最小粒子是( )
A.原子 B.分子 C.质子 D.中子
3.氡原子的质子数为86,中子数为136,这种氡原子核外电子数为( )
A.50 B.86 C.136 D.222
4.有一种元素原子的核电荷数为49,中子数为66,则这种元素的原子的质子数和核外电子数分别为( )
A 49 66 B 66 49
C 66 66 D 49 49
A
B
D
下图有18种元素,她们分成了几类?
你能说出其中的道理吗?
金属原子、非金属原子和稀有气体原子
的最外层电子数有什么特点?
1-18号元素原子结构示意图
J
F
X
H
He
氢
氦
Be
Li
B
C
N
O
F
Ne
锂
铍
硼
碳
氮
氧
氟
氖
Ar
Cl
S
P
Si
Al
Mg
Na
钠
镁
铝
硅
磷
硫
氯
氩
1.第一层最多排2个电子,
2.第二层最多排8个电子。
3.最外层不超过8个(第一层2个)
4.最外层达到8个电子的状态是稳定结构。(第一层两个电子也为稳定结构)
核外电子排步规律:
最 外 层 电 子 数 特 点
1.金属元素最外层电子数一般<4个;
2.非金属元素最外层电子数一般≥4个;
3.稀有气体元素最外层电子数是8(He是2个)。
原子核(蚂蚁)
原子(体育场 )
原子核比原子小得多
一个碳原子的质量是:
0.00000000000000000000000001993千克
即1.993×10-26千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个铁原子的质量是:
0.00000000000000000000000009288千克
即9.288×10-26千克
原子的质量很小,记忆、计算都很不方便,怎么办?
原子很小,原子核更小
四、原子的质量
1.实际质量
2.相对质量
相对原子质量——以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的数值,就是这种原子的相对原子质量。
②相对原子质量是一个比值,有单位
③相对原子质量≈质子数+ 中子数。
1 个 X原子的实际质量
一个碳-12原子的实际质量/12
①X原子的相对原子质量 =
④原子的相对原子质量越大其实际质量就越大。
⑤原子的相对原子质量之比等于其实际质量之比。
构成原子的粒子的质量
1.008
1.007
1/1836
相对质量
1.675×10-27
1.673×10-27
9.109×10-31
质量/kg
中子
质子
原子核
电子
构成原子的粒子
可以说原子的质量全部集中在原子核上即:相对原子质量=质子数+中子数
几种原子的质量
1. 674×10-27
氢原子
1.993×10-26
碳原子
9.288×10-26
铁原子
2.657×10-26
氧原子
相对原子质量
实际质量/kg
几种常见原子
1
12
16
56
7
6
6
6
中子数
质子数
原子
碳-12
碳-13
碳原子
1、原子是由_________和_________构成的。
2、构成原子的粒子有_____、_____、_______。其中,______带正电,_______带负电,_______不带电,________绕着________做高速运动。________占据体积很小,却集中了原子的主要质量。
综合应用
原子核
核外电子
质子
电子
中子
质子
电子
中子
电子
原子核
原子核
综合应用
3、将①分子②原子③质子④中子⑤电子等粒子用序号分别填 入下列适当空格中:
(1)构成物质的基本粒子是________
(2)构成原子的基本粒子是_______
(3)显电中性(不带电)的粒子是_________
(4)带正电的粒子是______
(5)化学变化中种类一定改变的粒子是______,决定原子种类的粒子是 。
(6)原子中数目一定相等的粒子是________
①②
③④⑤
①②④
③
①
③⑤
③
1. 英国科学家道尔顿于19世纪初提出了近代原子学说。他认为物质是由原子构成的,这些原子是微小的、不可分割的实心球体。请你指出道尔顿原子学说中与现代科学实验证明的事实不相符的地方:
(1)________________________________
(2)________________________________
(3)________________________________
物质并不都是由原子构成的,分子、离子也可以构成物质。
原子可分为原子核和核外电子。
原子不是实心球体,原子内部有很大空间。
物质都是由原子构成的
不可分割
实心球体
拓展延伸
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
