第一章 酸碱盐-除杂题型专练(含解析)
图片预览



文档简介
中小学教育资源及组卷应用平台
酸碱盐-除杂题型
(2020·浙江杭州市·九年级期末)某CO气体中含有少量的CO2和H2O,为了得到纯净、干燥的CO,除杂装置(如图)的导管按气流方向连接顺序是(
)
A.a→b→c→d
B.b→a→c→d
C.c→d→b→a
D.d→c→b→a
除去食盐溶液中的SO42﹣、Ca2+、Mg2+,进行下列操作:①过滤;②加适量稀盐酸;③加过量NaOH溶液;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。合理的操作顺序是
(
)
A.⑤③④①②
B.⑤④③②①
C.③④⑤①②
D.④③⑤①②
“除杂”是必须掌握的一项基本化学技能,下表除去杂质的方法中正确的是(
)
选项
物质
杂质
除杂质的方法
A
CaCl2溶液
稀盐酸
过量碳酸钙、过滤
B
KOH溶液
KCl
适量稀盐酸
C
NaCl溶液
Na2CO3
适量硝酸钙溶液、过滤
D
O2
CO
通过灼热的氧化铜
A.A
B.B
C.C
D.D
(2020·杭州市开元中学九年级月考)下列除去杂质的方法中正确的是( )
选项
物质
杂质
除杂质的方法
A
CO2
CO
将气体通入足量氢氧化钠溶液
B
CaCl2
CaCO3
加适量水溶液、过滤、蒸发结晶
C
银粉
锌粉
加入过量硫酸亚铁溶液,过滤
D
NaCl溶液
Na2CO3
加适量硝酸钙溶液,过滤
A.A
B.B
C.C
D.D
(2020·萧山区朝晖初级中学九年级月考)下列除去杂质的操作不正确的是( )
序号
物质
杂质
除杂试剂
提纯方法
A
FeC12
CuC12
水、铁粉
过滤、蒸发、结晶
B
NaC1
Na2CO3
稀盐酸
蒸发、结晶
C
CO2
CO
石灰水
干燥
D
MnO2
KC1
水
过滤、洗涤、干燥
A.A
B.B
C.C
D.D
(2020·杭州市三墩中学九年级期中)用括号中的试剂除去下列物质中所含杂质、所用药品错误的是(
)
A.NaOH溶液中混有Na2CO3(稀H2SO4)
B.NaCl溶液中混有Na2SO4(BaCl2溶液)
C.KCl溶液中混有K2CO3(稀HCl)
D.CO中混有CO2(NaOH溶液)
某溶液中含有较多的Na2SO4和少量的Fe2(SO4)3,若用该溶液制取芒硝(Na2SO4.10H2O),可供选择的操作用:①加适量的H2SO4溶液;②加金属钠;③结晶;④加过量的NaOH溶液;⑤加强热脱结晶水;⑥过滤。下列操作正确的是
(
)
A.②⑥③
B.④⑥①③
C.④⑥③⑤
D.②⑥①③⑤
下列除去杂质的方法中,正确的是(
)
选项
物质(括号内为杂质)
去除杂质的方法
A.
NaCl(Na2CO3)
加入适量的Ca(OH)2溶液、过滤
B.
CaO(CaCO3)
加水、过滤
C.
Fe(Zn)
加过量FeSO4溶液、过滤
D.
H2SO4(HNO3)
加Ba(NO3)2溶液、过滤
A.A
B.B
C.C
D.D
(2020·浙江杭州市·九年级月考)除杂和提纯是科学学科要求的基本技能。下列有关除去主要物质中的杂质说法中,是用化学方法且所用试剂和方法均正确的是( )
选项
主要物质
杂质
除杂质所用试剂和方法
A
溶液
溶液
先加过量Fe粉,再过滤
B
铜粉
铁粉
用磁铁吸引
C
点燃
D
HCl气体
先通过足量溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
为了探究实验室中久置的氢氧化钠固体的变质情况,同学们进行如图所示的实验。下列分析和结论中,正确的是
A.若Ⅱ、Ⅲ均有明显现象,则说明样品一定完全变质
B.若D为白色固体,则溶液A是Na2CO3溶液
C.若D为气体,则加入甲溶液的目的是证明样品已变质
D.若D为白色固体,且溶液C为红色,则样品一定部分变质
除去下列各物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
选项
物质(括号内为杂质)
除杂试剂及操作方法
A
二氧化碳(一氧化碳)
通入氧气,点燃
B
氧化钙(碳酸钙)
加入足量的水,过滤
C
铁粉(铜粉)
加入过量的稀硫酸,充分反应后过滤
D
硫酸铜溶液(稀硫酸)
加入过量的氧化铜,充分反应后过滤
A.A?
B.B?
C.C?
D.D
下列除杂方法正确的是( )
A.用CuSO4溶液除去铁粉中混有的铜粉
B.用CaCO3除去CaCl2溶液中混有的稀盐酸
C.用稀H2SO4除去NaCl中混有的Na2CO3
D.用点燃方法除去CO2中混有的CO
除去下列各组物质中的杂质,所用试剂和方法均正确的是(
)
选项
物质
杂质
除杂所用的试剂和方法
A
CaO固体
CaCO3固体
加入适量的稀盐酸
B
NaOH溶液
Ca(OH)2溶液
先加入过量的Na2CO3溶液,再过滤
C
CO2气体
CO气体
点燃
D
H2气体
HCl气体
先通过NaOH溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
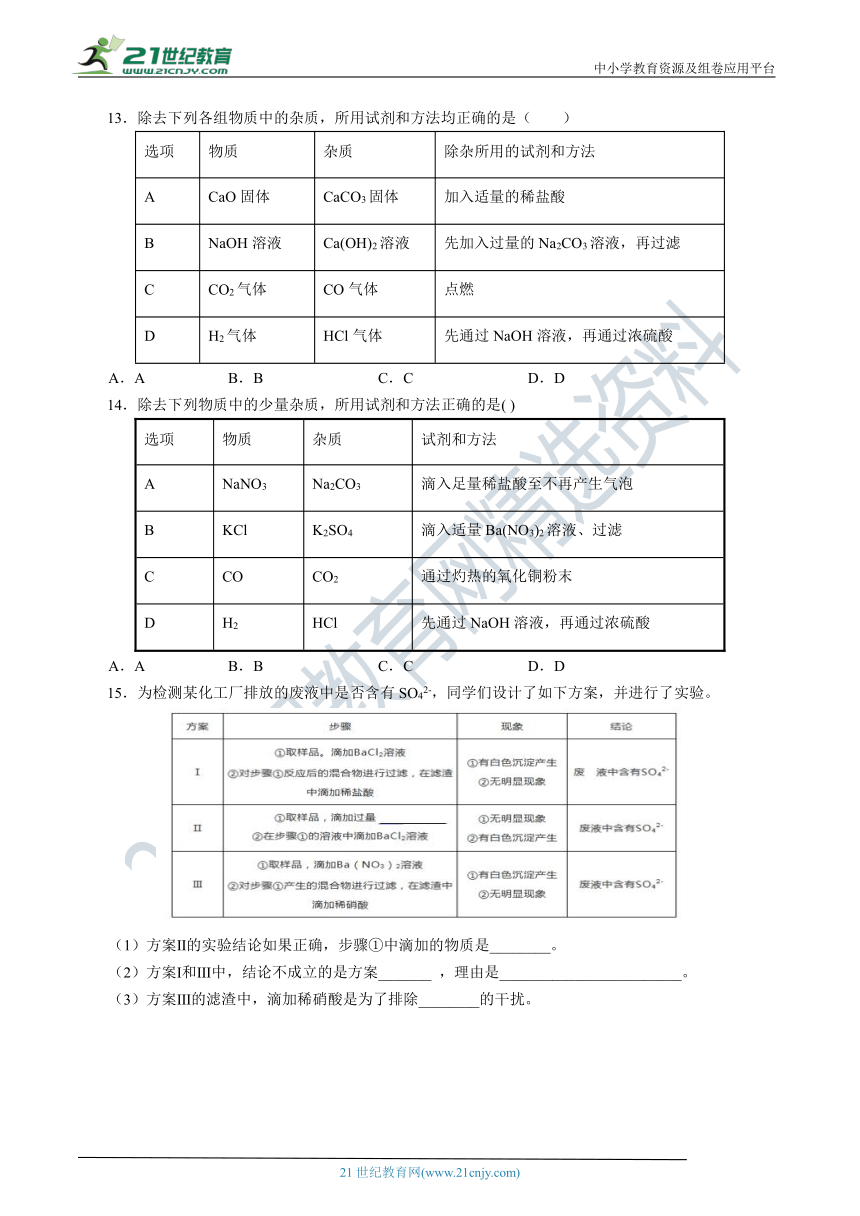
除去下列物质中的少量杂质,所用试剂和方法正确的是(
)
选项
物质
杂质
试剂和方法
A
NaNO3
Na2CO3
滴入足量稀盐酸至不再产生气泡
B
KCl
K2SO4
滴入适量Ba(NO3)2溶液、过滤
C
CO
CO2
通过灼热的氧化铜粉末
D
H2
HCl
先通过NaOH溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
为检测某化工厂排放的废液中是否含有SO42-,同学们设计了如下方案,并进行了实验。
(1)方案Ⅱ的实验结论如果正确,步骤①中滴加的物质是________。
(2)方案Ⅰ和Ⅲ中,结论不成立的是方案_______
,理由是________________________。
(3)方案Ⅲ的滤渣中,滴加稀硝酸是为了排除________的干扰。
(2020·浙江杭州市·九年级月考)为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是(
)
选项
物质
操作方法
A
Fe(Fe2O3)
加入过量稀盐酸,充分反应后过滤
B
CaO粉末(CaCO3粉末)
加足量的水,充分搅拌后过滤
C
NaOH溶液[Ca(OH)2溶液]
通入过量CO2气体,充分反应后过滤
D
CuSO4溶液(硫酸)
加入过量CuO粉末,加热,充分反应后过滤
A.A
B.B
C.C
D.D
为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案并进行实验。
(1)加入CaCl2溶液后,分离除去沉淀A的实验操作方法是_________________。
(2)同学们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,
请写出固体物质B中杂质的成分________________________(用化学式表示)。
(3)同学们继续探究后又提出新的方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入。
写出有关反应的化学方程式:_________________________________________。
酸碱盐-除杂题型
(2020·浙江杭州市·九年级期末)某CO气体中含有少量的CO2和H2O,为了得到纯净、干燥的CO,除杂装置(如图)的导管按气流方向连接顺序是(
)
A.a→b→c→d
B.b→a→c→d
C.c→d→b→a
D.d→c→b→a
【答案】C
【详解】要除去CO中的二氧化碳和水,要先用氢氧化钠溶液除二氧化碳,然后再用浓硫酸除水,为使药品充分接触,导管要长进短出,顺序为
c→d→b→a
;
故答案为:C。
除去食盐溶液中的SO42﹣、Ca2+、Mg2+,进行下列操作:①过滤;②加适量稀盐酸;③加过量NaOH溶液;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。合理的操作顺序是
(
)
A.⑤③④①②
B.⑤④③②①
C.③④⑤①②
D.④③⑤①②
【答案】A
【分析】食盐溶液中的SO42﹣、Ca2+、Mg2+,可以依次向里面加入氯化钡、氢氧化钠、碳酸钠将它们转化为沉淀而除去。
【详解】食盐中有硫酸钠、氯化镁和氯化钙等可溶性杂质。除去食盐溶液中的SO42﹣、Ca2+、Mg2+,可以依次向里面加入氯化钡、氢氧化钠、碳酸钠将其转化为沉淀,过滤除去沉淀,最后加稀盐酸可以除去多余的碳酸钠、氢氧化钠,得到精盐水。最后蒸发结晶的得到精盐。
故选A。
【点睛】除去食盐中有硫酸钠、氯化镁和氯化钙等可溶性杂质,特别注意两个先后:先加氯化钡后加碳酸钠,多余的氯化钡用碳酸钠除去;先过滤后加稀盐酸,以免生成的碳酸钙、氢氧化镁和稀盐酸反应。
“除杂”是必须掌握的一项基本化学技能,下表除去杂质的方法中正确的是(
)
选项
物质
杂质
除杂质的方法
A
CaCl2溶液
稀盐酸
过量碳酸钙、过滤
B
KOH溶液
KCl
适量稀盐酸
C
NaCl溶液
Na2CO3
适量硝酸钙溶液、过滤
D
O2
CO
通过灼热的氧化铜
A.A
B.B
C.C
D.D
【答案】A
【详解】A、稀盐酸能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。B、KOH溶液能与适量稀盐酸反应生成氯化钾和水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。C、硝酸钡能与Na2CO3溶液反应生成碳酸钡沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,故选项所采取的方法错误。D、CO能与灼热的氧化铜反应生成铜和二氧化碳,且一氧化碳与氧气在加热时易发生爆炸,能除去杂质但引入了新的杂质二氧化碳,不符合除杂原则,故选项所采取的方法错误。
故选A。
(2020·杭州市开元中学九年级月考)下列除去杂质的方法中正确的是( )
选项
物质
杂质
除杂质的方法
A
CO2
CO
将气体通入足量氢氧化钠溶液
B
CaCl2
CaCO3
加适量水溶液、过滤、蒸发结晶
C
银粉
锌粉
加入过量硫酸亚铁溶液,过滤
D
NaCl溶液
Na2CO3
加适量硝酸钙溶液,过滤
A.A
B.B
C.C
D.D
【答案】B
【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、二氧化碳能与氢氧化钠溶液反应生成碳酸钠和水,一氧化碳不与氢氧化钠溶液反应,不符合除杂原则,故A不正确;B、碳酸钙不溶于水,加适量水溶液、过滤掉碳酸钙,蒸发结晶得到氯化钙,故B正确;C、锌粉能与过量硫酸亚铁溶液反应生成硫酸锌溶液和铁,引入了新的杂质铁,故C不正确;D、碳酸钠能与适量硝酸钙溶液反应生成碳酸钙沉淀和硝酸钠,引入了新的杂质硝酸钠,故D不正确。故选B。
【点睛】除杂条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
(2020·萧山区朝晖初级中学九年级月考)下列除去杂质的操作不正确的是( )
序号
物质
杂质
除杂试剂
提纯方法
A
FeC12
CuC12
水、铁粉
过滤、蒸发、结晶
B
NaC1
Na2CO3
稀盐酸
蒸发、结晶
C
CO2
CO
石灰水
干燥
D
MnO2
KC1
水
过滤、洗涤、干燥
A.A
B.B
C.C
D.D
【答案】C
【详解】A、铁能置换出氯化铜溶液中的铜,生成氯化亚铁,不会带入新的杂质,过滤、蒸发、结晶后能得到纯净的氯化亚铁,故A操作正确;B、碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,蒸发、结晶后得到纯净的氯化钠,故B操作正确;C、二氧化碳和石灰水反应生成碳酸钙和水,会把原物质除去,故C操作错误;D、二氧化锰不溶于水,而氯化钾能够溶于水,所以可以通过溶解、过滤和洗涤、干燥的方法来得到二氧化锰,故D操作正确。
故选C。
(2020·杭州市三墩中学九年级期中)用括号中的试剂除去下列物质中所含杂质、所用药品错误的是(
)
A.NaOH溶液中混有Na2CO3(稀H2SO4)
B.NaCl溶液中混有Na2SO4(BaCl2溶液)
C.KCl溶液中混有K2CO3(稀HCl)
D.CO中混有CO2(NaOH溶液)
【答案】A
【详解】A、用稀硫酸除去NaOH溶液中混有Na2CO3,硫酸虽然能够除去碳酸钠,但同时也把氢氧化钠除去了,且会引入新杂质硫酸钠,符合题意;
B、用BaC12溶液除去NaCl溶液中混有Na2SO4
,氯化钠与氯化钡不反应,但氯化钡能与硫酸钠反应生成氯化钠和硫酸钡沉淀,从而除去了硫酸钠,同时还生成氯化钠,不符合题意;C、用稀盐酸除去KCl溶液中混有K2CO3,盐酸不与氯化钾反应,但能与碳酸钾反应,生成二氧化碳气体、水和氯化钾,从而除去了碳酸钾,同时还生成了氯化钾,不符合题意;D、用NaOH
溶液除去CO中混有CO2
,氢氧化钠溶液不与一氧化碳反应,但能与二氧化碳反应生成碳酸钠和水,从则吸收的二氧化碳,不符合题意。故选A。
【点睛】用化学方法除去某物质中少量杂质时,所用物质不能与主要物质反应,且要能与杂质反应生成和主要物质不同状态的物质。
某溶液中含有较多的Na2SO4和少量的Fe2(SO4)3,若用该溶液制取芒硝(Na2SO4.10H2O),可供选择的操作用:①加适量的H2SO4溶液;②加金属钠;③结晶;④加过量的NaOH溶液;⑤加强热脱结晶水;⑥过滤。下列操作正确的是
(
)
A.②⑥③
B.④⑥①③
C.④⑥③⑤
D.②⑥①③⑤
【答案】B
【详解】通过分析可以选择的操作,可以先加入过量的氢氧化钠将铁离子完全沉淀,然后进行过滤,再加入适量的硫酸将前面反应剩余的氢氧化钠转化为硫酸钠,最后将溶液结晶就可以得到硫酸钠晶体,
故选B。
下列除去杂质的方法中,正确的是(
)
选项
物质(括号内为杂质)
去除杂质的方法
A.
NaCl(Na2CO3)
加入适量的Ca(OH)2溶液、过滤
B.
CaO(CaCO3)
加水、过滤
C.
Fe(Zn)
加过量FeSO4溶液、过滤
D.
H2SO4(HNO3)
加Ba(NO3)2溶液、过滤
A.A
B.B
C.C
D.D
【答案】C
【详解】A.Na2CO3能与适量的Ca(OH)2溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质氢氧化钠,不符合除杂原则,故A错误;B.碳酸钙不溶于水,氧化钙溶于水后生成氢氧化钙,会把原物质除去,不符合除杂原则,故B错误;C.锌能与过量FeSO4溶液反应生成硫酸锌溶液和铁,能除去杂质且没有引入新的杂质,符合除杂原则,故C正确;D.H2SO4能与Ba(NO3)2溶液反应生成硫酸钡沉淀和硝酸,反而会把原物质除去,不符合除杂原则,故D错误;
故选C。
(2020·浙江杭州市·九年级月考)除杂和提纯是科学学科要求的基本技能。下列有关除去主要物质中的杂质说法中,是用化学方法且所用试剂和方法均正确的是( )
选项
主要物质
杂质
除杂质所用试剂和方法
A
溶液
溶液
先加过量Fe粉,再过滤
B
铜粉
铁粉
用磁铁吸引
C
点燃
D
HCl气体
先通过足量溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
【答案】A
【详解】A、加入过量Fe粉,铁和氯化铜反应生成氯化亚铁和铜,再过滤得到氯化亚铁溶液,该选项是用化学方法且所用试剂和方法均正确,符合题意;B、用磁铁吸引,铁粉能被磁铁吸引,铜粉不能被磁铁吸引,从而把两种物质分离,该选项是物理方法,不符合题意;C、点燃时,二氧化碳、氧气都不能反应,该选项方法不正确,不符合题意;D、碳酸钠和盐酸反应生成二氧化碳气体,最终导致氢气中含有二氧化碳,该选项方法不正确,不符合题意。故选:A。
为了探究实验室中久置的氢氧化钠固体的变质情况,同学们进行如图所示的实验。下列分析和结论中,正确的是
A.若Ⅱ、Ⅲ均有明显现象,则说明样品一定完全变质
B.若D为白色固体,则溶液A是Na2CO3溶液
C.若D为气体,则加入甲溶液的目的是证明样品已变质
D.若D为白色固体,且溶液C为红色,则样品一定部分变质
【答案】C
【解析】试题分析:若D为气体,则加入甲溶液的目的是证明样品已变质,因为氢氧化钠变质会变为碳酸钠,而碳酸钠遇到酸会产生二氧化碳气体。故选C.
考点:氢氧化钠的变质与检验
除去下列各物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
选项
物质(括号内为杂质)
除杂试剂及操作方法
A
二氧化碳(一氧化碳)
通入氧气,点燃
B
氧化钙(碳酸钙)
加入足量的水,过滤
C
铁粉(铜粉)
加入过量的稀硫酸,充分反应后过滤
D
硫酸铜溶液(稀硫酸)
加入过量的氧化铜,充分反应后过滤
A.A?
B.B?
C.C?
D.D
【答案】D
【分析】除杂要求:不引入新的杂质,不能和原物质反应。
【详解】A、除去二氧化碳中的一氧化碳,通入氧气点燃,会引入新的气体杂质,且二氧化碳不支持燃烧,故A不正确;B、氧化钙中有碳酸钙杂质,加水氧化钙和水反应生成氢氧化钙,把原物质除去了,故B不正确;C、铁粉里面含有铜粉,加过量的稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜不参加反应,充分反应后过滤,把原物质除去了,故C不正确;D、硫酸铜溶液中含有稀硫酸,加过量的氧化铜,和稀硫酸反应生成硫酸铜和水,充分反应后过滤,可以除去稀硫酸,故D正确。故选D。
下列除杂方法正确的是( )
A.用CuSO4溶液除去铁粉中混有的铜粉
B.用CaCO3除去CaCl2溶液中混有的稀盐酸
C.用稀H2SO4除去NaCl中混有的Na2CO3
D.用点燃方法除去CO2中混有的CO
【答案】B
【解析】试题分析:A、除去铁粉中混有的铜粉,用CuSO4溶液不行,因为铁会与CuSO4溶液反应,而铜不会,错误,B、除去CaCl2溶液中混有的稀盐酸,加入CaCO3,发生反应:CaCO3+2HCl==CaCl2+H2O+CO2↑,正确,C、除去NaCl中混有的Na2CO3,用稀H2SO4不行,因为发生反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑,产生新的杂质Na2SO4,错误,D、用点燃方法除去CO2中混有的CO不行,因为二氧化碳既不燃烧也不支持燃烧,无法点燃,错误,故选B
除去下列各组物质中的杂质,所用试剂和方法均正确的是(
)
选项
物质
杂质
除杂所用的试剂和方法
A
CaO固体
CaCO3固体
加入适量的稀盐酸
B
NaOH溶液
Ca(OH)2溶液
先加入过量的Na2CO3溶液,再过滤
C
CO2气体
CO气体
点燃
D
H2气体
HCl气体
先通过NaOH溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
【答案】D
【详解】A、氧化钙和碳酸钙能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。B、Ca(OH)2溶液能与过量的Na2CO3溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质碳酸钠(过量的),不符合除杂原则,故选项所采取的方法错误。C、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误。D、HCl气体能与氢氧化钠溶液反应生成氯化钠和水,氢气不与氢氧化钠溶液反应,再通过浓硫酸进行干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选D。
除去下列物质中的少量杂质,所用试剂和方法正确的是(
)
选项
物质
杂质
试剂和方法
A
NaNO3
Na2CO3
滴入足量稀盐酸至不再产生气泡
B
KCl
K2SO4
滴入适量Ba(NO3)2溶液、过滤
C
CO
CO2
通过灼热的氧化铜粉末
D
H2
HCl
先通过NaOH溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
【答案】D
【详解】A、盐酸与杂质碳酸钠反应生成氯化钠,引入新杂质,选项错误;B、硝酸钡与杂质硫酸钾反应生成硝酸钠新杂质,选项错误;C、通过灼热的氧化铜粉末,一氧化碳能与氧化铜反应生成二氧化碳,得不到一氧化碳,并且不能除去二氧化碳,选项错误;D、杂质氯化氢能与氢氧化钠反应生成水,先通过NaOH溶液能除去氯化氢,浓硫酸具有吸水性,再通过浓硫酸能除去水得到纯净的氢气,选项正确。
为检测某化工厂排放的废液中是否含有SO42-,同学们设计了如下方案,并进行了实验。
(1)方案Ⅱ的实验结论如果正确,步骤①中滴加的物质是________。
(2)方案Ⅰ和Ⅲ中,结论不成立的是方案_______
,理由是________________________。
(3)方案Ⅲ的滤渣中,滴加稀硝酸是为了排除________的干扰。
【答案】稀盐酸
Ⅰ
不能排除Ag+的干扰
CO32-
【详解】(1)检验硫酸根离子是利用与钡离子产生不溶于酸的白色沉淀,所以实验①中加入的是稀盐酸,一个目的是提供酸环境,二是排除银离子的干扰;(2)根据方案Ⅰ中①取样品。滴加BaCl2溶液,有白色沉淀,②对步骤①反应后的混合物进行过滤,在滤渣中滴加稀盐酸,无明显现象,即白色沉淀不溶解,因为不溶于酸的白色沉淀有两个:硫酸钡和氯化银,加入氯化钡溶液后生成的白色沉淀,不一定是硫酸钡,有可能是氯化银,只要有银离子存在就行,所以该方案不合理;(3)滴加硝酸钡有白色沉淀,不一定是硫酸钡,碳酸钡也是白色沉淀,但碳酸钡沉淀溶于硝酸,硫酸钡不溶于硝酸,所以加入硝酸是为了排除碳酸根离子的干扰;故答案为:(1)稀盐酸????(2)方案Ⅰ;不能排除Ag+的干扰????(3)CO32-
【点睛】本题容易出错的地方是对方案Ⅰ的评价,要知道不溶于酸的白色沉淀有两个:硫酸钡和氯化银,加入氯化钡溶液后生成的白色沉淀,不一定是硫酸钡,有可能是氯化银,只要有银离子存在就行。
(2020·浙江杭州市·九年级月考)为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是(
)
选项
物质
操作方法
A
Fe(Fe2O3)
加入过量稀盐酸,充分反应后过滤
B
CaO粉末(CaCO3粉末)
加足量的水,充分搅拌后过滤
C
NaOH溶液[Ca(OH)2溶液]
通入过量CO2气体,充分反应后过滤
D
CuSO4溶液(硫酸)
加入过量CuO粉末,加热,充分反应后过滤
A.A
B.B
C.C
D.D
【答案】D
【详解】A、Fe和Fe2O3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。B、CaO粉末能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。C、Ca(OH)2溶液与和NaOH溶液均能与二氧化碳反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。D、硫酸能与过量CuO粉末反应生成硫酸铜和水,再过滤除去过量的氧化铜,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选D。
为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案并进行实验。
(1)加入CaCl2溶液后,分离除去沉淀A的实验操作方法是_________________。
(2)同学们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,
请写出固体物质B中杂质的成分________________________(用化学式表示)。
(3)同学们继续探究后又提出新的方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入。
写出有关反应的化学方程式:_________________________________________。
【答案】过滤
CaCl2
Na2CO3
+2HCl=2NaCl+H2O+CO2↑
【详解】(1)过滤是把不溶于液体的固体与液体分离的一种方法,加入CaCl2溶液后,分离除去沉淀A的实验操作方法是过滤.(2)氯化钙溶液是过量的,固体物质B中杂质的成分是氯化钙,其化学式为:CaCl2.(3)碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
故答案为(1)过滤(2)CaCl2;(3)Na2CO3+2HCl═2NaCl+H2O+CO2↑.
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
酸碱盐-除杂题型
(2020·浙江杭州市·九年级期末)某CO气体中含有少量的CO2和H2O,为了得到纯净、干燥的CO,除杂装置(如图)的导管按气流方向连接顺序是(
)
A.a→b→c→d
B.b→a→c→d
C.c→d→b→a
D.d→c→b→a
除去食盐溶液中的SO42﹣、Ca2+、Mg2+,进行下列操作:①过滤;②加适量稀盐酸;③加过量NaOH溶液;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。合理的操作顺序是
(
)
A.⑤③④①②
B.⑤④③②①
C.③④⑤①②
D.④③⑤①②
“除杂”是必须掌握的一项基本化学技能,下表除去杂质的方法中正确的是(
)
选项
物质
杂质
除杂质的方法
A
CaCl2溶液
稀盐酸
过量碳酸钙、过滤
B
KOH溶液
KCl
适量稀盐酸
C
NaCl溶液
Na2CO3
适量硝酸钙溶液、过滤
D
O2
CO
通过灼热的氧化铜
A.A
B.B
C.C
D.D
(2020·杭州市开元中学九年级月考)下列除去杂质的方法中正确的是( )
选项
物质
杂质
除杂质的方法
A
CO2
CO
将气体通入足量氢氧化钠溶液
B
CaCl2
CaCO3
加适量水溶液、过滤、蒸发结晶
C
银粉
锌粉
加入过量硫酸亚铁溶液,过滤
D
NaCl溶液
Na2CO3
加适量硝酸钙溶液,过滤
A.A
B.B
C.C
D.D
(2020·萧山区朝晖初级中学九年级月考)下列除去杂质的操作不正确的是( )
序号
物质
杂质
除杂试剂
提纯方法
A
FeC12
CuC12
水、铁粉
过滤、蒸发、结晶
B
NaC1
Na2CO3
稀盐酸
蒸发、结晶
C
CO2
CO
石灰水
干燥
D
MnO2
KC1
水
过滤、洗涤、干燥
A.A
B.B
C.C
D.D
(2020·杭州市三墩中学九年级期中)用括号中的试剂除去下列物质中所含杂质、所用药品错误的是(
)
A.NaOH溶液中混有Na2CO3(稀H2SO4)
B.NaCl溶液中混有Na2SO4(BaCl2溶液)
C.KCl溶液中混有K2CO3(稀HCl)
D.CO中混有CO2(NaOH溶液)
某溶液中含有较多的Na2SO4和少量的Fe2(SO4)3,若用该溶液制取芒硝(Na2SO4.10H2O),可供选择的操作用:①加适量的H2SO4溶液;②加金属钠;③结晶;④加过量的NaOH溶液;⑤加强热脱结晶水;⑥过滤。下列操作正确的是
(
)
A.②⑥③
B.④⑥①③
C.④⑥③⑤
D.②⑥①③⑤
下列除去杂质的方法中,正确的是(
)
选项
物质(括号内为杂质)
去除杂质的方法
A.
NaCl(Na2CO3)
加入适量的Ca(OH)2溶液、过滤
B.
CaO(CaCO3)
加水、过滤
C.
Fe(Zn)
加过量FeSO4溶液、过滤
D.
H2SO4(HNO3)
加Ba(NO3)2溶液、过滤
A.A
B.B
C.C
D.D
(2020·浙江杭州市·九年级月考)除杂和提纯是科学学科要求的基本技能。下列有关除去主要物质中的杂质说法中,是用化学方法且所用试剂和方法均正确的是( )
选项
主要物质
杂质
除杂质所用试剂和方法
A
溶液
溶液
先加过量Fe粉,再过滤
B
铜粉
铁粉
用磁铁吸引
C
点燃
D
HCl气体
先通过足量溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
为了探究实验室中久置的氢氧化钠固体的变质情况,同学们进行如图所示的实验。下列分析和结论中,正确的是
A.若Ⅱ、Ⅲ均有明显现象,则说明样品一定完全变质
B.若D为白色固体,则溶液A是Na2CO3溶液
C.若D为气体,则加入甲溶液的目的是证明样品已变质
D.若D为白色固体,且溶液C为红色,则样品一定部分变质
除去下列各物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
选项
物质(括号内为杂质)
除杂试剂及操作方法
A
二氧化碳(一氧化碳)
通入氧气,点燃
B
氧化钙(碳酸钙)
加入足量的水,过滤
C
铁粉(铜粉)
加入过量的稀硫酸,充分反应后过滤
D
硫酸铜溶液(稀硫酸)
加入过量的氧化铜,充分反应后过滤
A.A?
B.B?
C.C?
D.D
下列除杂方法正确的是( )
A.用CuSO4溶液除去铁粉中混有的铜粉
B.用CaCO3除去CaCl2溶液中混有的稀盐酸
C.用稀H2SO4除去NaCl中混有的Na2CO3
D.用点燃方法除去CO2中混有的CO
除去下列各组物质中的杂质,所用试剂和方法均正确的是(
)
选项
物质
杂质
除杂所用的试剂和方法
A
CaO固体
CaCO3固体
加入适量的稀盐酸
B
NaOH溶液
Ca(OH)2溶液
先加入过量的Na2CO3溶液,再过滤
C
CO2气体
CO气体
点燃
D
H2气体
HCl气体
先通过NaOH溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
除去下列物质中的少量杂质,所用试剂和方法正确的是(
)
选项
物质
杂质
试剂和方法
A
NaNO3
Na2CO3
滴入足量稀盐酸至不再产生气泡
B
KCl
K2SO4
滴入适量Ba(NO3)2溶液、过滤
C
CO
CO2
通过灼热的氧化铜粉末
D
H2
HCl
先通过NaOH溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
为检测某化工厂排放的废液中是否含有SO42-,同学们设计了如下方案,并进行了实验。
(1)方案Ⅱ的实验结论如果正确,步骤①中滴加的物质是________。
(2)方案Ⅰ和Ⅲ中,结论不成立的是方案_______
,理由是________________________。
(3)方案Ⅲ的滤渣中,滴加稀硝酸是为了排除________的干扰。
(2020·浙江杭州市·九年级月考)为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是(
)
选项
物质
操作方法
A
Fe(Fe2O3)
加入过量稀盐酸,充分反应后过滤
B
CaO粉末(CaCO3粉末)
加足量的水,充分搅拌后过滤
C
NaOH溶液[Ca(OH)2溶液]
通入过量CO2气体,充分反应后过滤
D
CuSO4溶液(硫酸)
加入过量CuO粉末,加热,充分反应后过滤
A.A
B.B
C.C
D.D
为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案并进行实验。
(1)加入CaCl2溶液后,分离除去沉淀A的实验操作方法是_________________。
(2)同学们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,
请写出固体物质B中杂质的成分________________________(用化学式表示)。
(3)同学们继续探究后又提出新的方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入。
写出有关反应的化学方程式:_________________________________________。
酸碱盐-除杂题型
(2020·浙江杭州市·九年级期末)某CO气体中含有少量的CO2和H2O,为了得到纯净、干燥的CO,除杂装置(如图)的导管按气流方向连接顺序是(
)
A.a→b→c→d
B.b→a→c→d
C.c→d→b→a
D.d→c→b→a
【答案】C
【详解】要除去CO中的二氧化碳和水,要先用氢氧化钠溶液除二氧化碳,然后再用浓硫酸除水,为使药品充分接触,导管要长进短出,顺序为
c→d→b→a
;
故答案为:C。
除去食盐溶液中的SO42﹣、Ca2+、Mg2+,进行下列操作:①过滤;②加适量稀盐酸;③加过量NaOH溶液;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。合理的操作顺序是
(
)
A.⑤③④①②
B.⑤④③②①
C.③④⑤①②
D.④③⑤①②
【答案】A
【分析】食盐溶液中的SO42﹣、Ca2+、Mg2+,可以依次向里面加入氯化钡、氢氧化钠、碳酸钠将它们转化为沉淀而除去。
【详解】食盐中有硫酸钠、氯化镁和氯化钙等可溶性杂质。除去食盐溶液中的SO42﹣、Ca2+、Mg2+,可以依次向里面加入氯化钡、氢氧化钠、碳酸钠将其转化为沉淀,过滤除去沉淀,最后加稀盐酸可以除去多余的碳酸钠、氢氧化钠,得到精盐水。最后蒸发结晶的得到精盐。
故选A。
【点睛】除去食盐中有硫酸钠、氯化镁和氯化钙等可溶性杂质,特别注意两个先后:先加氯化钡后加碳酸钠,多余的氯化钡用碳酸钠除去;先过滤后加稀盐酸,以免生成的碳酸钙、氢氧化镁和稀盐酸反应。
“除杂”是必须掌握的一项基本化学技能,下表除去杂质的方法中正确的是(
)
选项
物质
杂质
除杂质的方法
A
CaCl2溶液
稀盐酸
过量碳酸钙、过滤
B
KOH溶液
KCl
适量稀盐酸
C
NaCl溶液
Na2CO3
适量硝酸钙溶液、过滤
D
O2
CO
通过灼热的氧化铜
A.A
B.B
C.C
D.D
【答案】A
【详解】A、稀盐酸能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。B、KOH溶液能与适量稀盐酸反应生成氯化钾和水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。C、硝酸钡能与Na2CO3溶液反应生成碳酸钡沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,故选项所采取的方法错误。D、CO能与灼热的氧化铜反应生成铜和二氧化碳,且一氧化碳与氧气在加热时易发生爆炸,能除去杂质但引入了新的杂质二氧化碳,不符合除杂原则,故选项所采取的方法错误。
故选A。
(2020·杭州市开元中学九年级月考)下列除去杂质的方法中正确的是( )
选项
物质
杂质
除杂质的方法
A
CO2
CO
将气体通入足量氢氧化钠溶液
B
CaCl2
CaCO3
加适量水溶液、过滤、蒸发结晶
C
银粉
锌粉
加入过量硫酸亚铁溶液,过滤
D
NaCl溶液
Na2CO3
加适量硝酸钙溶液,过滤
A.A
B.B
C.C
D.D
【答案】B
【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、二氧化碳能与氢氧化钠溶液反应生成碳酸钠和水,一氧化碳不与氢氧化钠溶液反应,不符合除杂原则,故A不正确;B、碳酸钙不溶于水,加适量水溶液、过滤掉碳酸钙,蒸发结晶得到氯化钙,故B正确;C、锌粉能与过量硫酸亚铁溶液反应生成硫酸锌溶液和铁,引入了新的杂质铁,故C不正确;D、碳酸钠能与适量硝酸钙溶液反应生成碳酸钙沉淀和硝酸钠,引入了新的杂质硝酸钠,故D不正确。故选B。
【点睛】除杂条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
(2020·萧山区朝晖初级中学九年级月考)下列除去杂质的操作不正确的是( )
序号
物质
杂质
除杂试剂
提纯方法
A
FeC12
CuC12
水、铁粉
过滤、蒸发、结晶
B
NaC1
Na2CO3
稀盐酸
蒸发、结晶
C
CO2
CO
石灰水
干燥
D
MnO2
KC1
水
过滤、洗涤、干燥
A.A
B.B
C.C
D.D
【答案】C
【详解】A、铁能置换出氯化铜溶液中的铜,生成氯化亚铁,不会带入新的杂质,过滤、蒸发、结晶后能得到纯净的氯化亚铁,故A操作正确;B、碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,蒸发、结晶后得到纯净的氯化钠,故B操作正确;C、二氧化碳和石灰水反应生成碳酸钙和水,会把原物质除去,故C操作错误;D、二氧化锰不溶于水,而氯化钾能够溶于水,所以可以通过溶解、过滤和洗涤、干燥的方法来得到二氧化锰,故D操作正确。
故选C。
(2020·杭州市三墩中学九年级期中)用括号中的试剂除去下列物质中所含杂质、所用药品错误的是(
)
A.NaOH溶液中混有Na2CO3(稀H2SO4)
B.NaCl溶液中混有Na2SO4(BaCl2溶液)
C.KCl溶液中混有K2CO3(稀HCl)
D.CO中混有CO2(NaOH溶液)
【答案】A
【详解】A、用稀硫酸除去NaOH溶液中混有Na2CO3,硫酸虽然能够除去碳酸钠,但同时也把氢氧化钠除去了,且会引入新杂质硫酸钠,符合题意;
B、用BaC12溶液除去NaCl溶液中混有Na2SO4
,氯化钠与氯化钡不反应,但氯化钡能与硫酸钠反应生成氯化钠和硫酸钡沉淀,从而除去了硫酸钠,同时还生成氯化钠,不符合题意;C、用稀盐酸除去KCl溶液中混有K2CO3,盐酸不与氯化钾反应,但能与碳酸钾反应,生成二氧化碳气体、水和氯化钾,从而除去了碳酸钾,同时还生成了氯化钾,不符合题意;D、用NaOH
溶液除去CO中混有CO2
,氢氧化钠溶液不与一氧化碳反应,但能与二氧化碳反应生成碳酸钠和水,从则吸收的二氧化碳,不符合题意。故选A。
【点睛】用化学方法除去某物质中少量杂质时,所用物质不能与主要物质反应,且要能与杂质反应生成和主要物质不同状态的物质。
某溶液中含有较多的Na2SO4和少量的Fe2(SO4)3,若用该溶液制取芒硝(Na2SO4.10H2O),可供选择的操作用:①加适量的H2SO4溶液;②加金属钠;③结晶;④加过量的NaOH溶液;⑤加强热脱结晶水;⑥过滤。下列操作正确的是
(
)
A.②⑥③
B.④⑥①③
C.④⑥③⑤
D.②⑥①③⑤
【答案】B
【详解】通过分析可以选择的操作,可以先加入过量的氢氧化钠将铁离子完全沉淀,然后进行过滤,再加入适量的硫酸将前面反应剩余的氢氧化钠转化为硫酸钠,最后将溶液结晶就可以得到硫酸钠晶体,
故选B。
下列除去杂质的方法中,正确的是(
)
选项
物质(括号内为杂质)
去除杂质的方法
A.
NaCl(Na2CO3)
加入适量的Ca(OH)2溶液、过滤
B.
CaO(CaCO3)
加水、过滤
C.
Fe(Zn)
加过量FeSO4溶液、过滤
D.
H2SO4(HNO3)
加Ba(NO3)2溶液、过滤
A.A
B.B
C.C
D.D
【答案】C
【详解】A.Na2CO3能与适量的Ca(OH)2溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质氢氧化钠,不符合除杂原则,故A错误;B.碳酸钙不溶于水,氧化钙溶于水后生成氢氧化钙,会把原物质除去,不符合除杂原则,故B错误;C.锌能与过量FeSO4溶液反应生成硫酸锌溶液和铁,能除去杂质且没有引入新的杂质,符合除杂原则,故C正确;D.H2SO4能与Ba(NO3)2溶液反应生成硫酸钡沉淀和硝酸,反而会把原物质除去,不符合除杂原则,故D错误;
故选C。
(2020·浙江杭州市·九年级月考)除杂和提纯是科学学科要求的基本技能。下列有关除去主要物质中的杂质说法中,是用化学方法且所用试剂和方法均正确的是( )
选项
主要物质
杂质
除杂质所用试剂和方法
A
溶液
溶液
先加过量Fe粉,再过滤
B
铜粉
铁粉
用磁铁吸引
C
点燃
D
HCl气体
先通过足量溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
【答案】A
【详解】A、加入过量Fe粉,铁和氯化铜反应生成氯化亚铁和铜,再过滤得到氯化亚铁溶液,该选项是用化学方法且所用试剂和方法均正确,符合题意;B、用磁铁吸引,铁粉能被磁铁吸引,铜粉不能被磁铁吸引,从而把两种物质分离,该选项是物理方法,不符合题意;C、点燃时,二氧化碳、氧气都不能反应,该选项方法不正确,不符合题意;D、碳酸钠和盐酸反应生成二氧化碳气体,最终导致氢气中含有二氧化碳,该选项方法不正确,不符合题意。故选:A。
为了探究实验室中久置的氢氧化钠固体的变质情况,同学们进行如图所示的实验。下列分析和结论中,正确的是
A.若Ⅱ、Ⅲ均有明显现象,则说明样品一定完全变质
B.若D为白色固体,则溶液A是Na2CO3溶液
C.若D为气体,则加入甲溶液的目的是证明样品已变质
D.若D为白色固体,且溶液C为红色,则样品一定部分变质
【答案】C
【解析】试题分析:若D为气体,则加入甲溶液的目的是证明样品已变质,因为氢氧化钠变质会变为碳酸钠,而碳酸钠遇到酸会产生二氧化碳气体。故选C.
考点:氢氧化钠的变质与检验
除去下列各物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
选项
物质(括号内为杂质)
除杂试剂及操作方法
A
二氧化碳(一氧化碳)
通入氧气,点燃
B
氧化钙(碳酸钙)
加入足量的水,过滤
C
铁粉(铜粉)
加入过量的稀硫酸,充分反应后过滤
D
硫酸铜溶液(稀硫酸)
加入过量的氧化铜,充分反应后过滤
A.A?
B.B?
C.C?
D.D
【答案】D
【分析】除杂要求:不引入新的杂质,不能和原物质反应。
【详解】A、除去二氧化碳中的一氧化碳,通入氧气点燃,会引入新的气体杂质,且二氧化碳不支持燃烧,故A不正确;B、氧化钙中有碳酸钙杂质,加水氧化钙和水反应生成氢氧化钙,把原物质除去了,故B不正确;C、铁粉里面含有铜粉,加过量的稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜不参加反应,充分反应后过滤,把原物质除去了,故C不正确;D、硫酸铜溶液中含有稀硫酸,加过量的氧化铜,和稀硫酸反应生成硫酸铜和水,充分反应后过滤,可以除去稀硫酸,故D正确。故选D。
下列除杂方法正确的是( )
A.用CuSO4溶液除去铁粉中混有的铜粉
B.用CaCO3除去CaCl2溶液中混有的稀盐酸
C.用稀H2SO4除去NaCl中混有的Na2CO3
D.用点燃方法除去CO2中混有的CO
【答案】B
【解析】试题分析:A、除去铁粉中混有的铜粉,用CuSO4溶液不行,因为铁会与CuSO4溶液反应,而铜不会,错误,B、除去CaCl2溶液中混有的稀盐酸,加入CaCO3,发生反应:CaCO3+2HCl==CaCl2+H2O+CO2↑,正确,C、除去NaCl中混有的Na2CO3,用稀H2SO4不行,因为发生反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑,产生新的杂质Na2SO4,错误,D、用点燃方法除去CO2中混有的CO不行,因为二氧化碳既不燃烧也不支持燃烧,无法点燃,错误,故选B
除去下列各组物质中的杂质,所用试剂和方法均正确的是(
)
选项
物质
杂质
除杂所用的试剂和方法
A
CaO固体
CaCO3固体
加入适量的稀盐酸
B
NaOH溶液
Ca(OH)2溶液
先加入过量的Na2CO3溶液,再过滤
C
CO2气体
CO气体
点燃
D
H2气体
HCl气体
先通过NaOH溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
【答案】D
【详解】A、氧化钙和碳酸钙能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。B、Ca(OH)2溶液能与过量的Na2CO3溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质碳酸钠(过量的),不符合除杂原则,故选项所采取的方法错误。C、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误。D、HCl气体能与氢氧化钠溶液反应生成氯化钠和水,氢气不与氢氧化钠溶液反应,再通过浓硫酸进行干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选D。
除去下列物质中的少量杂质,所用试剂和方法正确的是(
)
选项
物质
杂质
试剂和方法
A
NaNO3
Na2CO3
滴入足量稀盐酸至不再产生气泡
B
KCl
K2SO4
滴入适量Ba(NO3)2溶液、过滤
C
CO
CO2
通过灼热的氧化铜粉末
D
H2
HCl
先通过NaOH溶液,再通过浓硫酸
A.A
B.B
C.C
D.D
【答案】D
【详解】A、盐酸与杂质碳酸钠反应生成氯化钠,引入新杂质,选项错误;B、硝酸钡与杂质硫酸钾反应生成硝酸钠新杂质,选项错误;C、通过灼热的氧化铜粉末,一氧化碳能与氧化铜反应生成二氧化碳,得不到一氧化碳,并且不能除去二氧化碳,选项错误;D、杂质氯化氢能与氢氧化钠反应生成水,先通过NaOH溶液能除去氯化氢,浓硫酸具有吸水性,再通过浓硫酸能除去水得到纯净的氢气,选项正确。
为检测某化工厂排放的废液中是否含有SO42-,同学们设计了如下方案,并进行了实验。
(1)方案Ⅱ的实验结论如果正确,步骤①中滴加的物质是________。
(2)方案Ⅰ和Ⅲ中,结论不成立的是方案_______
,理由是________________________。
(3)方案Ⅲ的滤渣中,滴加稀硝酸是为了排除________的干扰。
【答案】稀盐酸
Ⅰ
不能排除Ag+的干扰
CO32-
【详解】(1)检验硫酸根离子是利用与钡离子产生不溶于酸的白色沉淀,所以实验①中加入的是稀盐酸,一个目的是提供酸环境,二是排除银离子的干扰;(2)根据方案Ⅰ中①取样品。滴加BaCl2溶液,有白色沉淀,②对步骤①反应后的混合物进行过滤,在滤渣中滴加稀盐酸,无明显现象,即白色沉淀不溶解,因为不溶于酸的白色沉淀有两个:硫酸钡和氯化银,加入氯化钡溶液后生成的白色沉淀,不一定是硫酸钡,有可能是氯化银,只要有银离子存在就行,所以该方案不合理;(3)滴加硝酸钡有白色沉淀,不一定是硫酸钡,碳酸钡也是白色沉淀,但碳酸钡沉淀溶于硝酸,硫酸钡不溶于硝酸,所以加入硝酸是为了排除碳酸根离子的干扰;故答案为:(1)稀盐酸????(2)方案Ⅰ;不能排除Ag+的干扰????(3)CO32-
【点睛】本题容易出错的地方是对方案Ⅰ的评价,要知道不溶于酸的白色沉淀有两个:硫酸钡和氯化银,加入氯化钡溶液后生成的白色沉淀,不一定是硫酸钡,有可能是氯化银,只要有银离子存在就行。
(2020·浙江杭州市·九年级月考)为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是(
)
选项
物质
操作方法
A
Fe(Fe2O3)
加入过量稀盐酸,充分反应后过滤
B
CaO粉末(CaCO3粉末)
加足量的水,充分搅拌后过滤
C
NaOH溶液[Ca(OH)2溶液]
通入过量CO2气体,充分反应后过滤
D
CuSO4溶液(硫酸)
加入过量CuO粉末,加热,充分反应后过滤
A.A
B.B
C.C
D.D
【答案】D
【详解】A、Fe和Fe2O3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。B、CaO粉末能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。C、Ca(OH)2溶液与和NaOH溶液均能与二氧化碳反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。D、硫酸能与过量CuO粉末反应生成硫酸铜和水,再过滤除去过量的氧化铜,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选D。
为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案并进行实验。
(1)加入CaCl2溶液后,分离除去沉淀A的实验操作方法是_________________。
(2)同学们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,
请写出固体物质B中杂质的成分________________________(用化学式表示)。
(3)同学们继续探究后又提出新的方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入。
写出有关反应的化学方程式:_________________________________________。
【答案】过滤
CaCl2
Na2CO3
+2HCl=2NaCl+H2O+CO2↑
【详解】(1)过滤是把不溶于液体的固体与液体分离的一种方法,加入CaCl2溶液后,分离除去沉淀A的实验操作方法是过滤.(2)氯化钙溶液是过量的,固体物质B中杂质的成分是氯化钙,其化学式为:CaCl2.(3)碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
故答案为(1)过滤(2)CaCl2;(3)Na2CO3+2HCl═2NaCl+H2O+CO2↑.
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
