3.2溶液组成的定量表示同步课堂练习-2021-2022学年九年级化学鲁教版上册(word版 含答案)
文档属性
| 名称 | 3.2溶液组成的定量表示同步课堂练习-2021-2022学年九年级化学鲁教版上册(word版 含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 76.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-05 07:18:19 | ||
图片预览

文档简介
《3.2溶液组成的定量表示》同步课堂练习
一、选择题:
1、影响固体物质溶解度的操作是( )
A.加热 B.振荡 C.搅拌 D.加压
2、60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是( )
A.溶质质量:溶剂质量=10:11
B.溶剂质量:溶液质量=20:21
C.溶质质量:溶剂质量=11:10
D.溶液质量:溶质质量=21:10
3、将20℃的KNO3饱和溶液升温至50℃(不考虑水分蒸发),一定发生改变的是( )
A.溶质的质量分数 B.溶质的质量
C.KNO3?的溶解度 D.溶液的质量
4、下列有关溶液的说法中,不正确的是( )
A.物质溶解过程中通常会伴随着热量的变化
B.在氯化钾溶液稀释的过程中,氯化钾的质量不变
C.在压强不变时,升高温度可以增大CO2在水中的溶解度
D.熟石灰的饱和溶液通过降低温度或者增加溶剂转化为不饱和溶液
5、有M、N两种物质,20℃时20克水最多溶解5克M,60℃时100克水里最多溶解10克N。则M、N的溶解度大小是( )
A.M>N B.M<N C.M=N D.无法比较
6、不同温度时,NH4Cl固体的溶解度如下表所示。20℃时,将50g NH4Cl固体加入盛有100g水的烧杯中,充分溶解得到溶液。下列说法正确的是( )
温度/℃ 20 40 60 80
溶解度/g 37.2 45.8 55.2 65.6
A.NH4Cl的溶解度随温度升高而减小
B.烧杯中溶液的质量为150g
C.所得溶液为饱和溶液
D.将烧杯中溶液升温至60℃后,溶质质量分数为50%
7、打开一瓶盐汽水,有大量二氧化碳气体逸出,相关分析正确的是( )
A.盐汽水中只有二氧化碳一种溶质
B.打开汽水瓶,汽水是二氧化碳的饱和溶液
C.剩余汽水中不含二氧化碳
D.升高温度汽水变为二氧化碳的不饱和溶液
8、某汽水中含有二氧化碳、白砂糖、柠檬酸和水等多种物质,打开汽水瓶盖,有大量气泡逸出,说法正确的是( )
A.白砂糖的溶解度减小
B.二氧化碳的溶解度减小
C.气泡逸出后的溶液为二氧化碳的不饱和溶液
D.汽水溶液质量不变
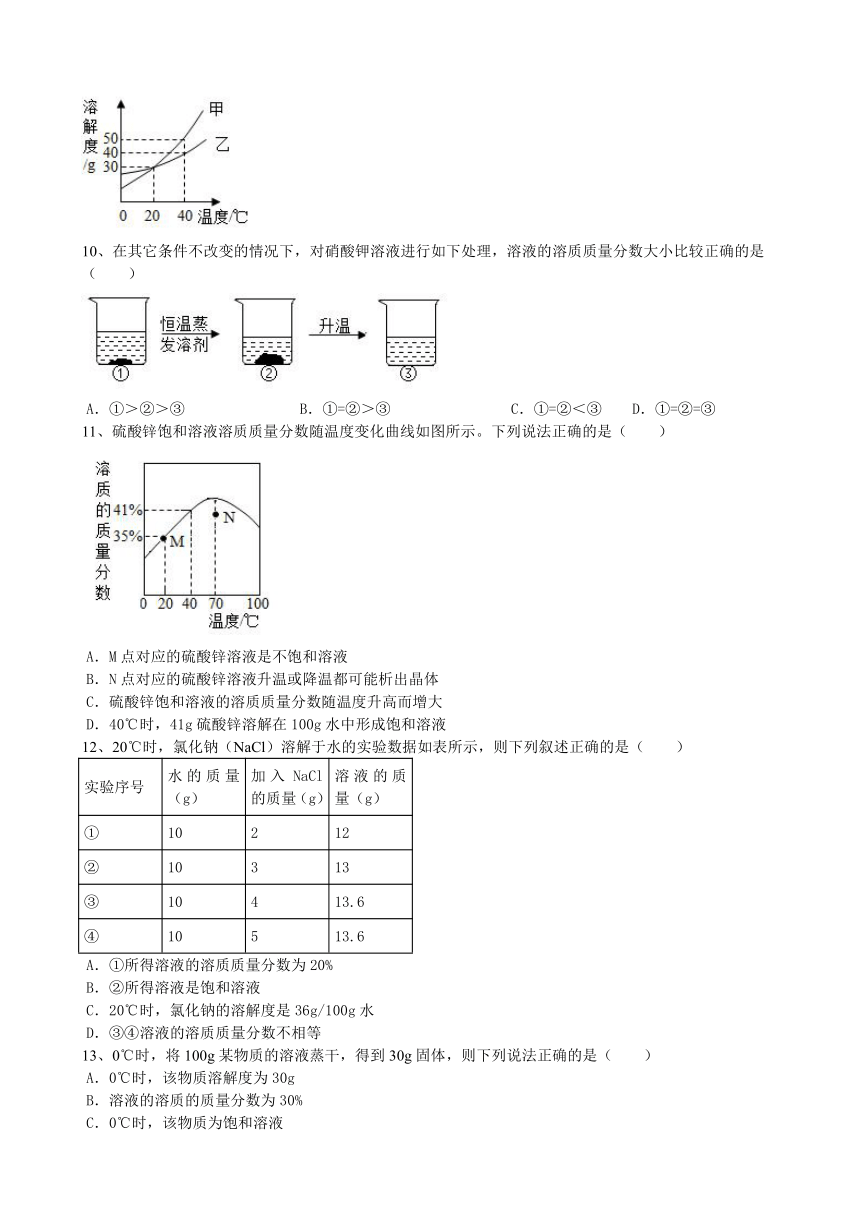
9、甲、乙两种固体物质的溶解度曲线如图所示。下列说法不正确的是( )
A.40℃时,甲的溶解度大于乙的溶解度
B.甲、乙物质的溶解度都随温度的升高而增大
C.将20℃时甲的饱和溶液降温至0℃,无晶体析出
D.将40℃时乙的饱和溶液降温至20℃,仍然是饱和溶液
10、在其它条件不改变的情况下,对硝酸钾溶液进行如下处理,溶液的溶质质量分数大小比较正确的是( )
A.①>②>③ B.①=②>③ C.①=②<③ D.①=②=③
11、硫酸锌饱和溶液溶质质量分数随温度变化曲线如图所示。下列说法正确的是( )
A.M点对应的硫酸锌溶液是不饱和溶液
B.N点对应的硫酸锌溶液升温或降温都可能析出晶体
C.硫酸锌饱和溶液的溶质质量分数随温度升高而增大
D.40℃时,41g硫酸锌溶解在100g水中形成饱和溶液
12、20℃时,氯化钠(NaCl)溶解于水的实验数据如表所示,则下列叙述正确的是( )
实验序号 水的质量(g) 加入NaCl的质量(g) 溶液的质量(g)
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.①所得溶液的溶质质量分数为20%
B.②所得溶液是饱和溶液
C.20℃时,氯化钠的溶解度是36g/100g水
D.③④溶液的溶质质量分数不相等
13、0℃时,将100g某物质的溶液蒸干,得到30g固体,则下列说法正确的是( )
A.0℃时,该物质溶解度为30g
B.溶液的溶质的质量分数为30%
C.0℃时,该物质为饱和溶液
D.无法计算该溶液的溶质的质量分数
14、20℃时,向下列3只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。
下列说法不正确的是( )
A.①中溶液的质量为120g
B.②中溶液的溶质质量分数为30%
C.将②中的溶液倒出一半,溶液中溶质质量分数不变
D.将③中溶液升温至40℃时,溶液中溶质质量分数增大
二、填空题:
1、根据NaCl和KNO3的溶解度数据表,回答下列问题:
温度/℃ 0 10 20 30 40 50 60 70
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138
(1)10℃时,NaCl的溶解度是? g;
(2)30℃时,溶解度较大的是? (选填“NaCl”或“KNO3”);
(3)下列分析正确的是? 。
A.10℃时,能够配制出溶质的质量分数为20.9%的KNO3溶液
B.20℃时,20g NaCl固体加入100g水,充分溶解后得到NaCl的不饱和溶液
C.20℃到30℃之间,能配制出溶质质量分数相等的NaCl饱和溶液和KNO3饱和溶液
D.将KNO3溶液经过某种操作后,析出KNO3晶体,过滤后所得溶液溶质的质量分数与原溶液相比,可能变大、变小或不变
2、向分别装有30g甲、乙物质的a、b烧杯中,各加入50g水,所得溶液的溶质质量分数随温度变化的趋势如图所示,回答下列问题:
(1)将乙物质换成? (填序号),该图像的变化趋势不变。
A.KNO3
B.NaCl
C.Ca(OH)2
(2)t2℃时,甲物质的溶解度为? 。
(3)下列描述正确的是? (填序号)。
A.在0℃时,乙物质恰好为饱和溶液
B.t1℃时,甲、乙两物质的溶解度相等
C.t2℃时,若将mg乙物质加入100g水中,充分溶解,得到(100+m)g的溶液
D.将a、b烧杯,从t3℃降温至t2℃,b烧杯所剩固体更少
(4)另取一杯甲的不饱和溶液,若将其变为饱和溶液,下列说法正确的是? (填序号)。
A.溶质质量一定增大
B.溶剂质量一定减少
C.溶质质量分数一定变大
D.溶液质量可能不变
3、下面是某小组进行的“哪些因素影响固体物质在水中的溶解度”的实验探究,请你完成探究报告.
探究实验:哪些因素影响固体物质在水中的溶解度?
(1)溶质种类的影响
在实验中要改变的因素是:溶质的种类;要保持不变的因素是: .
实验步骤:30℃时,用量筒各取5mL蒸馏水分别加入①、②两支试管中,再分别加入KNO3、Ca(OH)2各2g振荡,观察各物质溶解情况.
实验现象:试管①中KNO3全部溶解.试管②中有较多Ca(OH)2未溶.
实验结论:在 保持不变的情况下,不同种类的物质在水中的溶解度 .
(2)温度的影响(以KNO3为例)
在实验中要改变的因素是 ;要保持不变的因素是 .
实验步骤:用量筒各取5mL蒸馏水,分别加入①、②二支试管中,再加入5gKNO3晶体,将试管①保持在常温下,将试管②加热并保持在60%,振荡,观察各试管中KNO3的溶解情况.
实验现象:试管①中有多量KNO3未溶,试管②中KNO3全部溶解.
实验结论:在不同 下,同种固体物质在水中的溶解度不相等.
4、如表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答.
温度(℃) 10 20 30 40 50 60
甲 35.8 36.0 36.3 36.6 37.0 37.3
乙 20.9 31.6 45.8 63.9 85.5 110.0
丙 0.182 0.165 0.160 0.141 x 0.121
(1)10℃时,甲物质的溶解度是 .
(2)三种物质中溶解度受温度影响较大的是 .
(3)物质在水中的溶解性与其溶解度(20℃)的关系示意图如图1,则丙物质在水中的溶解性是 .
(4)30℃时,乙物质饱和溶液的溶质质量分数是 .(列式即可,不要求计算)
(5)50℃时,三种物质的溶解度由大到小的顺序是 .
(6)向不同温度的100g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图2所示.相关分析正确的是 .
a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.温度不变的情况下使Ⅳ中的固体全部溶解,溶质质量分数不变
(7)气体的溶解度也有一定的变化规律,不同温度下,氧气的溶解度随压强变化如图3所示,图中t2对应温度为30℃,则t1对应的温度 .
A.小于30℃
B.等于30℃
C.大于30℃
D.无法确定
(8)t℃时,某物质(固体)的饱和溶液中,溶质与溶液的质量比是n:m,则在t℃时,该物质的溶解度为 g.
参考答案
一、选择题:
1、A 2、C 3、C 4、C 5、D 6、C 7、B 8、B 9、C 10、C
11、B 12、C 13、D 14、B
二、填空题:
1、答案:(1)35.8;
(2)KNO3;
(3)BCD。
2、答案:(1)C;
(2)60g;
(3)B;
(4)D。
3、解:(1)探究溶质的种类对溶解度的影响,即除了溶质的种类不同外,温度和溶剂的质量都必须相同,这样才能得出正确的结论;由30℃时,5mL蒸馏水中溶解的KNO3、Ca(OH)2质量不同,则说明在温度相同、溶剂的量相同的情况下,不同的固体物质的溶解度不同.
(2)而当探究温度对溶解度的影响时,除了温度不同之外,溶质和溶剂的质量必须相同.由试管①中有多量KNO3未溶,试管②中KNO3全部溶解,可知在不同温度下,同种固体物质在水中的溶解度不相等.
故答案为:(1)温度、溶剂的质量.
实验结论:温度,不同.
(2)温度;溶质的质量和溶剂的质量.
实验结论:温度.
4、答案为:(1)35.8;
(2)乙;
(3)微溶于水;
(4);
(5)乙、甲、丙;
(6)bd;
(7)A;
(8).
一、选择题:
1、影响固体物质溶解度的操作是( )
A.加热 B.振荡 C.搅拌 D.加压
2、60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是( )
A.溶质质量:溶剂质量=10:11
B.溶剂质量:溶液质量=20:21
C.溶质质量:溶剂质量=11:10
D.溶液质量:溶质质量=21:10
3、将20℃的KNO3饱和溶液升温至50℃(不考虑水分蒸发),一定发生改变的是( )
A.溶质的质量分数 B.溶质的质量
C.KNO3?的溶解度 D.溶液的质量
4、下列有关溶液的说法中,不正确的是( )
A.物质溶解过程中通常会伴随着热量的变化
B.在氯化钾溶液稀释的过程中,氯化钾的质量不变
C.在压强不变时,升高温度可以增大CO2在水中的溶解度
D.熟石灰的饱和溶液通过降低温度或者增加溶剂转化为不饱和溶液
5、有M、N两种物质,20℃时20克水最多溶解5克M,60℃时100克水里最多溶解10克N。则M、N的溶解度大小是( )
A.M>N B.M<N C.M=N D.无法比较
6、不同温度时,NH4Cl固体的溶解度如下表所示。20℃时,将50g NH4Cl固体加入盛有100g水的烧杯中,充分溶解得到溶液。下列说法正确的是( )
温度/℃ 20 40 60 80
溶解度/g 37.2 45.8 55.2 65.6
A.NH4Cl的溶解度随温度升高而减小
B.烧杯中溶液的质量为150g
C.所得溶液为饱和溶液
D.将烧杯中溶液升温至60℃后,溶质质量分数为50%
7、打开一瓶盐汽水,有大量二氧化碳气体逸出,相关分析正确的是( )
A.盐汽水中只有二氧化碳一种溶质
B.打开汽水瓶,汽水是二氧化碳的饱和溶液
C.剩余汽水中不含二氧化碳
D.升高温度汽水变为二氧化碳的不饱和溶液
8、某汽水中含有二氧化碳、白砂糖、柠檬酸和水等多种物质,打开汽水瓶盖,有大量气泡逸出,说法正确的是( )
A.白砂糖的溶解度减小
B.二氧化碳的溶解度减小
C.气泡逸出后的溶液为二氧化碳的不饱和溶液
D.汽水溶液质量不变
9、甲、乙两种固体物质的溶解度曲线如图所示。下列说法不正确的是( )
A.40℃时,甲的溶解度大于乙的溶解度
B.甲、乙物质的溶解度都随温度的升高而增大
C.将20℃时甲的饱和溶液降温至0℃,无晶体析出
D.将40℃时乙的饱和溶液降温至20℃,仍然是饱和溶液
10、在其它条件不改变的情况下,对硝酸钾溶液进行如下处理,溶液的溶质质量分数大小比较正确的是( )
A.①>②>③ B.①=②>③ C.①=②<③ D.①=②=③
11、硫酸锌饱和溶液溶质质量分数随温度变化曲线如图所示。下列说法正确的是( )
A.M点对应的硫酸锌溶液是不饱和溶液
B.N点对应的硫酸锌溶液升温或降温都可能析出晶体
C.硫酸锌饱和溶液的溶质质量分数随温度升高而增大
D.40℃时,41g硫酸锌溶解在100g水中形成饱和溶液
12、20℃时,氯化钠(NaCl)溶解于水的实验数据如表所示,则下列叙述正确的是( )
实验序号 水的质量(g) 加入NaCl的质量(g) 溶液的质量(g)
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.①所得溶液的溶质质量分数为20%
B.②所得溶液是饱和溶液
C.20℃时,氯化钠的溶解度是36g/100g水
D.③④溶液的溶质质量分数不相等
13、0℃时,将100g某物质的溶液蒸干,得到30g固体,则下列说法正确的是( )
A.0℃时,该物质溶解度为30g
B.溶液的溶质的质量分数为30%
C.0℃时,该物质为饱和溶液
D.无法计算该溶液的溶质的质量分数
14、20℃时,向下列3只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。
下列说法不正确的是( )
A.①中溶液的质量为120g
B.②中溶液的溶质质量分数为30%
C.将②中的溶液倒出一半,溶液中溶质质量分数不变
D.将③中溶液升温至40℃时,溶液中溶质质量分数增大
二、填空题:
1、根据NaCl和KNO3的溶解度数据表,回答下列问题:
温度/℃ 0 10 20 30 40 50 60 70
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138
(1)10℃时,NaCl的溶解度是? g;
(2)30℃时,溶解度较大的是? (选填“NaCl”或“KNO3”);
(3)下列分析正确的是? 。
A.10℃时,能够配制出溶质的质量分数为20.9%的KNO3溶液
B.20℃时,20g NaCl固体加入100g水,充分溶解后得到NaCl的不饱和溶液
C.20℃到30℃之间,能配制出溶质质量分数相等的NaCl饱和溶液和KNO3饱和溶液
D.将KNO3溶液经过某种操作后,析出KNO3晶体,过滤后所得溶液溶质的质量分数与原溶液相比,可能变大、变小或不变
2、向分别装有30g甲、乙物质的a、b烧杯中,各加入50g水,所得溶液的溶质质量分数随温度变化的趋势如图所示,回答下列问题:
(1)将乙物质换成? (填序号),该图像的变化趋势不变。
A.KNO3
B.NaCl
C.Ca(OH)2
(2)t2℃时,甲物质的溶解度为? 。
(3)下列描述正确的是? (填序号)。
A.在0℃时,乙物质恰好为饱和溶液
B.t1℃时,甲、乙两物质的溶解度相等
C.t2℃时,若将mg乙物质加入100g水中,充分溶解,得到(100+m)g的溶液
D.将a、b烧杯,从t3℃降温至t2℃,b烧杯所剩固体更少
(4)另取一杯甲的不饱和溶液,若将其变为饱和溶液,下列说法正确的是? (填序号)。
A.溶质质量一定增大
B.溶剂质量一定减少
C.溶质质量分数一定变大
D.溶液质量可能不变
3、下面是某小组进行的“哪些因素影响固体物质在水中的溶解度”的实验探究,请你完成探究报告.
探究实验:哪些因素影响固体物质在水中的溶解度?
(1)溶质种类的影响
在实验中要改变的因素是:溶质的种类;要保持不变的因素是: .
实验步骤:30℃时,用量筒各取5mL蒸馏水分别加入①、②两支试管中,再分别加入KNO3、Ca(OH)2各2g振荡,观察各物质溶解情况.
实验现象:试管①中KNO3全部溶解.试管②中有较多Ca(OH)2未溶.
实验结论:在 保持不变的情况下,不同种类的物质在水中的溶解度 .
(2)温度的影响(以KNO3为例)
在实验中要改变的因素是 ;要保持不变的因素是 .
实验步骤:用量筒各取5mL蒸馏水,分别加入①、②二支试管中,再加入5gKNO3晶体,将试管①保持在常温下,将试管②加热并保持在60%,振荡,观察各试管中KNO3的溶解情况.
实验现象:试管①中有多量KNO3未溶,试管②中KNO3全部溶解.
实验结论:在不同 下,同种固体物质在水中的溶解度不相等.
4、如表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答.
温度(℃) 10 20 30 40 50 60
甲 35.8 36.0 36.3 36.6 37.0 37.3
乙 20.9 31.6 45.8 63.9 85.5 110.0
丙 0.182 0.165 0.160 0.141 x 0.121
(1)10℃时,甲物质的溶解度是 .
(2)三种物质中溶解度受温度影响较大的是 .
(3)物质在水中的溶解性与其溶解度(20℃)的关系示意图如图1,则丙物质在水中的溶解性是 .
(4)30℃时,乙物质饱和溶液的溶质质量分数是 .(列式即可,不要求计算)
(5)50℃时,三种物质的溶解度由大到小的顺序是 .
(6)向不同温度的100g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图2所示.相关分析正确的是 .
a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.温度不变的情况下使Ⅳ中的固体全部溶解,溶质质量分数不变
(7)气体的溶解度也有一定的变化规律,不同温度下,氧气的溶解度随压强变化如图3所示,图中t2对应温度为30℃,则t1对应的温度 .
A.小于30℃
B.等于30℃
C.大于30℃
D.无法确定
(8)t℃时,某物质(固体)的饱和溶液中,溶质与溶液的质量比是n:m,则在t℃时,该物质的溶解度为 g.
参考答案
一、选择题:
1、A 2、C 3、C 4、C 5、D 6、C 7、B 8、B 9、C 10、C
11、B 12、C 13、D 14、B
二、填空题:
1、答案:(1)35.8;
(2)KNO3;
(3)BCD。
2、答案:(1)C;
(2)60g;
(3)B;
(4)D。
3、解:(1)探究溶质的种类对溶解度的影响,即除了溶质的种类不同外,温度和溶剂的质量都必须相同,这样才能得出正确的结论;由30℃时,5mL蒸馏水中溶解的KNO3、Ca(OH)2质量不同,则说明在温度相同、溶剂的量相同的情况下,不同的固体物质的溶解度不同.
(2)而当探究温度对溶解度的影响时,除了温度不同之外,溶质和溶剂的质量必须相同.由试管①中有多量KNO3未溶,试管②中KNO3全部溶解,可知在不同温度下,同种固体物质在水中的溶解度不相等.
故答案为:(1)温度、溶剂的质量.
实验结论:温度,不同.
(2)温度;溶质的质量和溶剂的质量.
实验结论:温度.
4、答案为:(1)35.8;
(2)乙;
(3)微溶于水;
(4);
(5)乙、甲、丙;
(6)bd;
(7)A;
(8).
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
