7.1 质量守恒定律课件 —2021-2022学年九年级化学京改版(2013)上册(18张PPT)
文档属性
| 名称 | 7.1 质量守恒定律课件 —2021-2022学年九年级化学京改版(2013)上册(18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1002.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-06 08:57:22 | ||
图片预览






文档简介
质量守恒定律
广东省东莞市虎门第五中学
学习目标
1.从宏观和微观角度,理解质量守恒定律的含义和本质
2.体验探究问题的过程,通过量化实验及其分析,获得初步的逻辑思维能力。
探究问题1:
化学变化(化学反应)可以从什么角度进行描述?
宏观现象角度:溶液颜色,沉淀,气体等变化
微观粒子角度:水通电后,水分子拆分成氢和氧原子后,重新组合成氢气分子和氧气分子。
其他角度:体积变化?温度变化?质量变化?······
Fe CuSO4
Cu FeSO4
银白色
蓝色
红色
浅绿色
方案:铁钉与硫酸铜溶液反应【湿法炼铜】
铁 + 硫酸铜 → 铜 + 硫酸亚铁
现象:铁钉表面有红色物质生成,
溶液由蓝色变 为浅绿色,天平仍保持平衡。
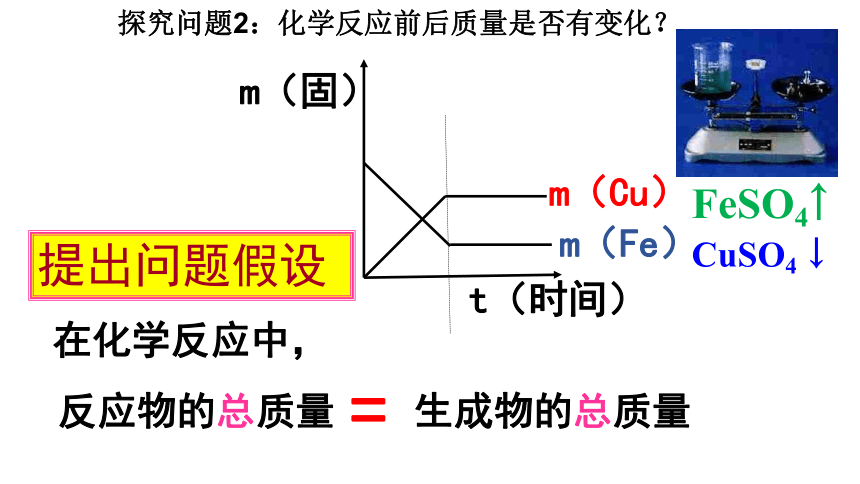
探究问题2:化学反应前后质量是否有变化?
注意:水,过量的反应物不反应
提出问题假设
在化学反应中,
反应物的总质量 生成物的总质量
=
m(固)
t(时间)
m(Cu)
探究问题2:化学反应前后质量是否有变化?
m(Fe)
CuSO4 ↓
FeSO4↑
小李同学做的醋酸与鸡蛋壳反应的实验(有气泡产生,总质量变少。?)
请你评价他的实验:是否支持我们的假设?是否推翻了我们的假设?如何改进实验?--密闭?【塑料瓶,小试管】
方案初步设计:醋酸与鸡蛋壳的反应
探究问题3:如何设计实验,验证我们的假设?
改进:
鸡蛋壳→塑料瓶底 密
醋酸→小管(可用吸管打结) 闭
方案初步设计:醋酸与鸡蛋壳
探究问题3:如何设计实验,验证我们的假设?
红磷质量+氧气质量 五氧化二磷质量
磷+氧气 五氧化二磷
点燃
P
O2
P2O5
反应物的总质量 生成物的总质量
红磷
方案一:
红磷燃烧
现象:产生大量白烟,气球先胀大,冷却后变小,天平仍保持平衡
探究问题3:如何设计实验,验证我们的假设?
结论
有物质变化:【是化学反应(化学变化)都有物质变化】
有沉淀产生:氢氧化钠与硫酸铜溶液【NaOH、CuSO4】
有气体产生:盐酸与碳酸钠溶液【HCl、Na2CO3】
有气体参与:红磷燃烧,镁燃烧······
历史上的科学家如波义耳、拉瓦锡等也做了很多尝试证明该假设的实验······
【科学的突破与发展速度,与仪器和设备的更新换代等密切相关】
方案二:?
探究问题3:如何设计实验,验证我们的假设?
例: 水 氢气+氧气
H2O H2 O2
通电
反应物分子
拆分
原子
重组
生成物分子
旧分子 原子 新分子
探究问题4:如何从理论角度,验证我们的假设?
1.原子的种类 2.原子的数目. 3.原子的质量 4.元素的种类
5.物质的总质量
1.分子的种类
2.物质的种类
1.分子的数目
2.元素的化合价
归纳
在化学反应前后
五个不变:
两个一定改变:
两个可能改变:
质量守恒定律
参加化学反应的各物质的质量总和,
等于反应后生成的各物质的质量总和
参加(是指真正参加化学反应的物质,没有参
加反应的物质不能计入)
化学反应(适用于所有的化学变化, 但不包括
物理变化)
质量总和(不是体积守恒,而且不能忽略反应
物或生成物中的气体)
反应物 生成物
反应条件:
碳和氧气
二氧化碳
点燃
C + O2 CO2
点燃
如:
根据质量守恒定律,可以说:
12g的碳与32g的氧气在点燃的条件下发生化学反应生成44g的二氧化碳
学习目标
应注意找出没参加反应的分子,并划掉。
又如:
H2O O2 + H2
通电
根据质量守恒定律:两个水分子在通电条件下分解,得到一个氧分子和两个氢分子。
化学符号
2H2O
O2
2H2
微观粒子
示意图
没参与反应
—氢
—氧
2 1 2
探究问题3:如何设计实验,验证我们的假设?
探究问题2:化学反应前后质量是否有变化?
探究问题1:化学变化可以从什么角度进行描述?
探究问题4:如何从理论角度,验证我们的假设?
参加化学反应的各物质的质量总和,
等于反应后生成的各物质的质量总和
小结:
质量守恒定律
假设:
1.下列说法用质量守恒定律解释正确的是( )
5g铁钉与20g硫酸铜溶液反应,得到25g产物
10g水变成10g冰
2升氢气与1升氧气生成2升水
9g水完全电解成1g氢气和8g氧气
D
质量守恒定律 巩固练习
×,水不参与反应
×,无化学反应
×,不是体积守恒
2.在化学反应A+B=C中,4g的A与足量的B充分反应后生成9gC,则参加反应的B的质量为 。
5g
作业:同步练习
质量守恒定律 巩固练习
祝你进步!
------更多化学学习资源请
关注“天问地答”公众号。
致谢
感谢2018,2019届学生和同事、同行们,尤其感谢吕彩玲、孙兰兰、陈庆祥,黄晓玲,谭敏茹等老师;小祥同学、老柔同学等一波在菠萝蜜树旁茁壮成长的初三的宝宝们。
广东省东莞市虎门第五中学
学习目标
1.从宏观和微观角度,理解质量守恒定律的含义和本质
2.体验探究问题的过程,通过量化实验及其分析,获得初步的逻辑思维能力。
探究问题1:
化学变化(化学反应)可以从什么角度进行描述?
宏观现象角度:溶液颜色,沉淀,气体等变化
微观粒子角度:水通电后,水分子拆分成氢和氧原子后,重新组合成氢气分子和氧气分子。
其他角度:体积变化?温度变化?质量变化?······
Fe CuSO4
Cu FeSO4
银白色
蓝色
红色
浅绿色
方案:铁钉与硫酸铜溶液反应【湿法炼铜】
铁 + 硫酸铜 → 铜 + 硫酸亚铁
现象:铁钉表面有红色物质生成,
溶液由蓝色变 为浅绿色,天平仍保持平衡。
探究问题2:化学反应前后质量是否有变化?
注意:水,过量的反应物不反应
提出问题假设
在化学反应中,
反应物的总质量 生成物的总质量
=
m(固)
t(时间)
m(Cu)
探究问题2:化学反应前后质量是否有变化?
m(Fe)
CuSO4 ↓
FeSO4↑
小李同学做的醋酸与鸡蛋壳反应的实验(有气泡产生,总质量变少。?)
请你评价他的实验:是否支持我们的假设?是否推翻了我们的假设?如何改进实验?--密闭?【塑料瓶,小试管】
方案初步设计:醋酸与鸡蛋壳的反应
探究问题3:如何设计实验,验证我们的假设?
改进:
鸡蛋壳→塑料瓶底 密
醋酸→小管(可用吸管打结) 闭
方案初步设计:醋酸与鸡蛋壳
探究问题3:如何设计实验,验证我们的假设?
红磷质量+氧气质量 五氧化二磷质量
磷+氧气 五氧化二磷
点燃
P
O2
P2O5
反应物的总质量 生成物的总质量
红磷
方案一:
红磷燃烧
现象:产生大量白烟,气球先胀大,冷却后变小,天平仍保持平衡
探究问题3:如何设计实验,验证我们的假设?
结论
有物质变化:【是化学反应(化学变化)都有物质变化】
有沉淀产生:氢氧化钠与硫酸铜溶液【NaOH、CuSO4】
有气体产生:盐酸与碳酸钠溶液【HCl、Na2CO3】
有气体参与:红磷燃烧,镁燃烧······
历史上的科学家如波义耳、拉瓦锡等也做了很多尝试证明该假设的实验······
【科学的突破与发展速度,与仪器和设备的更新换代等密切相关】
方案二:?
探究问题3:如何设计实验,验证我们的假设?
例: 水 氢气+氧气
H2O H2 O2
通电
反应物分子
拆分
原子
重组
生成物分子
旧分子 原子 新分子
探究问题4:如何从理论角度,验证我们的假设?
1.原子的种类 2.原子的数目. 3.原子的质量 4.元素的种类
5.物质的总质量
1.分子的种类
2.物质的种类
1.分子的数目
2.元素的化合价
归纳
在化学反应前后
五个不变:
两个一定改变:
两个可能改变:
质量守恒定律
参加化学反应的各物质的质量总和,
等于反应后生成的各物质的质量总和
参加(是指真正参加化学反应的物质,没有参
加反应的物质不能计入)
化学反应(适用于所有的化学变化, 但不包括
物理变化)
质量总和(不是体积守恒,而且不能忽略反应
物或生成物中的气体)
反应物 生成物
反应条件:
碳和氧气
二氧化碳
点燃
C + O2 CO2
点燃
如:
根据质量守恒定律,可以说:
12g的碳与32g的氧气在点燃的条件下发生化学反应生成44g的二氧化碳
学习目标
应注意找出没参加反应的分子,并划掉。
又如:
H2O O2 + H2
通电
根据质量守恒定律:两个水分子在通电条件下分解,得到一个氧分子和两个氢分子。
化学符号
2H2O
O2
2H2
微观粒子
示意图
没参与反应
—氢
—氧
2 1 2
探究问题3:如何设计实验,验证我们的假设?
探究问题2:化学反应前后质量是否有变化?
探究问题1:化学变化可以从什么角度进行描述?
探究问题4:如何从理论角度,验证我们的假设?
参加化学反应的各物质的质量总和,
等于反应后生成的各物质的质量总和
小结:
质量守恒定律
假设:
1.下列说法用质量守恒定律解释正确的是( )
5g铁钉与20g硫酸铜溶液反应,得到25g产物
10g水变成10g冰
2升氢气与1升氧气生成2升水
9g水完全电解成1g氢气和8g氧气
D
质量守恒定律 巩固练习
×,水不参与反应
×,无化学反应
×,不是体积守恒
2.在化学反应A+B=C中,4g的A与足量的B充分反应后生成9gC,则参加反应的B的质量为 。
5g
作业:同步练习
质量守恒定律 巩固练习
祝你进步!
------更多化学学习资源请
关注“天问地答”公众号。
致谢
感谢2018,2019届学生和同事、同行们,尤其感谢吕彩玲、孙兰兰、陈庆祥,黄晓玲,谭敏茹等老师;小祥同学、老柔同学等一波在菠萝蜜树旁茁壮成长的初三的宝宝们。
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
