《化学能与电能》45分钟课堂测试题
文档属性
| 名称 | 《化学能与电能》45分钟课堂测试题 |  | |
| 格式 | zip | ||
| 文件大小 | 50.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-28 21:00:20 | ||
图片预览

文档简介
《化学能与电能》45分钟课堂测试题
时间:45分钟 总分:100分
一、选择题(每题7分,共56分)
1.能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。据此判断,下列叙述正确的是 ( )
A.天然气是二级能源 B.石油是二级能源
C.电能是一级能源 D.水力是一级能源
2.已知空气-锌电池的电极反应为: 锌片:Zn+20H--2e-=ZnO+H20石墨:02+2H20+4e-=40H- 根 据此判断,锌片是( )。
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
3.一个原电池的总反应离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池组成正确( )。
A
B
C
D
正极
Zn
Ag
Cu
Cu
负极
Cu
Cu
Zn
Zn
电解质溶液
CuCl2
H2S04
CuSO4
FeCl2
4.有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是 ( )
A.DCAB B.DABC C.DBAC D.BADC
5.对于锌一铜一稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两
极变化是( )。
①锌片溶解了32.5 g②锌片增重32.5 g③铜片上析出l g H2 ④铜片上析出1 mol H2
A.①和③ B.①和④ C.②和③ D.②和④
6.100mL 2mol/L的盐酸跟过量的锌反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )。
A. 加入适量的6mol/L的盐酸 B. 加入数滴氯化铜溶液
C. 加入适量蒸馏水 D. 加入适量的氯化钠溶液
7.将纯锌片和纯铜片按图所示的方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )。
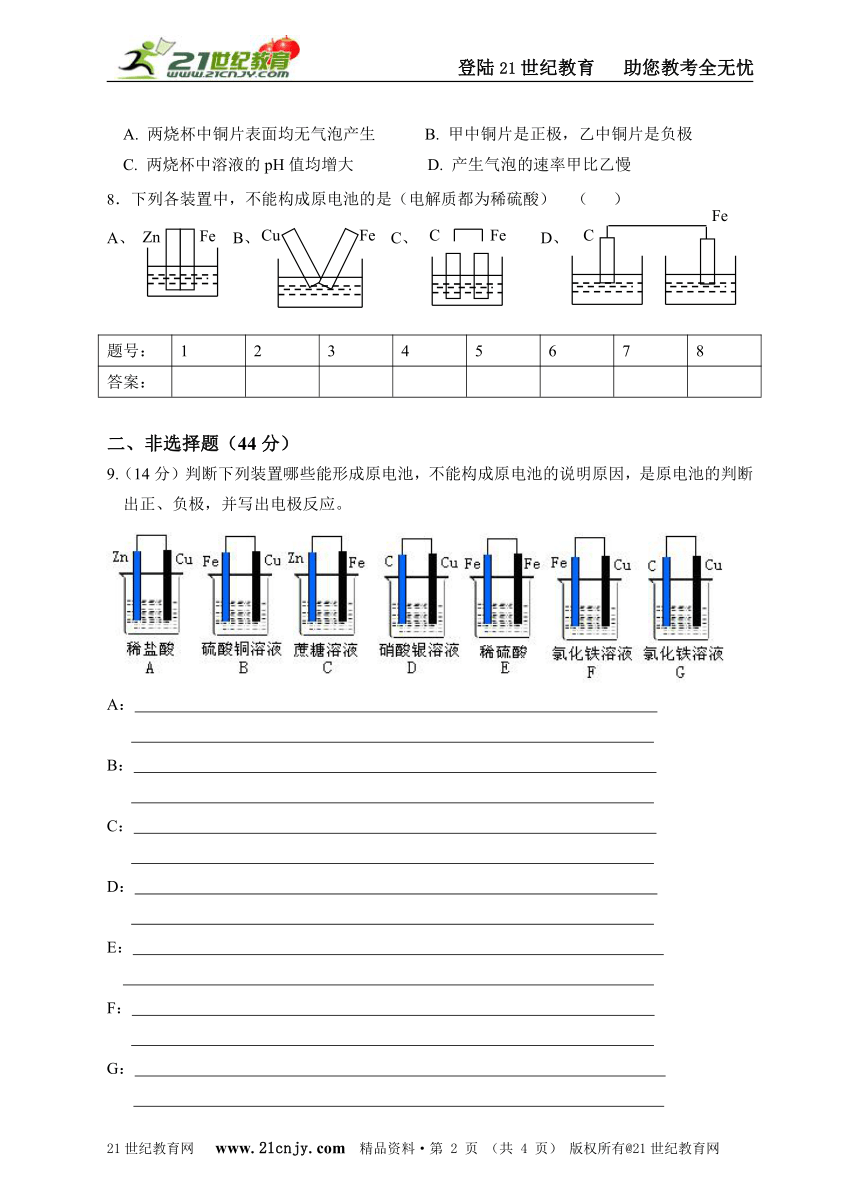
A. 两烧杯中铜片表面均无气泡产生 B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH值均增大 D. 产生气泡的速率甲比乙慢
8.下列各装置中,不能构成原电池的是(电解质都为稀硫酸) ( )
A、 B、 C、 D、
题号:
1
2
3
4
5
6
7
8
答案:
二、非选择题(44分)
9.(14分)判断下列装置哪些能形成原电池,不能构成原电池的说明原因,是原电池的判断出正、负极,并写出电极反应。
A:
B:
C:
D:
E:
F:
G:
10.(12分)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Fe=3FeCl2
(1)根据两反应本质,分别判断能否用于设计原电池____________________________。
(2)如果不能,说明其原因__________________________________________________。
(3)如果可以,请画出实验装置图,注明电解质溶液名称
和正负极材料,标出电子流动方向和电流方向,写出电极反
应式。
________是正极,正极反应式:___________________;
________是负极,负极反应式:__________________。
11.(8分)从铜、铁及碳棒中选取合适的电极材料设计一个原电池,实现如下反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
则负极为 ,电极反应式为 ,
正极应选 ,电极反应式为 ________________________。
12.(10分)如图所示装置:
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 。
两极反应式为:正极 ;
负极 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
参考答案:
选择题
题号:
1
2
3
4
5
6
7
8
答案:
D
A
C
B
A
B
C
D
非选择题
9、略
10、(1)能设计成原电池判的反应是B).CuCl2+Fe=FeCl2+Cu
(2)反应A不是氧化还原反应,没有电子转移
(3)Fe是负极反应式:Fe -2 e = Fe2+
Cu是正极正极反应式:Cu2+ + 2e- = Cu
图示(略)
11、Cu;3Cu-6e-=3Cu2+;碳棒;8H++2NO3-+6e-=2NO↑+4H2O
12、(1)电流表的指针发生偏转,铝片表面有气泡产生。
正极:2H++ 2e-=H2↑
负极:Mg-2e-=Mg2+
(2)Al 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
时间:45分钟 总分:100分
一、选择题(每题7分,共56分)
1.能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。据此判断,下列叙述正确的是 ( )
A.天然气是二级能源 B.石油是二级能源
C.电能是一级能源 D.水力是一级能源
2.已知空气-锌电池的电极反应为: 锌片:Zn+20H--2e-=ZnO+H20石墨:02+2H20+4e-=40H- 根 据此判断,锌片是( )。
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
3.一个原电池的总反应离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池组成正确( )。
A
B
C
D
正极
Zn
Ag
Cu
Cu
负极
Cu
Cu
Zn
Zn
电解质溶液
CuCl2
H2S04
CuSO4
FeCl2
4.有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是 ( )
A.DCAB B.DABC C.DBAC D.BADC
5.对于锌一铜一稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两
极变化是( )。
①锌片溶解了32.5 g②锌片增重32.5 g③铜片上析出l g H2 ④铜片上析出1 mol H2
A.①和③ B.①和④ C.②和③ D.②和④
6.100mL 2mol/L的盐酸跟过量的锌反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )。
A. 加入适量的6mol/L的盐酸 B. 加入数滴氯化铜溶液
C. 加入适量蒸馏水 D. 加入适量的氯化钠溶液
7.将纯锌片和纯铜片按图所示的方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )。
A. 两烧杯中铜片表面均无气泡产生 B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH值均增大 D. 产生气泡的速率甲比乙慢
8.下列各装置中,不能构成原电池的是(电解质都为稀硫酸) ( )
A、 B、 C、 D、
题号:
1
2
3
4
5
6
7
8
答案:
二、非选择题(44分)
9.(14分)判断下列装置哪些能形成原电池,不能构成原电池的说明原因,是原电池的判断出正、负极,并写出电极反应。
A:
B:
C:
D:
E:
F:
G:
10.(12分)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Fe=3FeCl2
(1)根据两反应本质,分别判断能否用于设计原电池____________________________。
(2)如果不能,说明其原因__________________________________________________。
(3)如果可以,请画出实验装置图,注明电解质溶液名称
和正负极材料,标出电子流动方向和电流方向,写出电极反
应式。
________是正极,正极反应式:___________________;
________是负极,负极反应式:__________________。
11.(8分)从铜、铁及碳棒中选取合适的电极材料设计一个原电池,实现如下反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
则负极为 ,电极反应式为 ,
正极应选 ,电极反应式为 ________________________。
12.(10分)如图所示装置:
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 。
两极反应式为:正极 ;
负极 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
参考答案:
选择题
题号:
1
2
3
4
5
6
7
8
答案:
D
A
C
B
A
B
C
D
非选择题
9、略
10、(1)能设计成原电池判的反应是B).CuCl2+Fe=FeCl2+Cu
(2)反应A不是氧化还原反应,没有电子转移
(3)Fe是负极反应式:Fe -2 e = Fe2+
Cu是正极正极反应式:Cu2+ + 2e- = Cu
图示(略)
11、Cu;3Cu-6e-=3Cu2+;碳棒;8H++2NO3-+6e-=2NO↑+4H2O
12、(1)电流表的指针发生偏转,铝片表面有气泡产生。
正极:2H++ 2e-=H2↑
负极:Mg-2e-=Mg2+
(2)Al 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
