3.3 常见的盐 同步练习(含答案)
文档属性
| 名称 | 3.3 常见的盐 同步练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 87.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-08-07 17:33:29 | ||
图片预览

文档简介
3.3常见的盐
一、选择题
1.下列关于氯化钠性质和用途的描述中,不正确的是( )
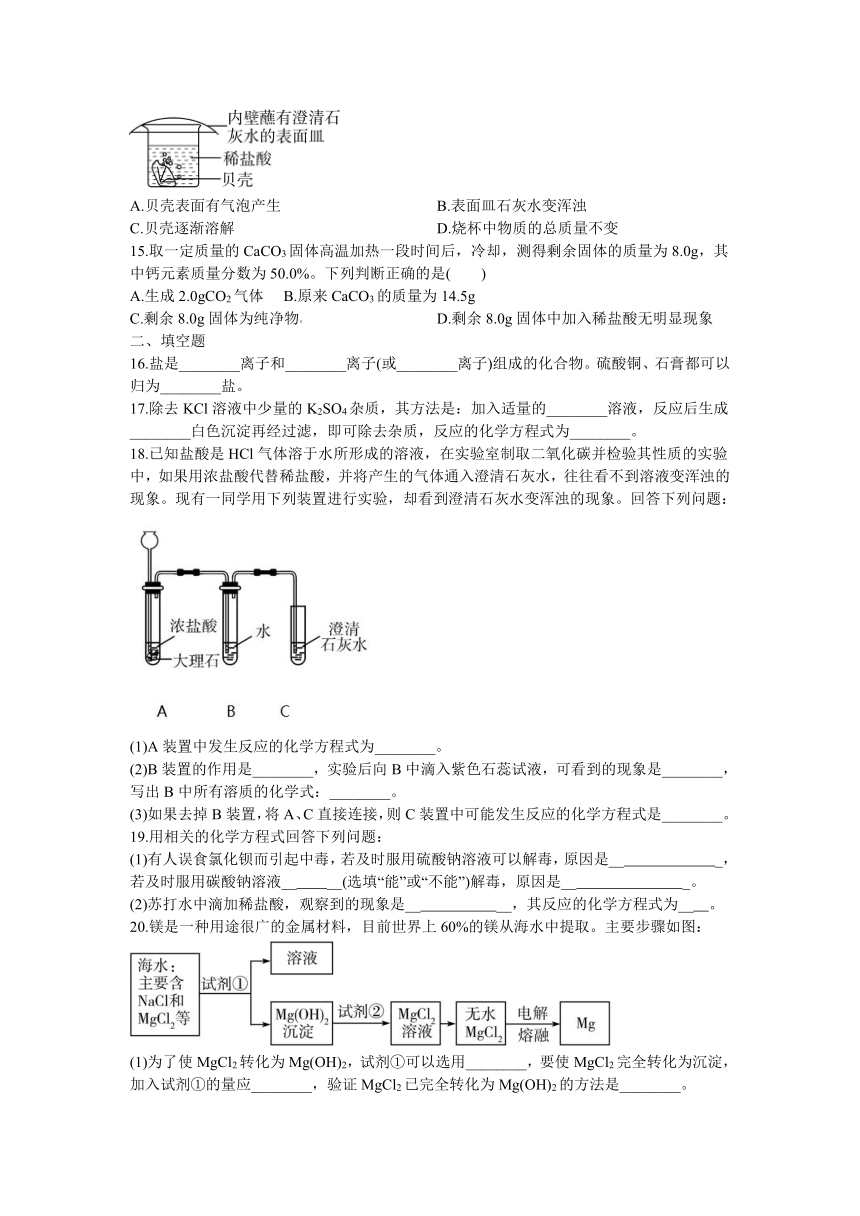
A.易溶于水 B.能吸收空气中的水分而潮解C.其溶液能跟硝酸银溶液反应 D.0.9%的氯化钠溶液用作医疗上的生理盐水
2.下列各组溶液恰好完全反应后过滤,滤液里只留有Na+和Cl-的一组是( )
A.BaCl2和Na2CO3溶液 B.AgNO3和NaCl溶液
C.CuCl2和Na2SO4溶液 D.Na2CO3和稀硫酸
3.下列物质中属于盐的是( )
A.盐酸 B.纯碱 C.苛性钠 D.熟石灰
4.蒸馒头时,在发酵面团中加入某种物质,既能除去面团发酵过程中产生的酸,又能使馒头松软,加入的这种物质是( )
A.NaOH B.Na2CO3C.CaO D.NaCl
5.分别将下列各组物质同时加入水中,能得到无色透明溶液的是( )
A.KCl、NaOH、CuSO4 B.Na2CO3、Ca(OH)2、NaNO3C.NaOH、KNO3、NaClD.Ba(NO3)2、K2SO4、NaCl
6.下列几组物质按酸、碱、盐顺序排列的是( )
A.KNO3、NaOH、HClB.Ca(OH)2、HCl、NaClC.H2SO4、Na2CO3、Ba(OH)2 D.HNO3、KOH、CuSO4
7.下列物质中,既能与石灰水反应,又能与稀盐酸反应的是( )
A.FeCl3B.CuO C.Na2CO3 D.KNO3
8.某盐溶液加入硝酸银溶液产生白色沉淀,加入稀硫酸也产生白色沉淀,该盐可能是( )
A.氯化钠 B.硝酸钡 C.氯化钡 D.硝酸铵
9.近来市场上出现了能补充人体盐分的饮品——盐汽水,你认为盐汽水的成分和普通汽水最大的不同是增加了( )
A.水 B.氯化钠 C.二氧化碳 D.碳酸钙
10.往含氯化钙和盐酸的混合溶液中逐滴加入碳酸钠至过量,观察到的现象正确的是( )
A.只有大量气泡冒出 B.只有白色沉淀产生C.开始冒出气泡,后出现白色沉淀 D.开始出现白色沉淀,后冒出气泡
11.下列物质中,既不溶于水也不溶于稀硝酸的一组是( )
A.CuO、Fe2O3 B.AgCl、BaSO4 C.Cu(OH)2、Fe(OH)3 D.CaCO3、BaCO3
12.下列物质的转化,不能一步实现的是( )
A.Cu(OH)2→CuCl2B.Zn→H2
C.H2O→H2D.AgCl→NaCl
13.若用实验证明FeCl3溶液显黄色不是由Cl-离子造成的,下列实验无意义的是( )
A.观察KCl溶液的颜色B.向FeCl3溶液中滴加适量氢氧化钠溶液振荡后静置,溶液黄色消失C.向FeCl3溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液黄色未消失D.加水稀释后FeCl3溶液黄色变浅
14.贝壳的主要成分是碳酸钙,小强设计了如图的实验进行有关探究活动,以下关于此实验现象的描述中错误的是( )
A.贝壳表面有气泡产生 B.表面皿石灰水变浑浊C.贝壳逐渐溶解 D.烧杯中物质的总质量不变
15.取一定质量的CaCO3固体高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,其中钙元素质量分数为50.0%。下列判断正确的是( )
A.生成2.0gCO2气体 B.原来CaCO3的质量为14.5gC.剩余8.0g固体为纯净物 D.剩余8.0g固体中加入稀盐酸无明显现象
二、填空题
16.盐是________离子和________离子(或________离子)组成的化合物。硫酸铜、石膏都可以归为________盐。
17.除去KCl溶液中少量的K2SO4杂质,其方法是:加入适量的________溶液,反应后生成________白色沉淀再经过滤,即可除去杂质,反应的化学方程式为________。
18.已知盐酸是HCl气体溶于水所形成的溶液,在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清石灰水,往往看不到溶液变浑浊的现象。现有一同学用下列装置进行实验,却看到澄清石灰水变浑浊的现象。回答下列问题:
(1)A装置中发生反应的化学方程式为________。
(2)B装置的作用是________,实验后向B中滴入紫色石蕊试液,可看到的现象是________,写出B中所有溶质的化学式:________。
(3)如果去掉B装置,将A、C直接连接,则C装置中可能发生反应的化学方程式是________。
19.用相关的化学方程式回答下列问题:
(1)有人误食氯化钡而引起中毒,若及时服用硫酸钠溶液可以解毒,原因是__ _,若及时服用碳酸钠溶液__ __(选填“能”或“不能”)解毒,原因是__ _。
(2)苏打水中滴加稀盐酸,观察到的现象是__ __,其反应的化学方程式为__ 。
20.镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。主要步骤如图:
(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选用________,要使MgCl2完全转化为沉淀,加入试剂①的量应________,验证MgCl2已完全转化为Mg(OH)2的方法是________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的操作是________。
(3)试剂②可以选用________。
答案和解析
一、选择题
1.B
2.A3.B4.B5.C6.D7.C8.C9.B10.C11.B
【解析】A、氧化铜和氧化铁不溶于水,但都能与硝酸反应形成溶液,不符合题意;B、氯化银和硫酸钡既不溶于水也不溶于硝酸,符合题意;C、氢氧化铜和氢氧化铁不溶于水,但能溶于酸,不符合题意;D、碳酸钙和碳酸钡不溶于水,但能溶于酸,不符合题意;
故选B。12.D13.D
【解析】A、KCl溶液中含有氯离子,但呈无色,可证明显黄色不是由Cl-离子造成的,不符合题意;B、向FeCl3溶液中滴加适量氢氧化钠溶液振荡后静置,因铁离子转化为沉淀,溶液黄色消失,可证明显黄色是由铁离子造成的,不符合题意;C、向FeCl3溶液中滴加适量无色硝酸银溶液,将氯离子转化为沉淀,溶液黄色未消失,可证明显黄色是由铁离子造成的,不符合题意;D、加水稀释后FeCl3溶液黄色变浅,溶液中仍是存在铁离子和氯离子,无法证明溶液黄色是由哪种离子造成,符合题意;
故选D。14.D15.A
【解析】钙元素质量为8.0g×50.0%=4g,因反应前后钙元素质量不变,则反应前碳酸钙质量为4g4g÷40100=10g;
A、固体减少质量即为生成气体质量,生成CO2气体质量为10g-8.0g=2.0g,符合题意;B、原来CaCO3的质量为10g,不符合题意;C、10g碳酸钙完全反应生成二氧化碳不2.2克,说明剩余8.0g固体为氧化钙和碳酸钙混合物,不符合题意;D、剩余8.0g固体中含有未分解的碳酸钙,加入稀盐酸会产生气泡,不符合题意;
故选A。二、填空题
16.酸根;金属;铵根;硫酸
17.BaCl2;BaSO4;K2SO4+BaCl2=BaSO4↓+2KCl
18.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)吸收挥发出的氯化氢气体;溶液变红;HCl、H2CO3
(3)Ca(OH)2+2HCl=CaCl2+2H2O
【解析】(1)A中为碳酸钙与盐酸的反应,方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)因浓盐酸有挥发性,生成二氧化碳中含有大量氯化氢气体,氯化氢易溶于水,所以B装置作用为吸收挥发出的氯化氢气体;B中溶液呈酸性,实验后向B中滴入紫色石蕊试液,可看到溶液变红;二氧化碳也能与水反应生成碳酸,所以B中溶质为HCl、H2CO3;
(3)若二氧化碳中含有大量氯化氢,则通入石灰水中,氯化氢与氢氧化钙反应,会干扰二氧化碳反应,方程式为Ca(OH)2+2HCl=CaCl2+2H2O;
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)吸收挥发出的氯化氢气体;溶液变红;HCl、H2CO3;(3)Ca(OH)2+2HCl=CaCl2+2H2O。19.BaCl2+Na2SO4===BaSO4↓+2NaCl;不能;BaCl2+Na2CO3===BaCO3↓+2NaCl、BaCO3+2HCl===BaCl2+H2O+CO2↑;有气泡产生;NaHCO3+HCl===NaCl+H2O+CO2↑;20.(1)氢氧化钠(或氢氧化钙等);过量;取上层清液于试管中,继续滴加氢氧化钠,若无沉淀生成,则证明已完全转化
(2)过滤
(3)盐酸
【解析】(1)氯化镁与可溶性碱反应可生成氢氧化镁,如氢氧化钠、氢氧化钙等;要使MgCl2完全转化为沉淀,加入试剂要过量;验证MgCl2已完全转化为Mg(OH)2即证明不含氯化镁,可取上层清液于试管中,继续滴加氢氧化钠,若无沉淀生成,则证明已完全转化;
(2)加入碱的溶液后,要分离出沉淀氢氧化镁要用过滤的方法;
(3)氢氧化镁要转化为氯化镁,需加入盐酸;
故答案为:(1)氢氧化钠(或氢氧化钙等);过量;取上层清液于试管中,继续滴加氢氧化钠,若无沉淀生成,则证明已完全转化;(2)过滤;(3)盐酸。
一、选择题
1.下列关于氯化钠性质和用途的描述中,不正确的是( )
A.易溶于水 B.能吸收空气中的水分而潮解C.其溶液能跟硝酸银溶液反应 D.0.9%的氯化钠溶液用作医疗上的生理盐水
2.下列各组溶液恰好完全反应后过滤,滤液里只留有Na+和Cl-的一组是( )
A.BaCl2和Na2CO3溶液 B.AgNO3和NaCl溶液
C.CuCl2和Na2SO4溶液 D.Na2CO3和稀硫酸
3.下列物质中属于盐的是( )
A.盐酸 B.纯碱 C.苛性钠 D.熟石灰
4.蒸馒头时,在发酵面团中加入某种物质,既能除去面团发酵过程中产生的酸,又能使馒头松软,加入的这种物质是( )
A.NaOH B.Na2CO3C.CaO D.NaCl
5.分别将下列各组物质同时加入水中,能得到无色透明溶液的是( )
A.KCl、NaOH、CuSO4 B.Na2CO3、Ca(OH)2、NaNO3C.NaOH、KNO3、NaClD.Ba(NO3)2、K2SO4、NaCl
6.下列几组物质按酸、碱、盐顺序排列的是( )
A.KNO3、NaOH、HClB.Ca(OH)2、HCl、NaClC.H2SO4、Na2CO3、Ba(OH)2 D.HNO3、KOH、CuSO4
7.下列物质中,既能与石灰水反应,又能与稀盐酸反应的是( )
A.FeCl3B.CuO C.Na2CO3 D.KNO3
8.某盐溶液加入硝酸银溶液产生白色沉淀,加入稀硫酸也产生白色沉淀,该盐可能是( )
A.氯化钠 B.硝酸钡 C.氯化钡 D.硝酸铵
9.近来市场上出现了能补充人体盐分的饮品——盐汽水,你认为盐汽水的成分和普通汽水最大的不同是增加了( )
A.水 B.氯化钠 C.二氧化碳 D.碳酸钙
10.往含氯化钙和盐酸的混合溶液中逐滴加入碳酸钠至过量,观察到的现象正确的是( )
A.只有大量气泡冒出 B.只有白色沉淀产生C.开始冒出气泡,后出现白色沉淀 D.开始出现白色沉淀,后冒出气泡
11.下列物质中,既不溶于水也不溶于稀硝酸的一组是( )
A.CuO、Fe2O3 B.AgCl、BaSO4 C.Cu(OH)2、Fe(OH)3 D.CaCO3、BaCO3
12.下列物质的转化,不能一步实现的是( )
A.Cu(OH)2→CuCl2B.Zn→H2
C.H2O→H2D.AgCl→NaCl
13.若用实验证明FeCl3溶液显黄色不是由Cl-离子造成的,下列实验无意义的是( )
A.观察KCl溶液的颜色B.向FeCl3溶液中滴加适量氢氧化钠溶液振荡后静置,溶液黄色消失C.向FeCl3溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液黄色未消失D.加水稀释后FeCl3溶液黄色变浅
14.贝壳的主要成分是碳酸钙,小强设计了如图的实验进行有关探究活动,以下关于此实验现象的描述中错误的是( )
A.贝壳表面有气泡产生 B.表面皿石灰水变浑浊C.贝壳逐渐溶解 D.烧杯中物质的总质量不变
15.取一定质量的CaCO3固体高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,其中钙元素质量分数为50.0%。下列判断正确的是( )
A.生成2.0gCO2气体 B.原来CaCO3的质量为14.5gC.剩余8.0g固体为纯净物 D.剩余8.0g固体中加入稀盐酸无明显现象
二、填空题
16.盐是________离子和________离子(或________离子)组成的化合物。硫酸铜、石膏都可以归为________盐。
17.除去KCl溶液中少量的K2SO4杂质,其方法是:加入适量的________溶液,反应后生成________白色沉淀再经过滤,即可除去杂质,反应的化学方程式为________。
18.已知盐酸是HCl气体溶于水所形成的溶液,在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清石灰水,往往看不到溶液变浑浊的现象。现有一同学用下列装置进行实验,却看到澄清石灰水变浑浊的现象。回答下列问题:
(1)A装置中发生反应的化学方程式为________。
(2)B装置的作用是________,实验后向B中滴入紫色石蕊试液,可看到的现象是________,写出B中所有溶质的化学式:________。
(3)如果去掉B装置,将A、C直接连接,则C装置中可能发生反应的化学方程式是________。
19.用相关的化学方程式回答下列问题:
(1)有人误食氯化钡而引起中毒,若及时服用硫酸钠溶液可以解毒,原因是__ _,若及时服用碳酸钠溶液__ __(选填“能”或“不能”)解毒,原因是__ _。
(2)苏打水中滴加稀盐酸,观察到的现象是__ __,其反应的化学方程式为__ 。
20.镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。主要步骤如图:
(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选用________,要使MgCl2完全转化为沉淀,加入试剂①的量应________,验证MgCl2已完全转化为Mg(OH)2的方法是________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的操作是________。
(3)试剂②可以选用________。
答案和解析
一、选择题
1.B
2.A3.B4.B5.C6.D7.C8.C9.B10.C11.B
【解析】A、氧化铜和氧化铁不溶于水,但都能与硝酸反应形成溶液,不符合题意;B、氯化银和硫酸钡既不溶于水也不溶于硝酸,符合题意;C、氢氧化铜和氢氧化铁不溶于水,但能溶于酸,不符合题意;D、碳酸钙和碳酸钡不溶于水,但能溶于酸,不符合题意;
故选B。12.D13.D
【解析】A、KCl溶液中含有氯离子,但呈无色,可证明显黄色不是由Cl-离子造成的,不符合题意;B、向FeCl3溶液中滴加适量氢氧化钠溶液振荡后静置,因铁离子转化为沉淀,溶液黄色消失,可证明显黄色是由铁离子造成的,不符合题意;C、向FeCl3溶液中滴加适量无色硝酸银溶液,将氯离子转化为沉淀,溶液黄色未消失,可证明显黄色是由铁离子造成的,不符合题意;D、加水稀释后FeCl3溶液黄色变浅,溶液中仍是存在铁离子和氯离子,无法证明溶液黄色是由哪种离子造成,符合题意;
故选D。14.D15.A
【解析】钙元素质量为8.0g×50.0%=4g,因反应前后钙元素质量不变,则反应前碳酸钙质量为4g4g÷40100=10g;
A、固体减少质量即为生成气体质量,生成CO2气体质量为10g-8.0g=2.0g,符合题意;B、原来CaCO3的质量为10g,不符合题意;C、10g碳酸钙完全反应生成二氧化碳不2.2克,说明剩余8.0g固体为氧化钙和碳酸钙混合物,不符合题意;D、剩余8.0g固体中含有未分解的碳酸钙,加入稀盐酸会产生气泡,不符合题意;
故选A。二、填空题
16.酸根;金属;铵根;硫酸
17.BaCl2;BaSO4;K2SO4+BaCl2=BaSO4↓+2KCl
18.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)吸收挥发出的氯化氢气体;溶液变红;HCl、H2CO3
(3)Ca(OH)2+2HCl=CaCl2+2H2O
【解析】(1)A中为碳酸钙与盐酸的反应,方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)因浓盐酸有挥发性,生成二氧化碳中含有大量氯化氢气体,氯化氢易溶于水,所以B装置作用为吸收挥发出的氯化氢气体;B中溶液呈酸性,实验后向B中滴入紫色石蕊试液,可看到溶液变红;二氧化碳也能与水反应生成碳酸,所以B中溶质为HCl、H2CO3;
(3)若二氧化碳中含有大量氯化氢,则通入石灰水中,氯化氢与氢氧化钙反应,会干扰二氧化碳反应,方程式为Ca(OH)2+2HCl=CaCl2+2H2O;
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)吸收挥发出的氯化氢气体;溶液变红;HCl、H2CO3;(3)Ca(OH)2+2HCl=CaCl2+2H2O。19.BaCl2+Na2SO4===BaSO4↓+2NaCl;不能;BaCl2+Na2CO3===BaCO3↓+2NaCl、BaCO3+2HCl===BaCl2+H2O+CO2↑;有气泡产生;NaHCO3+HCl===NaCl+H2O+CO2↑;20.(1)氢氧化钠(或氢氧化钙等);过量;取上层清液于试管中,继续滴加氢氧化钠,若无沉淀生成,则证明已完全转化
(2)过滤
(3)盐酸
【解析】(1)氯化镁与可溶性碱反应可生成氢氧化镁,如氢氧化钠、氢氧化钙等;要使MgCl2完全转化为沉淀,加入试剂要过量;验证MgCl2已完全转化为Mg(OH)2即证明不含氯化镁,可取上层清液于试管中,继续滴加氢氧化钠,若无沉淀生成,则证明已完全转化;
(2)加入碱的溶液后,要分离出沉淀氢氧化镁要用过滤的方法;
(3)氢氧化镁要转化为氯化镁,需加入盐酸;
故答案为:(1)氢氧化钠(或氢氧化钙等);过量;取上层清液于试管中,继续滴加氢氧化钠,若无沉淀生成,则证明已完全转化;(2)过滤;(3)盐酸。
