8.3 二氧化碳的实验室制法课件 — 2021-2022学年九年级化学京改版(2013)上册(共22张PPT)
文档属性
| 名称 | 8.3 二氧化碳的实验室制法课件 — 2021-2022学年九年级化学京改版(2013)上册(共22张PPT) |
|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-07 11:24:23 | ||
图片预览





文档简介
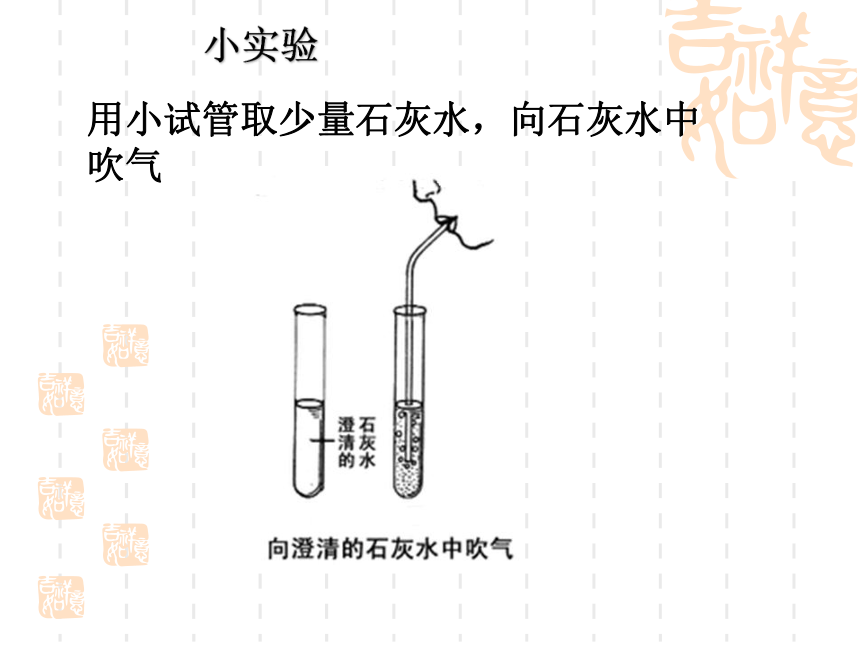
小实验
用小试管取少量石灰水,向石灰水中吹气
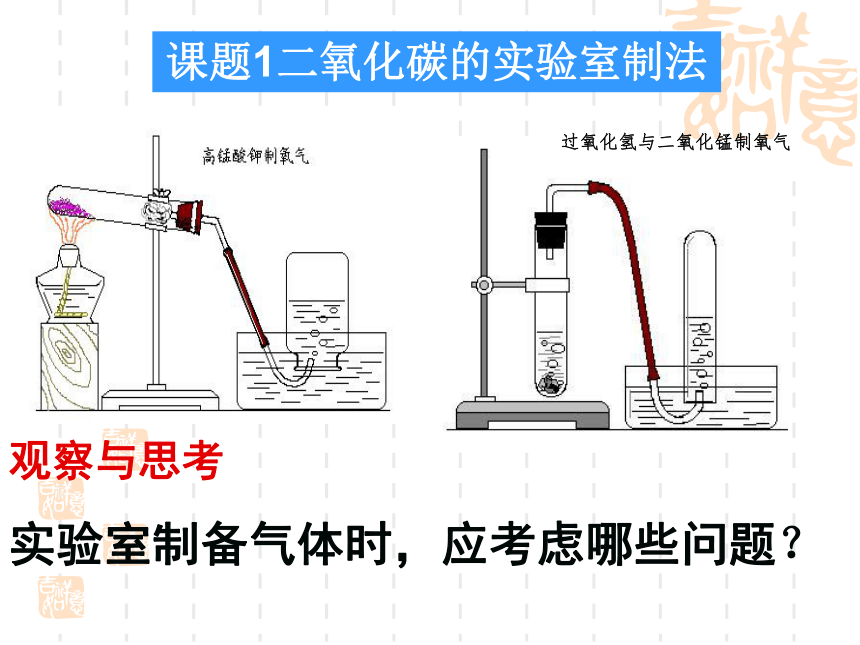
过氧化氢与二氧化锰制氧气
观察与思考
实验室制备气体时,应考虑哪些问题?
课题1二氧化碳的实验室制法
一、气体的实验室制法
1.所需药品
2.反应原理
3.发生装置
4.收集方法
5.步骤
6.验满
7.检验
课题1二氧化碳的制法
一、探究反应原理
哪些化学变化可以产生CO2
实验室制取气体的要求
1、纯度高、2反应速率适中 3条件易于达成
( ) O2
反应药品的选择:
氧元素
( ) CO2
碳元素、氧元素
小资料:
1、碳酸钙(CaCO3)与稀酸(稀盐酸、稀硫酸) 在常温下反应会产生二氧化碳
2、自然界中碳酸钙含量丰富,大理石、石灰石中的主要成分都是碳酸钙(其中的杂质一般不与稀酸反应)
碳酸钙CaCO3
白色粉末
大理石
石灰石
块状固体
主要成分都是碳酸钙
稀硫酸
稀盐酸
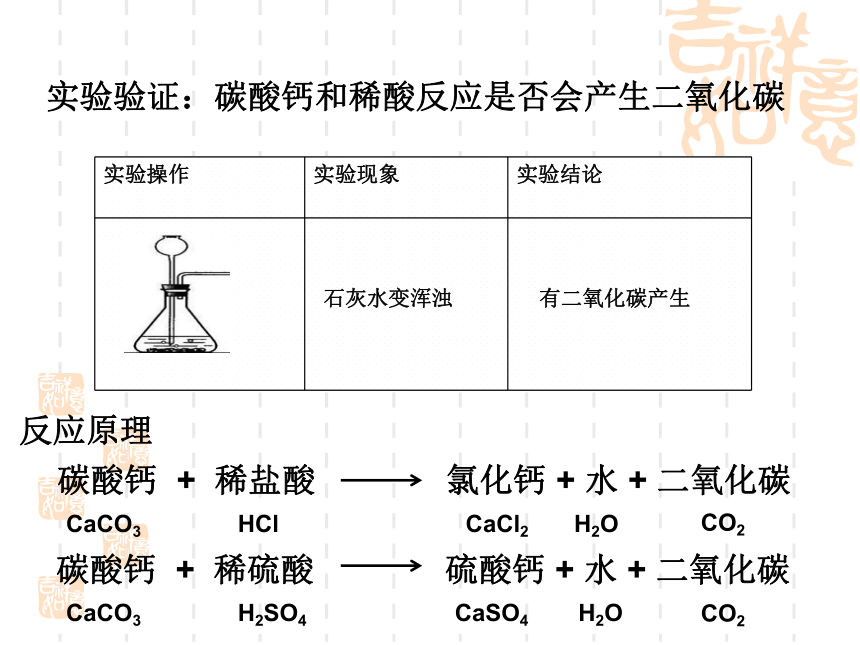
实验验证:碳酸钙和稀酸反应是否会产生二氧化碳
实验操作
实验现象
实验结论
石灰水变浑浊
有二氧化碳产生
反应原理
碳酸钙 + 稀盐酸 氯化钙 + 水 + 二氧化碳
CaCO3
HCl
CaCl2
H2O
CO2
碳酸钙 + 稀硫酸 硫酸钙 + 水 + 二氧化碳
CaCO3
H2SO4
CaSO4
H2O
CO2
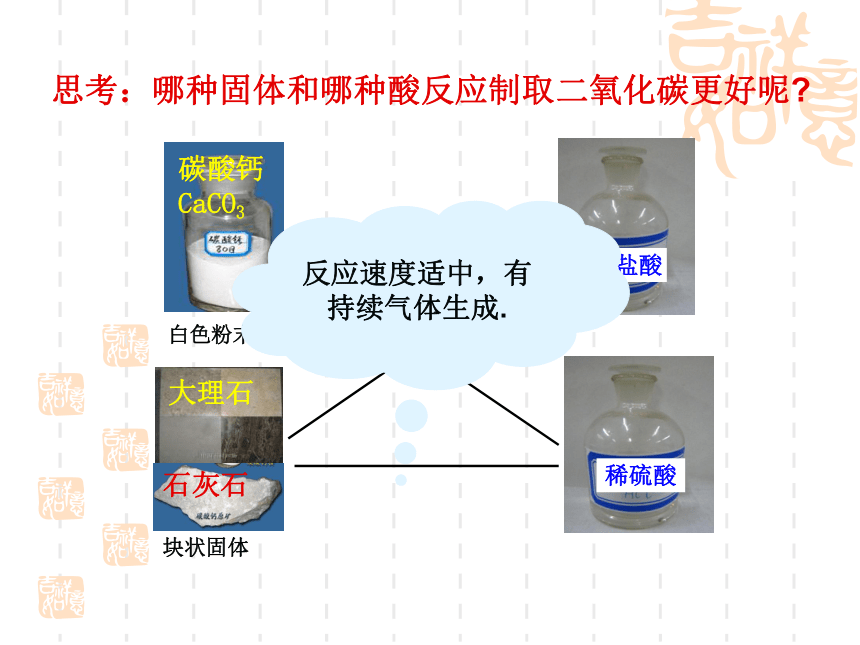
思考:哪种固体和哪种酸反应制取二氧化碳更好呢?
碳酸钙CaCO3
白色粉末
大理石
石灰石
块状固体
稀硫酸
稀盐酸
反应速度适中,有持续气体生成.
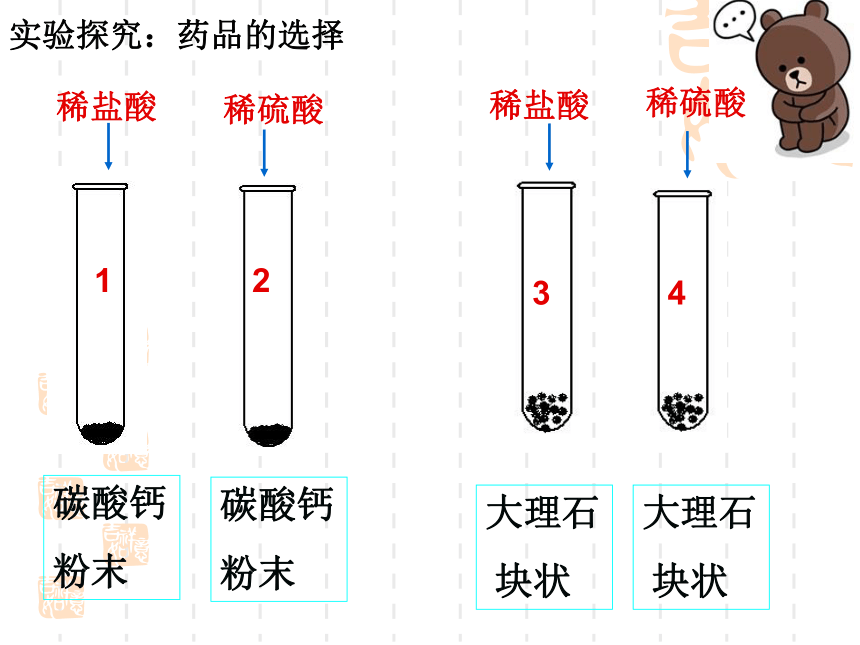
实验探究:药品的选择
碳酸钙
粉末
碳酸钙
粉末
稀盐酸
稀硫酸
大理石
块状
大理石
块状
稀盐酸
稀硫酸
1
2
3
4
实验室制二氧化碳用浓盐酸是否可行?
现象:有刺激性气味
结论:
不能,因为浓盐酸会挥发出氯化氢气体,制得的CO2中混有氯化氢。
*
大理石(或石灰石)和稀盐酸
1.药品
混合物,主要成份碳酸钙CaCO3
混合物,含氯化氢HCl和水H2O
思考(1)实验室不用稀硫酸制CO2的原因?
大理石与稀硫酸反应生成微溶物,阻碍反应进行
(2)实验室不用CaCO3粉末制CO2的原因?
反应速度太快不易收集。
(3)实验室制CO2不用浓盐酸的原因?
浓盐酸会能发出氯化氢,制得的CO2中混有氯化氢
2、反应原理
CaCO3+2HCl CaCl2 + H2O+CO2
1、药品: 大理石(石灰石)
稀盐酸
碳酸钙 + 稀盐酸 氯化钙 + 水 + 二氧化碳
3.发生装置
CO2
固体加热
固—液不加热
A
B
向上排空气法
排水法
O2密度比空气大,O2不易溶于水
O2收集
氧气的性质:
向上排空气法
向下排空气法
排水法
CO2密度比空气大,能溶于水且 和水反应生成碳酸。
--用向上排空气法
4. CO2收集
实验室制取氧气
检查气密性
检查气密性
装药品
装药品
加热
收集气体
收集气体
导管移出水面
验满
熄灭酒精灯
双氧水制氧气
高锰酸钾制氧气
实验室制二氧化碳
检查气密性
装药品
收集气体
验满
5.验满
1、二氧化碳可以使石灰水变浑浊
2、二氧化碳可以使紫色石蕊试剂变红
3、二氧化碳不燃烧,也不支持燃烧,
可以使燃烧的木条熄灭
3、二氧化碳不燃烧,也不支持燃烧,
可以使燃烧的木条熄灭
将燃着的木条接近瓶口,熄灭则满。
请同学们自己制取一瓶二氧化碳
检查气密性
装药品
收集气体
验满
6.检验:如何检验一集气瓶中,是否是二氧化碳
练习1:指出下列装置中的四处错误
1、长颈漏斗应伸入液面以下
2、导管应伸入胶塞少许
3、集气瓶口应向上
4、导管应伸入集气瓶底部
1
2
3
4
1、长颈漏斗颈未伸入液面下
2、导管伸入胶塞过长
3、集气瓶口向下倾斜
4、导管未伸入集气瓶底部
改正错误:
小结:实验室制取二氧化碳
1.所需药品
2.反应原理
3.发生装置
4.收集方法
5.步骤:
6.验满
7.检验
大理石(或石灰石)和稀盐酸
向上排空气法
将气体通入澄清石灰水振荡,澄清石灰变浑浊则原气体为二氧化碳
将燃着木条接近集气瓶口,木条熄灭,二氧化碳已满
CaCO3+2HCl CaCl2 + H2O+CO2
组装仪器检查气密性,装药品(先固后液),收集。
用小试管取少量石灰水,向石灰水中吹气
过氧化氢与二氧化锰制氧气
观察与思考
实验室制备气体时,应考虑哪些问题?
课题1二氧化碳的实验室制法
一、气体的实验室制法
1.所需药品
2.反应原理
3.发生装置
4.收集方法
5.步骤
6.验满
7.检验
课题1二氧化碳的制法
一、探究反应原理
哪些化学变化可以产生CO2
实验室制取气体的要求
1、纯度高、2反应速率适中 3条件易于达成
( ) O2
反应药品的选择:
氧元素
( ) CO2
碳元素、氧元素
小资料:
1、碳酸钙(CaCO3)与稀酸(稀盐酸、稀硫酸) 在常温下反应会产生二氧化碳
2、自然界中碳酸钙含量丰富,大理石、石灰石中的主要成分都是碳酸钙(其中的杂质一般不与稀酸反应)
碳酸钙CaCO3
白色粉末
大理石
石灰石
块状固体
主要成分都是碳酸钙
稀硫酸
稀盐酸
实验验证:碳酸钙和稀酸反应是否会产生二氧化碳
实验操作
实验现象
实验结论
石灰水变浑浊
有二氧化碳产生
反应原理
碳酸钙 + 稀盐酸 氯化钙 + 水 + 二氧化碳
CaCO3
HCl
CaCl2
H2O
CO2
碳酸钙 + 稀硫酸 硫酸钙 + 水 + 二氧化碳
CaCO3
H2SO4
CaSO4
H2O
CO2
思考:哪种固体和哪种酸反应制取二氧化碳更好呢?
碳酸钙CaCO3
白色粉末
大理石
石灰石
块状固体
稀硫酸
稀盐酸
反应速度适中,有持续气体生成.
实验探究:药品的选择
碳酸钙
粉末
碳酸钙
粉末
稀盐酸
稀硫酸
大理石
块状
大理石
块状
稀盐酸
稀硫酸
1
2
3
4
实验室制二氧化碳用浓盐酸是否可行?
现象:有刺激性气味
结论:
不能,因为浓盐酸会挥发出氯化氢气体,制得的CO2中混有氯化氢。
*
大理石(或石灰石)和稀盐酸
1.药品
混合物,主要成份碳酸钙CaCO3
混合物,含氯化氢HCl和水H2O
思考(1)实验室不用稀硫酸制CO2的原因?
大理石与稀硫酸反应生成微溶物,阻碍反应进行
(2)实验室不用CaCO3粉末制CO2的原因?
反应速度太快不易收集。
(3)实验室制CO2不用浓盐酸的原因?
浓盐酸会能发出氯化氢,制得的CO2中混有氯化氢
2、反应原理
CaCO3+2HCl CaCl2 + H2O+CO2
1、药品: 大理石(石灰石)
稀盐酸
碳酸钙 + 稀盐酸 氯化钙 + 水 + 二氧化碳
3.发生装置
CO2
固体加热
固—液不加热
A
B
向上排空气法
排水法
O2密度比空气大,O2不易溶于水
O2收集
氧气的性质:
向上排空气法
向下排空气法
排水法
CO2密度比空气大,能溶于水且 和水反应生成碳酸。
--用向上排空气法
4. CO2收集
实验室制取氧气
检查气密性
检查气密性
装药品
装药品
加热
收集气体
收集气体
导管移出水面
验满
熄灭酒精灯
双氧水制氧气
高锰酸钾制氧气
实验室制二氧化碳
检查气密性
装药品
收集气体
验满
5.验满
1、二氧化碳可以使石灰水变浑浊
2、二氧化碳可以使紫色石蕊试剂变红
3、二氧化碳不燃烧,也不支持燃烧,
可以使燃烧的木条熄灭
3、二氧化碳不燃烧,也不支持燃烧,
可以使燃烧的木条熄灭
将燃着的木条接近瓶口,熄灭则满。
请同学们自己制取一瓶二氧化碳
检查气密性
装药品
收集气体
验满
6.检验:如何检验一集气瓶中,是否是二氧化碳
练习1:指出下列装置中的四处错误
1、长颈漏斗应伸入液面以下
2、导管应伸入胶塞少许
3、集气瓶口应向上
4、导管应伸入集气瓶底部
1
2
3
4
1、长颈漏斗颈未伸入液面下
2、导管伸入胶塞过长
3、集气瓶口向下倾斜
4、导管未伸入集气瓶底部
改正错误:
小结:实验室制取二氧化碳
1.所需药品
2.反应原理
3.发生装置
4.收集方法
5.步骤:
6.验满
7.检验
大理石(或石灰石)和稀盐酸
向上排空气法
将气体通入澄清石灰水振荡,澄清石灰变浑浊则原气体为二氧化碳
将燃着木条接近集气瓶口,木条熄灭,二氧化碳已满
CaCO3+2HCl CaCl2 + H2O+CO2
组装仪器检查气密性,装药品(先固后液),收集。
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
