【新教材】2021-2022鲁科版化学必修一 同步学案 3.3.4物质特殊的转化关系与常见气体的制备
文档属性
| 名称 | 【新教材】2021-2022鲁科版化学必修一 同步学案 3.3.4物质特殊的转化关系与常见气体的制备 |

|
|
| 格式 | docx | ||
| 文件大小 | 862.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-09 10:34:44 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
物质特殊的转化关系与常见气体的制备
一、物质特殊的转化关系
1.直线型转化关系“ABC(酸或碱)”
NH3(N2)NONO2HNO3;
H2S(S)SO2SO3H2SO4;
CH4(C)COCO2H2CO3;
NaNa2ONa2O2NaOH。
2.三角型转化关系“”
【例1】 非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________________。
②在工业生产中,B气体的大量排放会形成________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是A________、C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式:_______________________________________________________________
_______________________________________________________________。
该反应________(填“属于”或“不属于”)氧化还原反应。
【对点练习】
1.已知某物质X能发生如下转化:
下列有关上述转化关系中物质及其反应的叙述错误的是( )
A.若X为N2或NH3,则A为硝酸
B.若X为S或H2S,则A为硫酸
C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
2.Ⅰ.常见无机物A、B、C、D、E、X存在如图转化关系。已知A、B、C、D的焰色试验都呈黄色,其中A为单质,X是常见的无色无味气体(部分生成物和反应条件略去)。
请回答:
(1)组成单质A的元素符号为________。
(2)写出由C转化为D的化学方程式:_________________________。
Ⅱ.A、B、C、D为四种常见物质。A是金属单质,且A的合金用量最大。这四种物质具有如图所示的转化关系(部分生成物和反应条件略去)。
请回答:
(1)向溶液C中滴加硫氰酸钾溶液,溶液变________色。
(2)写出图中反应C+A―→B的离子方程式:______________________________________。
3.5种常见物质X、Y、Z、E、F均含有同一元素M,已知Y是单质,Z是NO(一氧化氮),在一定条件下它们有如下转化关系:
X可能是一种氢化物吗?X―→Y可能是非氧化还原反应吗?试举例说明。
4.已知A、B、C、D之间的转化关系如图所示:
(1)若A为Fe,D为H2,则B一定为酸吗?
(2)若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则A、B、C、D各是什么微粒?写出其转化方程式。
二、常见气体的制备
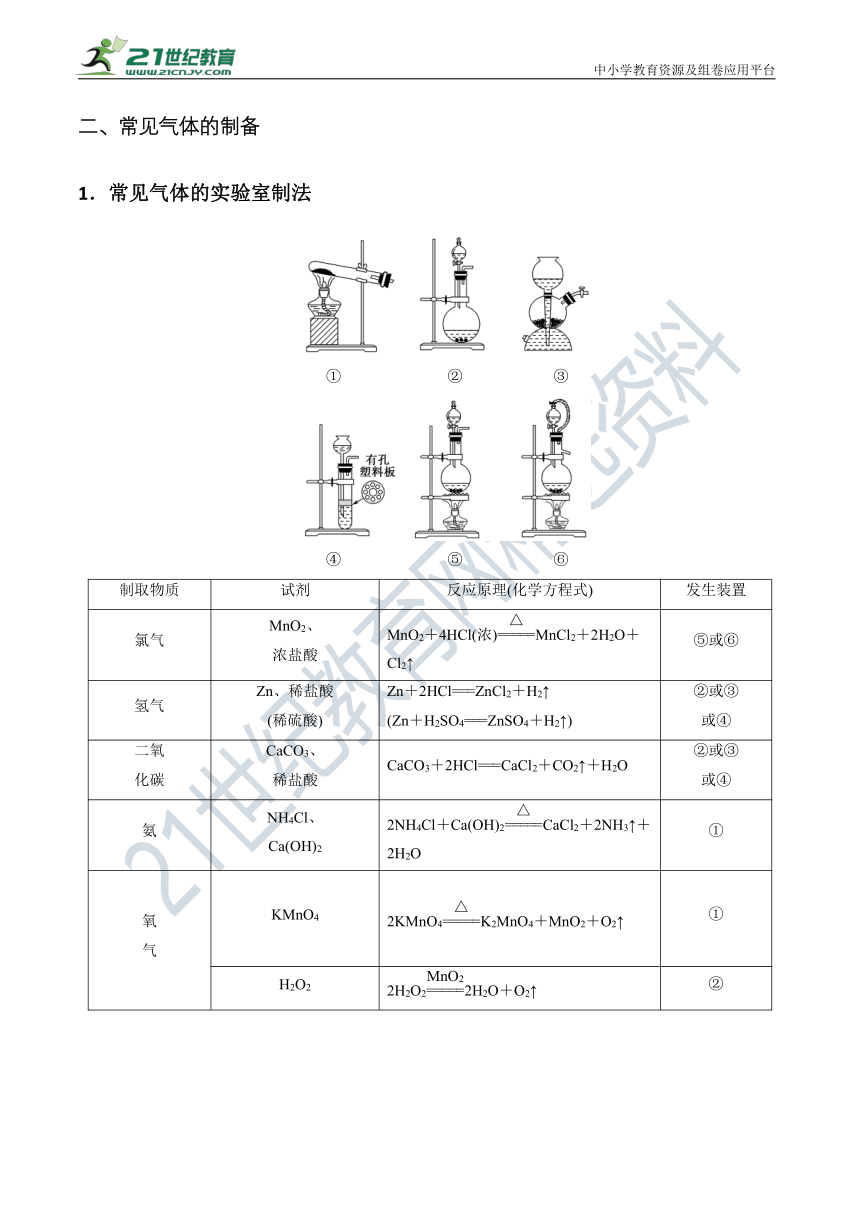
1.常见气体的实验室制法
① ② ③
④ ⑤ ⑥
制取物质
试剂
反应原理(化学方程式)
发生装置
氯气
MnO2、
浓盐酸
MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
⑤或⑥
氢气
Zn、稀盐酸
(稀硫酸)
Zn+2HCl===ZnCl2+H2↑
(Zn+H2SO4===ZnSO4+H2↑)
②或③
或④
二氧
化碳
CaCO3、
稀盐酸
CaCO3+2HCl===CaCl2+CO2↑+H2O
②或③
或④
氨
NH4Cl、
Ca(OH)2
2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
①
氧
气
KMnO4
2KMnO4K2MnO4+MnO2+O2↑
①
H2O2
2H2O22H2O+O2↑
②
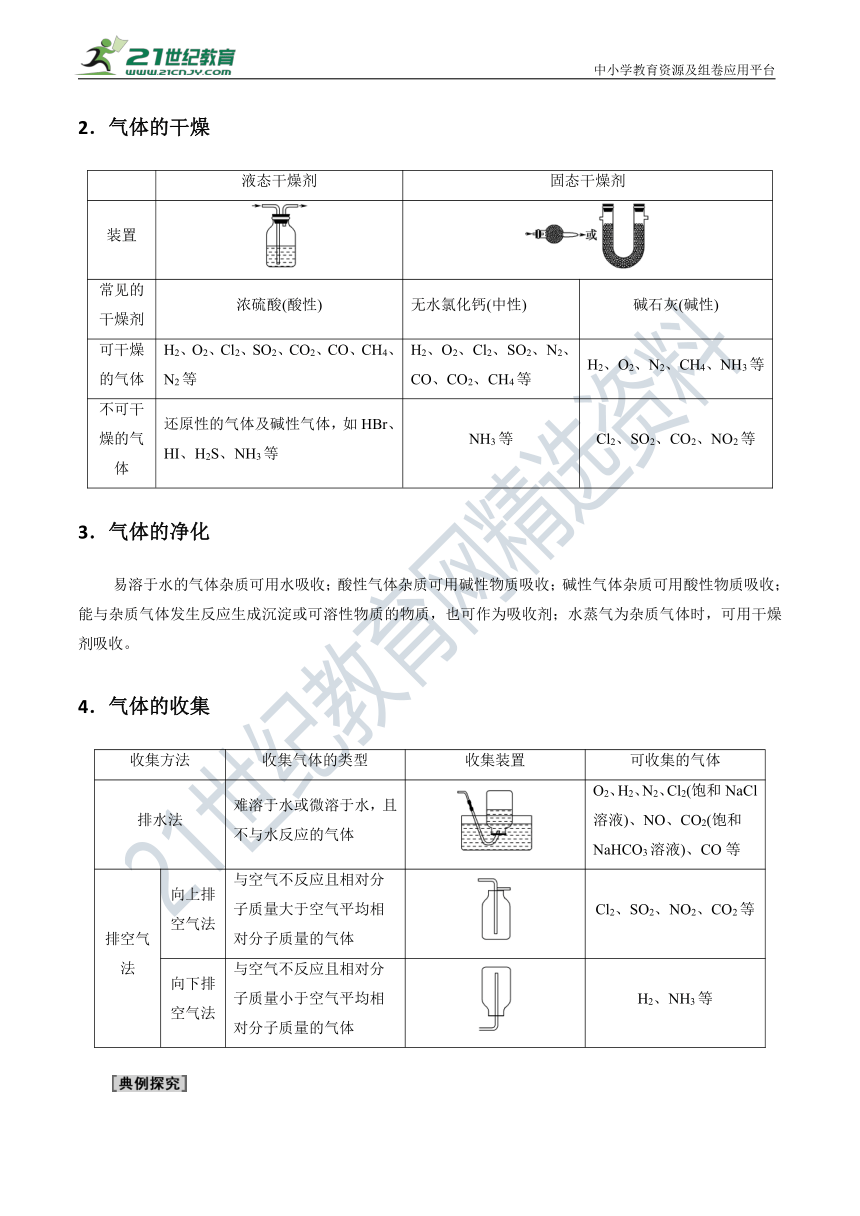
2.气体的干燥
液态干燥剂
固态干燥剂
装置
常见的干燥剂
浓硫酸(酸性)
无水氯化钙(中性)
碱石灰(碱性)
可干燥的气体
H2、O2、Cl2、SO2、CO2、CO、CH4、N2等
H2、O2、Cl2、SO2、N2、CO、CO2、CH4等
H2、O2、N2、CH4、NH3等
不可干燥的气体
还原性的气体及碱性气体,如HBr、HI、H2S、NH3等
NH3等
Cl2、SO2、CO2、NO2等
3.气体的净化
易溶于水的气体杂质可用水吸收;酸性气体杂质可用碱性物质吸收;碱性气体杂质可用酸性物质吸收;能与杂质气体发生反应生成沉淀或可溶性物质的物质,也可作为吸收剂;水蒸气为杂质气体时,可用干燥剂吸收。
4.气体的收集
收集方法
收集气体的类型
收集装置
可收集的气体
排水法
难溶于水或微溶于水,且不与水反应的气体
O2、H2、N2、Cl2(饱和NaCl溶液)、NO、CO2(饱和NaHCO3溶液)、CO等
排空气法
向上排空气法
与空气不反应且相对分子质量大于空气平均相对分子质量的气体
Cl2、SO2、NO2、CO2等
向下排空气法
与空气不反应且相对分子质量小于空气平均相对分子质量的气体
H2、NH3等
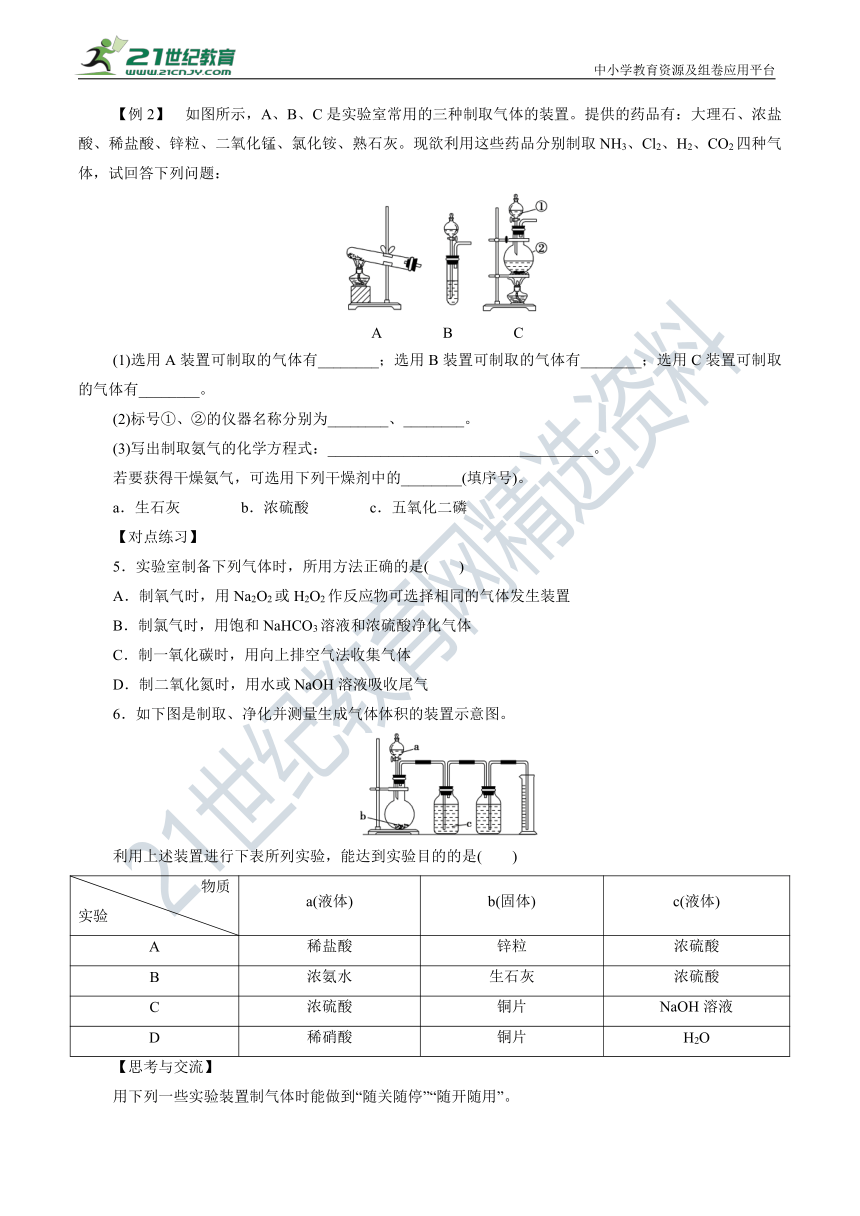
【例2】 如图所示,A、B、C是实验室常用的三种制取气体的装置。提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:
A B C
(1)选用A装置可制取的气体有________;选用B装置可制取的气体有________;选用C装置可制取的气体有________。
(2)标号①、②的仪器名称分别为________、________。
(3)写出制取氨气的化学方程式:___________________________________。
若要获得干燥氨气,可选用下列干燥剂中的________(填序号)。
a.生石灰 b.浓硫酸 c.五氧化二磷
【对点练习】
5.实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制一氧化碳时,用向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
6.如下图是制取、净化并测量生成气体体积的装置示意图。
利用上述装置进行下表所列实验,能达到实验目的的是( )
物质
实验
a(液体)
b(固体)
c(液体)
A
稀盐酸
锌粒
浓硫酸
B
浓氨水
生石灰
浓硫酸
C
浓硫酸
铜片
NaOH溶液
D
稀硝酸
铜片
H2O
【思考与交流】
用下列一些实验装置制气体时能做到“随关随停”“随开随用”。
1.实验室制备SO2用到的试剂是什么,原理是什么?能否用上述仪器装置制备?
[提示] 实验室制备SO2用到的试剂是Na2SO3粉末和较浓的H2SO4,反应原理为Na2SO3+H2SO4===Na2SO4+SO2↑+H2O,因为Na2SO3为粉末状固体,故不能用上述装置制备。
2.实验室制备H2S用到的试剂是什么,原理是什么?能否用上述仪器装置制备?
[提示] 实验室制备H2S气体用FeS固体和稀硫酸,反应原理为FeS+H2SO4===FeSO4+H2S↑,因为FeS为块状固体,H2S难溶于反应液,FeSO4易溶于水,故可用上述装置制备。
3.实验室制备CO2气体能否用Na2CO3和稀盐酸或石灰石和稀硫酸,为什么?
[提示] 不能,Na2CO3和稀盐酸反应太快,不易控制,石灰石和稀硫酸反应生成CaSO4,它微溶于水,附着在CaCO3固体表面,阻碍反应进一步发生。
【课堂练习】
1.用下列装置收集Cl2并进行尾气吸收,其中最合理的是( )
A B
C
D
2.为了净化和收集由盐酸和大理石制得的CO2气体,从下图中选择合适的装置并连接。合理的是( )
A.a—a′→d—d′→e
B.b—b′→d—d′→g
C.c—c′→d—d′→g
D.d—d′→c—c′→f
3.如图为含有同一种元素的a、b、c、d四种物质的转化关系。其中a是单质,b、c是氧化物,d是酸,各步转化均为一步实现,则a可能是①C、②N2、③S中的( )
―→―→―→
A.①和③
B.只有①
C.①②③
D.①②
4.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法错误的是( )
A.X使蔗糖变黑的现象主要体现了X的脱水性
B.若A为铜,则X与A反应时只体现氧化性
C.若A为碳单质,则C不宜用来扑灭由钠引起的着火
D.将B气体通入品红溶液中,品红溶液褪色
5.氯气是一种重要的化工原料,在生产和生活中应用十分广泛。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,所以在实验室可用高锰酸钾固体和浓盐酸制氯气,实验装置图如图所示。
(1)请为该实验选择合适的发生装置________(填“A”或“B”)。
(2)要得到纯净、干燥的氯气,在发生装置和集气瓶之间还需要放置如下图中的________。
A B
C D
(3)当集气瓶中收集满氯气时,可以观察到气体呈_________色。烧杯中所盛液体为________,其作用是_______________。
【习题练习】
1.关于实验室制Cl2,下列说法正确的是( )
A.可用KMnO4和浓盐酸反应制取
B.用碱石灰干燥Cl2
C.用排水法收集Cl2
D.用饱和石灰水吸收尾气
2.下列各组气体在常温下能共存且能用向上排空气法收集的是( )
A.NO和O2
B.HCl和NH3
C.H2和CO
D.SO2和CO2
3.已知NH3难溶于CCl4。则如图所示装置中,不适宜用于NH3气体尾气吸收的是( )
A B C D
4.如图是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置制备气体的是( )
A.铜屑和浓硝酸
B.二氧化锰和浓盐酸
C.硫化亚铁和稀盐酸
D.铜和稀硝酸
5.如图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.固体NH4Cl和消石灰制取氨气
6.氮及其化合物的变化关系如图所示。
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.反应③中,NO2作氧化剂,H2O作还原剂
D.液氨可用作制冷剂,硝酸可用于制化肥、农药、炸药、染料、盐类等
7.如图为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。下列关于甲、乙、丙、丁的判断不正确的是( )
A.甲只具有还原性
B.乙、丙均为酸性氧化物
C.乙既有氧化性,又有还原性
D.丁为黄色或淡黄色固体
8.(双选)甲、乙、丙、丁四种物质之间的转化关系如下所示,则下列说法错误的是( )
A.若甲是C,则乙可能是O2
B.若甲是Fe,则乙可能是Cl2
C.若甲是NaOH溶液,则乙可能是SO3
D.若甲是H2S,则乙可能是O2
9.已知A是一种金属单质,B显淡黄色,相关物质的转化关系如图所示,则下列关于C的性质的叙述错误的是( )
A.易溶于水
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.属于碱
10.下列装置或操作能达到实验目的的是( )
A.实验室制取并收集NH3 B.干燥Cl2
C.检查装置气密性 D.利用排空气法收集CO2
11.下列制备和收集气体的实验装置合理的是( )
A.用氯化铵和氢氧化钙制NH3 B.用铜片和稀硝酸制NO
C.用锌粒和稀硫酸制H2 D.用双氧水和二氧化锰制O2
12.下列实验的试剂、装置选用不合理的是( )
甲 乙
丙
选项
实验目的
试剂
装置
A
除去Cl2中少量的HCl、H2O
试剂a为饱和氯化钠溶液
甲
B
除去H2中少量CO2、H2O
试剂b为碱石灰
乙
C
除去NH3中少量H2O
试剂b为无水氯化钙
乙
D
除去N2中少量的O2
足量的铜网
丙
13.下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号
X
Y
Z
W
①
S
Na2SO3
H2SO3
SO2
②
Na
NaOH
Na2CO3
NaCl
③
Cl2
Ca(ClO)2
HClO
HCl
④
Fe
FeCl3
FeCl2
Fe(OH)2
A.①②③
B.①③④
C.②③
D.②③④
14.已知A为常见的金属单质,根据如图所示的关系,下列叙述中正确的是( )
A.A为Fe,B为FeO
B.C→D溶液的颜色变化:浅绿色→棕黄色
C.④的离子方程式:Fe+Fe3+===2Fe2+
D.⑤的离子方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
15.在如图所示的转化关系中,已知B、D都是淡黄色固体,D与G的浓溶液在一定条件下反应生成E。
回答下列问题:
(1)写出下列物质的化学式:
A________、F________、H________。
(2)D与热的C溶液反应时氧化产物与还原产物的物质的量之比为1∶2,试写出该反应的离子方程式:________________________。
(3)写出D与G的浓溶液反应生成E的化学方程式:
______________________________________________________________。
16.如图表示某些物质之间的转化关系,每个字母代表一种物质,部分产物已略去。A是一种酸式盐,也是一种常用的化学肥料,B是能使湿润的红色石蕊试纸变蓝色的无色气体,D是无色无味气体。
回答下列问题:
(1)物质A的名称是________。
(2)写出物质B的一种主要用途_______________________________。
(3)写出实验室制取气体B的化学方程式:______________________;
写出工业上制取气体B的化学方程式:__________________________。
(4)写出下列反应的化学方程式:
B―→E:__________________________________________________;
F―→G:__________________________________________________。
17.工业上,向500~600
℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。
A B C D
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为___________________________________________________________________。
装置B中加入的试剂是________。
(2)制取无水氯化亚铁的实验中,装置A用来制取________。尾气的成分是________。若仍用D的装置进行尾气处理,存在的问题是________________________、________________________。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是________。欲制得纯净的FeCl2,在实验操作中应先________________,再_____________________________。
18.实验室常见的几种气体发生装置如图A、B、C所示:
A B C D
图1
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是_____________;检查C装置气密性的操作方法是______________________________________________。
(2)气体的性质是选择气体收集方法的主要依据。下列气体的性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤是否与氧气反应
(3)下图是某学生设计收集气体的几种装置,其中不可行的是________。
A B
C D
图2
(4)若用图1中的A装置与D装置相连制取收集X气体,则X可能是下列气体中的________;
①CO2 ②NO ③Cl2 ④H2
其中在D装置中连接小烧杯的目的是_______________。
参考答案附解析
【对点练习】
1.
D [A项,若X为N2或NH3,Y为NO,Z为NO2,则A为硝酸,正确;B项,若X为S或H2S,Y为SO2,Z为SO3,则A为硫酸,正确;C项,若X为非金属单质或非金属氢化物,A为硝酸或硫酸时,稀硝酸与Cu反应生成Y,浓硝酸和Cu反应不生成Y,且Cu与稀硫酸不反应,则A不一定能与金属铜反应生成Y,正确;D项,反应①和②一定为氧化还原反应,反应③若为二氧化氮和水的反应也为氧化还原反应,错误。]
2.
[解析] Ⅰ.A、B、C、D的焰色试验都呈黄色,均含有Na元素,其中A为单质,则A为Na,钠与水反应生成NaOH与氢气,可推知E为H2,B为NaOH,X是常见的无色无味气体,能与NaOH连续反应,可知X为CO2,C为Na2CO3,D为NaHCO3。
Ⅱ.A、B、C、D为四种常见物质。A是金属单质,且A的合金用量最大,则A为铁。铁与氯气反应生成氯化铁,C为FeCl3,铁与盐酸反应生成氯化亚铁,B为FeCl2,D与一氧化碳反应生成铁,则D可能为铁的某种氧化物。
[答案] Ⅰ.(1)Na (2)Na2CO3+H2O+CO2===2NaHCO3
Ⅱ.(1)红 (2)2Fe3++Fe===3Fe2+
3.
[提示] Z是NO,E是NO2,F是HNO3,Y可能是N2或NH3。如Y是N2则可通过反应8NH3+3Cl2===N2+6NH4Cl转化为N2,所以X可能是氢化物NH3;如Y是NH3则可通过反应Ca(OH)2+2NH4Cl2NH3↑+CaCl2+2H2O转化为NH3,此反应为非氧化还原反应。
4.
(1)
[提示] 不一定,B也可能是H2O。
(2)
[提示] C为NH3,可由OH-和NH反应生成:
NH+OH-NH3↑+H2O。
5.
A [用过氧化钠和过氧化氢制备氧气时,均可采用固液不加热的制气体装置,A项正确;氯气溶于水生成盐酸和次氯酸,盐酸与碳酸氢钠溶液反应生成CO2,B项错误;一氧化碳密度与空气密度接近,不能用排空气法收集,C项错误;不能用水吸收制取二氧化氮的尾气,因为二氧化氮与水生成硝酸和一氧化氮,一氧化氮不溶于水造成污染,D项错误。]
6.
A [A、B、C、D项中产生的气体依次分别为H2、NH3、SO2、NO;B项NH3不能用浓硫酸干燥;C项浓硫酸与Cu反应需要加热;D项中产生的NO与O2反应,测得V(NO)不准确。]
【课堂练习】
1.C [由于ρCl2>ρ空气,故采用向上排空气法收集Cl2,即导气管在试管中“长进短出”,排除A、B两项;用NaOH溶液吸收Cl2,为防止倒吸应使用倒扣漏斗,排除D项。]
2.C [由盐酸和大理石制得的CO2气体中会含有杂质H2O(g)和HCl,除杂的试剂分别为浓硫酸和饱和碳酸氢钠溶液,应先让气体通过饱和NaHCO3溶液除去HCl,再通过浓硫酸干燥。收集CO2时应用向上排空气法,所以正确答案为C选项。]
3.
C [①CCOCO2H2CO3,符合转化关系;
②N2NONO2HNO3,符合转化关系;
③SSO2SO3H2SO4,符合转化关系;因此符合转化关系的为①②③,C正确。]
4.
B [已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑,可知X为浓硫酸。浓硫酸能使蔗糖脱水炭化,故A不符合题意;若A为铜,铜和浓硫酸反应生成硫酸铜、SO2和H2O,X体现氧化性和酸性,故B符合题意;若A为碳单质,则C为二氧化碳,钠燃烧生成Na2O2,CO2和Na2O2反应放出O2,故CO2不宜用来扑灭由钠引起的着火,故C不符合题意;B为二氧化硫气体,有漂白性,通入品红溶液中,品红溶液褪色,故D不符合题意。]
5.
[解析] (1)由题知,该反应制取气体的类型为固体+液体―→气体;反应不需加热,故应选择B装置。
(2)氯气中可能混有HCl、H2O(g),HCl用饱和NaCl溶液除去,H2O(g)用浓硫酸除去,要得到纯净、干燥的氯气,应先除去HCl,再除去H2O(g)。
(3)氯气的颜色为黄绿色,烧杯中所盛液体为NaOH溶液,其作用是吸收多余的氯气。
[答案] (1)B (2)D (3)黄绿 NaOH溶液 吸收多余的氯气
【习题练习】
1.
A [KMnO4、MnO2都是氧化剂,都能与浓盐酸反应制取Cl2,A正确。Cl2是酸性气体,能溶于水,不能用碱石灰干燥,也不能用排水法收集,B、C错。Ca(OH)2微溶于水,饱和石灰水中溶有的Ca(OH)2太少,吸收尾气不彻底,D错。]
2.D [A和B选项中的两组气体常温下会发生反应,不能共存;C选项中的H2用向下排空气法收集,而CO一般用排水法收集;D选项中的SO2和CO2常温下不发生反应,而且两者的密度均比空气大,都可以用向上排空气法收集。]
3.B [B中装置易形成倒吸,不适宜NH3气体的尾气处理。]
4.
A [铜屑和浓硝酸反应生成NO2气体,可用图示的浓硫酸干燥,又因NO2密度比空气大且不与空气反应,可用图示的向上排空气法收集,A项正确;二氧化锰和浓盐酸反应制Cl2需加热,B项错误;硫化亚铁和稀盐酸制得的H2S易被浓硫酸氧化,C项错误;铜和稀硝酸反应生成的NO能与空气中的O2反应,不能利用图示的排空气法收集,D项错误。]
5.
B [能用启普发生器制取的气体应满足的条件:块状固体和液体进行反应,生成的气体难溶于反应液,反应不需要加热(反应过程中不能有太大热量变化,生成物除气体外应易溶于水)。大理石和稀硫酸反应生成的硫酸钙微溶于水,附着在大理石的表面阻止反应的进行,A项不合题意;浓盐酸与二氧化锰反应需要加热,且MnO2为粉末状固体,C项不合题意;固体NH4Cl和消石灰制取氨气需要加热,且氨气易溶于水,D项不合题意。]
6.
C [反应③:3NO2+H2O===2HNO3+NO,NO2既是氧化剂又是还原剂。]
7.
A [甲、乙、丙、丁分别为H2S、SO2、SO3、S。H2S中-2价的S只有还原性,但其中的H为+1价,具有氧化性,如H2S与活泼金属反应可表现出氧化性(即酸性),A项错误;SO2与SO3均能与碱和碱性氧化物反应生成盐,均为酸性氧化物,B项正确;SO2中的S为+4价,处于S的中间价态,C项正确;单质S为黄色或淡黄色固体,D项正确。]
8.BC [若甲是C,则乙可能是O2,丙是CO,丁是CO2,A正确;若甲是Fe,乙是Cl2,则丙是氯化铁,氯化铁和氯气不反应,B错误;若甲是NaOH溶液,则乙可能是SO2,丙是亚硫酸钠,丁是亚硫酸氢钠,C错误;若甲是H2S,则乙可能是O2,丙是S,丁是SO2,D正确。]
9.
D [根据已知信息,可以推断出A为Na,B为Na2O2,C为Na2CO3,D为NaOH。Na2CO3属于盐,D项错误。]
10.C [A中,由于氨气的密度小于空气的密度,用向下排空气法收集是正确的,但集气瓶瓶口不能密封(塞橡皮塞),可塞一团疏松的棉花,目的是防止气体对流,以收集到较纯的氨气;B中,洗气时气体应长进短出;C中,通过观察长颈漏斗中液面是否下降,可以检查装置的气密性;D中,收集密度比空气重的二氧化碳气体用向上排空气法,应该为长管进气,短管排出空气。]
11.D [A中大试管的管口应略向下倾斜;B中NO很容易被空气中的氧气氧化,所以采用B装置得不到NO;C中氢气的密度比空气小,所以集气瓶中的进气导管应比出气导管要短,C错误;D装置合理。]
12.
C [A选项正确,甲装置中饱和氯化钠溶液可除去HCl,浓硫酸可除去H2O;B选项正确,干燥管中碱石灰的成分为生石灰与氢氧化钠,可除去CO2和H2O;C选项错误,干燥管中的无水氯化钙在除去水的同时也会吸收NH3生成络合物;D选项正确,丙装置中的铜网可除去O2。]
13.
A [①S溶于NaOH溶液加热可得Na2SO3,Na2SO3溶液中滴加稀盐酸可得H2SO3,H2SO3受热分解生成SO2,SO2再与H2S反应可得S,故正确;②钠与水反应生成NaOH,NaOH与H2CO3反应生成Na2CO3,Na2CO3与稀盐酸反应生成NaCl,NaCl熔融电解生成钠,故正确;③Cl2与石灰乳反应生成Ca(ClO)2,Ca(ClO)2与稀盐酸反应生成HClO,HClO光照分解生成HCl,HCl电解生成Cl2,故正确;④Fe与Cl2反应可生成FeCl3,FeCl3与Fe反应得FeCl2,FeCl2与NaOH反应生成Fe(OH)2,Fe(OH)2一步转化得不到Fe,故错误。故选A。]
14.B [由“红褐色固体”可知F是Fe(OH)3,从而得出A为Fe,“黑色晶体”B为Fe3O4,继而推出C为FeCl2,D为FeCl3,E为Fe(OH)2。⑤的离子方程式为Fe+2Fe3+===3Fe2+,④的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。]
15.
[解析] (1)B、D都是淡黄色固体,在中学阶段,常见的淡黄色固体有S、Na2O2、AgBr,而由图中“AO2,BH2O,O2”推断,可知A为Na,B为Na2O2,C为NaOH,D为S,E、F分别是SO2、SO3,G、H分别为H2SO4、Na2SO4。
(2)S与热的NaOH溶液反应时氧化产物与还原产物的物质的量之比为1∶2,由化合价升降总数相等,则氧化产物应该为Na2SO3,还原产物为Na2S,据此写出反应的离子方程式。
(3)S与浓硫酸加热时反应生成SO2,化学方程式为S+2H2SO4(浓)
3SO2↑+2H2O。
[答案] (1)Na SO3 Na2SO4
(2)3S+6OH-===2S2-+SO+3H2O
(3)S+2H2SO4(浓)
3SO2↑+2H2O
16.
[解析] A与NaOH固体加热反应生成能使湿润的红色石蕊试纸变蓝色的无色气体B,则B是NH3,A是铵盐。D是无色无味气体,由B+D―→E,E+D―→F可推测D为O2,则E为NO,F为NO2,NO2与H2O反应生成HNO3(G),在加热条件下HNO3与木炭反应生成NO2和CO2,即C为CO2,A为NH4HCO3。
[答案] (1)碳酸氢铵 (2)制氮肥(或制硝酸或做制冷剂,合理即可)
(3)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(4)4NH3+5O24NO+6H2O 3NO2+H2O===2HNO3+NO
17.
[解析] (1)制取无水氯化铁的实验中,A装置为氯气的制备装置,发生的反应为二氧化锰和浓盐酸共热生成二氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,装置B的作用是除去氯气中的水蒸气,B中加入的试剂是浓硫酸。(2)根据题给信息知制取无水氯化亚铁的实验中,装置A用来制取HCl;尾气的成分是HCl和H2;若仍用D的装置进行尾气处理,氯化氢气体极易溶于水,氢气与氢氧化钠溶液不反应,则存在的问题是发生倒吸、可燃性气体H2不能被吸收。(3)检验FeCl3常用的试剂是KSCN溶液;欲制得纯净的FeCl2,应防止装置中氧气的干扰,在实验操作中应先通入氯化氢,利用产生的氯化氢气体排出装置中的空气,再点燃C处的酒精灯。
[答案] (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 浓硫酸
(2)HCl HCl和H2 易发生倒吸 可燃性气体H2不能被吸收
(3)KSCN溶液 通入氯化氢(赶尽装置中的空气) 点燃C处的酒精灯
18.
[答案] (1)浓氨水和氧化钙(或碱石灰、固体氢氧化钠等) 连接一根导管,将导管通入水槽中,关闭分液漏斗的活塞,用手捂或酒精灯微热圆底烧瓶底部,如果导管口处有气泡产生,松开手或停止加热后,在导管里形成一段水柱,说明C装置气密性良好
(2)②④ (3)BC (4)③ 吸收尾气,防止污染空气
物质特殊的转化关系与常见气体的制备
一、物质特殊的转化关系
1.直线型转化关系“ABC(酸或碱)”
NH3(N2)NONO2HNO3;
H2S(S)SO2SO3H2SO4;
CH4(C)COCO2H2CO3;
NaNa2ONa2O2NaOH。
2.三角型转化关系“”
【例1】 非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________________。
②在工业生产中,B气体的大量排放会形成________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是A________、C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式:_______________________________________________________________
_______________________________________________________________。
该反应________(填“属于”或“不属于”)氧化还原反应。
【对点练习】
1.已知某物质X能发生如下转化:
下列有关上述转化关系中物质及其反应的叙述错误的是( )
A.若X为N2或NH3,则A为硝酸
B.若X为S或H2S,则A为硫酸
C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
2.Ⅰ.常见无机物A、B、C、D、E、X存在如图转化关系。已知A、B、C、D的焰色试验都呈黄色,其中A为单质,X是常见的无色无味气体(部分生成物和反应条件略去)。
请回答:
(1)组成单质A的元素符号为________。
(2)写出由C转化为D的化学方程式:_________________________。
Ⅱ.A、B、C、D为四种常见物质。A是金属单质,且A的合金用量最大。这四种物质具有如图所示的转化关系(部分生成物和反应条件略去)。
请回答:
(1)向溶液C中滴加硫氰酸钾溶液,溶液变________色。
(2)写出图中反应C+A―→B的离子方程式:______________________________________。
3.5种常见物质X、Y、Z、E、F均含有同一元素M,已知Y是单质,Z是NO(一氧化氮),在一定条件下它们有如下转化关系:
X可能是一种氢化物吗?X―→Y可能是非氧化还原反应吗?试举例说明。
4.已知A、B、C、D之间的转化关系如图所示:
(1)若A为Fe,D为H2,则B一定为酸吗?
(2)若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则A、B、C、D各是什么微粒?写出其转化方程式。
二、常见气体的制备
1.常见气体的实验室制法
① ② ③
④ ⑤ ⑥
制取物质
试剂
反应原理(化学方程式)
发生装置
氯气
MnO2、
浓盐酸
MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
⑤或⑥
氢气
Zn、稀盐酸
(稀硫酸)
Zn+2HCl===ZnCl2+H2↑
(Zn+H2SO4===ZnSO4+H2↑)
②或③
或④
二氧
化碳
CaCO3、
稀盐酸
CaCO3+2HCl===CaCl2+CO2↑+H2O
②或③
或④
氨
NH4Cl、
Ca(OH)2
2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
①
氧
气
KMnO4
2KMnO4K2MnO4+MnO2+O2↑
①
H2O2
2H2O22H2O+O2↑
②
2.气体的干燥
液态干燥剂
固态干燥剂
装置
常见的干燥剂
浓硫酸(酸性)
无水氯化钙(中性)
碱石灰(碱性)
可干燥的气体
H2、O2、Cl2、SO2、CO2、CO、CH4、N2等
H2、O2、Cl2、SO2、N2、CO、CO2、CH4等
H2、O2、N2、CH4、NH3等
不可干燥的气体
还原性的气体及碱性气体,如HBr、HI、H2S、NH3等
NH3等
Cl2、SO2、CO2、NO2等
3.气体的净化
易溶于水的气体杂质可用水吸收;酸性气体杂质可用碱性物质吸收;碱性气体杂质可用酸性物质吸收;能与杂质气体发生反应生成沉淀或可溶性物质的物质,也可作为吸收剂;水蒸气为杂质气体时,可用干燥剂吸收。
4.气体的收集
收集方法
收集气体的类型
收集装置
可收集的气体
排水法
难溶于水或微溶于水,且不与水反应的气体
O2、H2、N2、Cl2(饱和NaCl溶液)、NO、CO2(饱和NaHCO3溶液)、CO等
排空气法
向上排空气法
与空气不反应且相对分子质量大于空气平均相对分子质量的气体
Cl2、SO2、NO2、CO2等
向下排空气法
与空气不反应且相对分子质量小于空气平均相对分子质量的气体
H2、NH3等
【例2】 如图所示,A、B、C是实验室常用的三种制取气体的装置。提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:
A B C
(1)选用A装置可制取的气体有________;选用B装置可制取的气体有________;选用C装置可制取的气体有________。
(2)标号①、②的仪器名称分别为________、________。
(3)写出制取氨气的化学方程式:___________________________________。
若要获得干燥氨气,可选用下列干燥剂中的________(填序号)。
a.生石灰 b.浓硫酸 c.五氧化二磷
【对点练习】
5.实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制一氧化碳时,用向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
6.如下图是制取、净化并测量生成气体体积的装置示意图。
利用上述装置进行下表所列实验,能达到实验目的的是( )
物质
实验
a(液体)
b(固体)
c(液体)
A
稀盐酸
锌粒
浓硫酸
B
浓氨水
生石灰
浓硫酸
C
浓硫酸
铜片
NaOH溶液
D
稀硝酸
铜片
H2O
【思考与交流】
用下列一些实验装置制气体时能做到“随关随停”“随开随用”。
1.实验室制备SO2用到的试剂是什么,原理是什么?能否用上述仪器装置制备?
[提示] 实验室制备SO2用到的试剂是Na2SO3粉末和较浓的H2SO4,反应原理为Na2SO3+H2SO4===Na2SO4+SO2↑+H2O,因为Na2SO3为粉末状固体,故不能用上述装置制备。
2.实验室制备H2S用到的试剂是什么,原理是什么?能否用上述仪器装置制备?
[提示] 实验室制备H2S气体用FeS固体和稀硫酸,反应原理为FeS+H2SO4===FeSO4+H2S↑,因为FeS为块状固体,H2S难溶于反应液,FeSO4易溶于水,故可用上述装置制备。
3.实验室制备CO2气体能否用Na2CO3和稀盐酸或石灰石和稀硫酸,为什么?
[提示] 不能,Na2CO3和稀盐酸反应太快,不易控制,石灰石和稀硫酸反应生成CaSO4,它微溶于水,附着在CaCO3固体表面,阻碍反应进一步发生。
【课堂练习】
1.用下列装置收集Cl2并进行尾气吸收,其中最合理的是( )
A B
C
D
2.为了净化和收集由盐酸和大理石制得的CO2气体,从下图中选择合适的装置并连接。合理的是( )
A.a—a′→d—d′→e
B.b—b′→d—d′→g
C.c—c′→d—d′→g
D.d—d′→c—c′→f
3.如图为含有同一种元素的a、b、c、d四种物质的转化关系。其中a是单质,b、c是氧化物,d是酸,各步转化均为一步实现,则a可能是①C、②N2、③S中的( )
―→―→―→
A.①和③
B.只有①
C.①②③
D.①②
4.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法错误的是( )
A.X使蔗糖变黑的现象主要体现了X的脱水性
B.若A为铜,则X与A反应时只体现氧化性
C.若A为碳单质,则C不宜用来扑灭由钠引起的着火
D.将B气体通入品红溶液中,品红溶液褪色
5.氯气是一种重要的化工原料,在生产和生活中应用十分广泛。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,所以在实验室可用高锰酸钾固体和浓盐酸制氯气,实验装置图如图所示。
(1)请为该实验选择合适的发生装置________(填“A”或“B”)。
(2)要得到纯净、干燥的氯气,在发生装置和集气瓶之间还需要放置如下图中的________。
A B
C D
(3)当集气瓶中收集满氯气时,可以观察到气体呈_________色。烧杯中所盛液体为________,其作用是_______________。
【习题练习】
1.关于实验室制Cl2,下列说法正确的是( )
A.可用KMnO4和浓盐酸反应制取
B.用碱石灰干燥Cl2
C.用排水法收集Cl2
D.用饱和石灰水吸收尾气
2.下列各组气体在常温下能共存且能用向上排空气法收集的是( )
A.NO和O2
B.HCl和NH3
C.H2和CO
D.SO2和CO2
3.已知NH3难溶于CCl4。则如图所示装置中,不适宜用于NH3气体尾气吸收的是( )
A B C D
4.如图是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置制备气体的是( )
A.铜屑和浓硝酸
B.二氧化锰和浓盐酸
C.硫化亚铁和稀盐酸
D.铜和稀硝酸
5.如图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.固体NH4Cl和消石灰制取氨气
6.氮及其化合物的变化关系如图所示。
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.反应③中,NO2作氧化剂,H2O作还原剂
D.液氨可用作制冷剂,硝酸可用于制化肥、农药、炸药、染料、盐类等
7.如图为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。下列关于甲、乙、丙、丁的判断不正确的是( )
A.甲只具有还原性
B.乙、丙均为酸性氧化物
C.乙既有氧化性,又有还原性
D.丁为黄色或淡黄色固体
8.(双选)甲、乙、丙、丁四种物质之间的转化关系如下所示,则下列说法错误的是( )
A.若甲是C,则乙可能是O2
B.若甲是Fe,则乙可能是Cl2
C.若甲是NaOH溶液,则乙可能是SO3
D.若甲是H2S,则乙可能是O2
9.已知A是一种金属单质,B显淡黄色,相关物质的转化关系如图所示,则下列关于C的性质的叙述错误的是( )
A.易溶于水
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.属于碱
10.下列装置或操作能达到实验目的的是( )
A.实验室制取并收集NH3 B.干燥Cl2
C.检查装置气密性 D.利用排空气法收集CO2
11.下列制备和收集气体的实验装置合理的是( )
A.用氯化铵和氢氧化钙制NH3 B.用铜片和稀硝酸制NO
C.用锌粒和稀硫酸制H2 D.用双氧水和二氧化锰制O2
12.下列实验的试剂、装置选用不合理的是( )
甲 乙
丙
选项
实验目的
试剂
装置
A
除去Cl2中少量的HCl、H2O
试剂a为饱和氯化钠溶液
甲
B
除去H2中少量CO2、H2O
试剂b为碱石灰
乙
C
除去NH3中少量H2O
试剂b为无水氯化钙
乙
D
除去N2中少量的O2
足量的铜网
丙
13.下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号
X
Y
Z
W
①
S
Na2SO3
H2SO3
SO2
②
Na
NaOH
Na2CO3
NaCl
③
Cl2
Ca(ClO)2
HClO
HCl
④
Fe
FeCl3
FeCl2
Fe(OH)2
A.①②③
B.①③④
C.②③
D.②③④
14.已知A为常见的金属单质,根据如图所示的关系,下列叙述中正确的是( )
A.A为Fe,B为FeO
B.C→D溶液的颜色变化:浅绿色→棕黄色
C.④的离子方程式:Fe+Fe3+===2Fe2+
D.⑤的离子方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
15.在如图所示的转化关系中,已知B、D都是淡黄色固体,D与G的浓溶液在一定条件下反应生成E。
回答下列问题:
(1)写出下列物质的化学式:
A________、F________、H________。
(2)D与热的C溶液反应时氧化产物与还原产物的物质的量之比为1∶2,试写出该反应的离子方程式:________________________。
(3)写出D与G的浓溶液反应生成E的化学方程式:
______________________________________________________________。
16.如图表示某些物质之间的转化关系,每个字母代表一种物质,部分产物已略去。A是一种酸式盐,也是一种常用的化学肥料,B是能使湿润的红色石蕊试纸变蓝色的无色气体,D是无色无味气体。
回答下列问题:
(1)物质A的名称是________。
(2)写出物质B的一种主要用途_______________________________。
(3)写出实验室制取气体B的化学方程式:______________________;
写出工业上制取气体B的化学方程式:__________________________。
(4)写出下列反应的化学方程式:
B―→E:__________________________________________________;
F―→G:__________________________________________________。
17.工业上,向500~600
℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。
A B C D
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为___________________________________________________________________。
装置B中加入的试剂是________。
(2)制取无水氯化亚铁的实验中,装置A用来制取________。尾气的成分是________。若仍用D的装置进行尾气处理,存在的问题是________________________、________________________。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是________。欲制得纯净的FeCl2,在实验操作中应先________________,再_____________________________。
18.实验室常见的几种气体发生装置如图A、B、C所示:
A B C D
图1
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是_____________;检查C装置气密性的操作方法是______________________________________________。
(2)气体的性质是选择气体收集方法的主要依据。下列气体的性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤是否与氧气反应
(3)下图是某学生设计收集气体的几种装置,其中不可行的是________。
A B
C D
图2
(4)若用图1中的A装置与D装置相连制取收集X气体,则X可能是下列气体中的________;
①CO2 ②NO ③Cl2 ④H2
其中在D装置中连接小烧杯的目的是_______________。
参考答案附解析
【对点练习】
1.
D [A项,若X为N2或NH3,Y为NO,Z为NO2,则A为硝酸,正确;B项,若X为S或H2S,Y为SO2,Z为SO3,则A为硫酸,正确;C项,若X为非金属单质或非金属氢化物,A为硝酸或硫酸时,稀硝酸与Cu反应生成Y,浓硝酸和Cu反应不生成Y,且Cu与稀硫酸不反应,则A不一定能与金属铜反应生成Y,正确;D项,反应①和②一定为氧化还原反应,反应③若为二氧化氮和水的反应也为氧化还原反应,错误。]
2.
[解析] Ⅰ.A、B、C、D的焰色试验都呈黄色,均含有Na元素,其中A为单质,则A为Na,钠与水反应生成NaOH与氢气,可推知E为H2,B为NaOH,X是常见的无色无味气体,能与NaOH连续反应,可知X为CO2,C为Na2CO3,D为NaHCO3。
Ⅱ.A、B、C、D为四种常见物质。A是金属单质,且A的合金用量最大,则A为铁。铁与氯气反应生成氯化铁,C为FeCl3,铁与盐酸反应生成氯化亚铁,B为FeCl2,D与一氧化碳反应生成铁,则D可能为铁的某种氧化物。
[答案] Ⅰ.(1)Na (2)Na2CO3+H2O+CO2===2NaHCO3
Ⅱ.(1)红 (2)2Fe3++Fe===3Fe2+
3.
[提示] Z是NO,E是NO2,F是HNO3,Y可能是N2或NH3。如Y是N2则可通过反应8NH3+3Cl2===N2+6NH4Cl转化为N2,所以X可能是氢化物NH3;如Y是NH3则可通过反应Ca(OH)2+2NH4Cl2NH3↑+CaCl2+2H2O转化为NH3,此反应为非氧化还原反应。
4.
(1)
[提示] 不一定,B也可能是H2O。
(2)
[提示] C为NH3,可由OH-和NH反应生成:
NH+OH-NH3↑+H2O。
5.
A [用过氧化钠和过氧化氢制备氧气时,均可采用固液不加热的制气体装置,A项正确;氯气溶于水生成盐酸和次氯酸,盐酸与碳酸氢钠溶液反应生成CO2,B项错误;一氧化碳密度与空气密度接近,不能用排空气法收集,C项错误;不能用水吸收制取二氧化氮的尾气,因为二氧化氮与水生成硝酸和一氧化氮,一氧化氮不溶于水造成污染,D项错误。]
6.
A [A、B、C、D项中产生的气体依次分别为H2、NH3、SO2、NO;B项NH3不能用浓硫酸干燥;C项浓硫酸与Cu反应需要加热;D项中产生的NO与O2反应,测得V(NO)不准确。]
【课堂练习】
1.C [由于ρCl2>ρ空气,故采用向上排空气法收集Cl2,即导气管在试管中“长进短出”,排除A、B两项;用NaOH溶液吸收Cl2,为防止倒吸应使用倒扣漏斗,排除D项。]
2.C [由盐酸和大理石制得的CO2气体中会含有杂质H2O(g)和HCl,除杂的试剂分别为浓硫酸和饱和碳酸氢钠溶液,应先让气体通过饱和NaHCO3溶液除去HCl,再通过浓硫酸干燥。收集CO2时应用向上排空气法,所以正确答案为C选项。]
3.
C [①CCOCO2H2CO3,符合转化关系;
②N2NONO2HNO3,符合转化关系;
③SSO2SO3H2SO4,符合转化关系;因此符合转化关系的为①②③,C正确。]
4.
B [已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑,可知X为浓硫酸。浓硫酸能使蔗糖脱水炭化,故A不符合题意;若A为铜,铜和浓硫酸反应生成硫酸铜、SO2和H2O,X体现氧化性和酸性,故B符合题意;若A为碳单质,则C为二氧化碳,钠燃烧生成Na2O2,CO2和Na2O2反应放出O2,故CO2不宜用来扑灭由钠引起的着火,故C不符合题意;B为二氧化硫气体,有漂白性,通入品红溶液中,品红溶液褪色,故D不符合题意。]
5.
[解析] (1)由题知,该反应制取气体的类型为固体+液体―→气体;反应不需加热,故应选择B装置。
(2)氯气中可能混有HCl、H2O(g),HCl用饱和NaCl溶液除去,H2O(g)用浓硫酸除去,要得到纯净、干燥的氯气,应先除去HCl,再除去H2O(g)。
(3)氯气的颜色为黄绿色,烧杯中所盛液体为NaOH溶液,其作用是吸收多余的氯气。
[答案] (1)B (2)D (3)黄绿 NaOH溶液 吸收多余的氯气
【习题练习】
1.
A [KMnO4、MnO2都是氧化剂,都能与浓盐酸反应制取Cl2,A正确。Cl2是酸性气体,能溶于水,不能用碱石灰干燥,也不能用排水法收集,B、C错。Ca(OH)2微溶于水,饱和石灰水中溶有的Ca(OH)2太少,吸收尾气不彻底,D错。]
2.D [A和B选项中的两组气体常温下会发生反应,不能共存;C选项中的H2用向下排空气法收集,而CO一般用排水法收集;D选项中的SO2和CO2常温下不发生反应,而且两者的密度均比空气大,都可以用向上排空气法收集。]
3.B [B中装置易形成倒吸,不适宜NH3气体的尾气处理。]
4.
A [铜屑和浓硝酸反应生成NO2气体,可用图示的浓硫酸干燥,又因NO2密度比空气大且不与空气反应,可用图示的向上排空气法收集,A项正确;二氧化锰和浓盐酸反应制Cl2需加热,B项错误;硫化亚铁和稀盐酸制得的H2S易被浓硫酸氧化,C项错误;铜和稀硝酸反应生成的NO能与空气中的O2反应,不能利用图示的排空气法收集,D项错误。]
5.
B [能用启普发生器制取的气体应满足的条件:块状固体和液体进行反应,生成的气体难溶于反应液,反应不需要加热(反应过程中不能有太大热量变化,生成物除气体外应易溶于水)。大理石和稀硫酸反应生成的硫酸钙微溶于水,附着在大理石的表面阻止反应的进行,A项不合题意;浓盐酸与二氧化锰反应需要加热,且MnO2为粉末状固体,C项不合题意;固体NH4Cl和消石灰制取氨气需要加热,且氨气易溶于水,D项不合题意。]
6.
C [反应③:3NO2+H2O===2HNO3+NO,NO2既是氧化剂又是还原剂。]
7.
A [甲、乙、丙、丁分别为H2S、SO2、SO3、S。H2S中-2价的S只有还原性,但其中的H为+1价,具有氧化性,如H2S与活泼金属反应可表现出氧化性(即酸性),A项错误;SO2与SO3均能与碱和碱性氧化物反应生成盐,均为酸性氧化物,B项正确;SO2中的S为+4价,处于S的中间价态,C项正确;单质S为黄色或淡黄色固体,D项正确。]
8.BC [若甲是C,则乙可能是O2,丙是CO,丁是CO2,A正确;若甲是Fe,乙是Cl2,则丙是氯化铁,氯化铁和氯气不反应,B错误;若甲是NaOH溶液,则乙可能是SO2,丙是亚硫酸钠,丁是亚硫酸氢钠,C错误;若甲是H2S,则乙可能是O2,丙是S,丁是SO2,D正确。]
9.
D [根据已知信息,可以推断出A为Na,B为Na2O2,C为Na2CO3,D为NaOH。Na2CO3属于盐,D项错误。]
10.C [A中,由于氨气的密度小于空气的密度,用向下排空气法收集是正确的,但集气瓶瓶口不能密封(塞橡皮塞),可塞一团疏松的棉花,目的是防止气体对流,以收集到较纯的氨气;B中,洗气时气体应长进短出;C中,通过观察长颈漏斗中液面是否下降,可以检查装置的气密性;D中,收集密度比空气重的二氧化碳气体用向上排空气法,应该为长管进气,短管排出空气。]
11.D [A中大试管的管口应略向下倾斜;B中NO很容易被空气中的氧气氧化,所以采用B装置得不到NO;C中氢气的密度比空气小,所以集气瓶中的进气导管应比出气导管要短,C错误;D装置合理。]
12.
C [A选项正确,甲装置中饱和氯化钠溶液可除去HCl,浓硫酸可除去H2O;B选项正确,干燥管中碱石灰的成分为生石灰与氢氧化钠,可除去CO2和H2O;C选项错误,干燥管中的无水氯化钙在除去水的同时也会吸收NH3生成络合物;D选项正确,丙装置中的铜网可除去O2。]
13.
A [①S溶于NaOH溶液加热可得Na2SO3,Na2SO3溶液中滴加稀盐酸可得H2SO3,H2SO3受热分解生成SO2,SO2再与H2S反应可得S,故正确;②钠与水反应生成NaOH,NaOH与H2CO3反应生成Na2CO3,Na2CO3与稀盐酸反应生成NaCl,NaCl熔融电解生成钠,故正确;③Cl2与石灰乳反应生成Ca(ClO)2,Ca(ClO)2与稀盐酸反应生成HClO,HClO光照分解生成HCl,HCl电解生成Cl2,故正确;④Fe与Cl2反应可生成FeCl3,FeCl3与Fe反应得FeCl2,FeCl2与NaOH反应生成Fe(OH)2,Fe(OH)2一步转化得不到Fe,故错误。故选A。]
14.B [由“红褐色固体”可知F是Fe(OH)3,从而得出A为Fe,“黑色晶体”B为Fe3O4,继而推出C为FeCl2,D为FeCl3,E为Fe(OH)2。⑤的离子方程式为Fe+2Fe3+===3Fe2+,④的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。]
15.
[解析] (1)B、D都是淡黄色固体,在中学阶段,常见的淡黄色固体有S、Na2O2、AgBr,而由图中“AO2,BH2O,O2”推断,可知A为Na,B为Na2O2,C为NaOH,D为S,E、F分别是SO2、SO3,G、H分别为H2SO4、Na2SO4。
(2)S与热的NaOH溶液反应时氧化产物与还原产物的物质的量之比为1∶2,由化合价升降总数相等,则氧化产物应该为Na2SO3,还原产物为Na2S,据此写出反应的离子方程式。
(3)S与浓硫酸加热时反应生成SO2,化学方程式为S+2H2SO4(浓)
3SO2↑+2H2O。
[答案] (1)Na SO3 Na2SO4
(2)3S+6OH-===2S2-+SO+3H2O
(3)S+2H2SO4(浓)
3SO2↑+2H2O
16.
[解析] A与NaOH固体加热反应生成能使湿润的红色石蕊试纸变蓝色的无色气体B,则B是NH3,A是铵盐。D是无色无味气体,由B+D―→E,E+D―→F可推测D为O2,则E为NO,F为NO2,NO2与H2O反应生成HNO3(G),在加热条件下HNO3与木炭反应生成NO2和CO2,即C为CO2,A为NH4HCO3。
[答案] (1)碳酸氢铵 (2)制氮肥(或制硝酸或做制冷剂,合理即可)
(3)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(4)4NH3+5O24NO+6H2O 3NO2+H2O===2HNO3+NO
17.
[解析] (1)制取无水氯化铁的实验中,A装置为氯气的制备装置,发生的反应为二氧化锰和浓盐酸共热生成二氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,装置B的作用是除去氯气中的水蒸气,B中加入的试剂是浓硫酸。(2)根据题给信息知制取无水氯化亚铁的实验中,装置A用来制取HCl;尾气的成分是HCl和H2;若仍用D的装置进行尾气处理,氯化氢气体极易溶于水,氢气与氢氧化钠溶液不反应,则存在的问题是发生倒吸、可燃性气体H2不能被吸收。(3)检验FeCl3常用的试剂是KSCN溶液;欲制得纯净的FeCl2,应防止装置中氧气的干扰,在实验操作中应先通入氯化氢,利用产生的氯化氢气体排出装置中的空气,再点燃C处的酒精灯。
[答案] (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 浓硫酸
(2)HCl HCl和H2 易发生倒吸 可燃性气体H2不能被吸收
(3)KSCN溶液 通入氯化氢(赶尽装置中的空气) 点燃C处的酒精灯
18.
[答案] (1)浓氨水和氧化钙(或碱石灰、固体氢氧化钠等) 连接一根导管,将导管通入水槽中,关闭分液漏斗的活塞,用手捂或酒精灯微热圆底烧瓶底部,如果导管口处有气泡产生,松开手或停止加热后,在导管里形成一段水柱,说明C装置气密性良好
(2)②④ (3)BC (4)③ 吸收尾气,防止污染空气
