黑龙江省虎林市高级中学化学课件1.1 化学实验基本方法
文档属性
| 名称 | 黑龙江省虎林市高级中学化学课件1.1 化学实验基本方法 |

|
|
| 格式 | zip | ||
| 文件大小 | 982.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-29 21:32:00 | ||
图片预览









文档简介
(共45张PPT)
第一节 化学实验基本方法
高考第一轮总复习
第一章 从实验学化学
一、化学实验基本操作
1.药品的取用
取用药品 固体药品 液体药品
粉末 块状 一定量 少量 大量 定量
使用仪器
操作方法
钥匙或纸槽
镊子
天平
胶头滴管
量筒、滴定管
一横二送三慢竖
一横二放三慢竖
左物右码
垂直于试管正上方
标签朝手心
一、化学实验基本操作
2.仪器的洗涤
(1)方法: (2)标准
使用毛刷,用去污剂和水冲洗
内壁均匀地附着一层水膜,既不聚成水滴,也不成股流下
(3)常见污染物洗涤
①容器内壁附有油污,可用______________________洗刷
②容器内壁附有“银镜”或“铜镜”,可注入__________经
微热使银或铜溶解
热纯碱溶液或NaOH溶液
稀硝酸
③容器内壁附着MnO2,可用__________。
浓盐酸
一、化学实验基本操作
2.仪器的洗涤
④容器内壁附着难溶碳酸盐或氢氧化物(如CaCO3 Fe(OH)3),可
注入少量__________反应使其溶解
稀盐酸
⑤硫磺可用氢氧化钠或__________洗涤使其溶解
⑥碘用__________洗涤
CS2
酒精
3.药品的保存
瓶口
广口瓶
细口瓶
固体
液体
瓶塞
一、化学实验基本操作
3.药品的保存
玻璃塞
橡胶塞
不能保存碱性试剂
比如NaOH、Na2SiO3 Na2CO3等碱性物质
不能保存酸性及强氧化性、有机物试剂
比如盐酸、高锰酸钾 溴水、汽油等物质
瓶色
无色
棕色
大部分见光不易分解的物质
见光易分解的物质
比如HNO3、Cl2(H2O)、Br2(H2O)、AgNO3、AgBr、AgI.
一、化学实验基本操作
3.药品的保存
特殊保存方式
Na、Ka
Li
白磷
HF
保存煤油中,不能保存在四氯化碳中
石蜡
冷水
塑料试剂瓶
解析
解析
一、化学实验基本操作
4. 试纸的使用
(1)试纸的种类
石蕊试纸(红、蓝)
PH试纸
品红试纸
KI淀粉试纸
定性检验溶液酸碱性
定量检验溶液酸碱性
检验二氧化硫等有漂白作用的气体
检验氯气
一、化学实验基本操作
4. 试纸的使用
(2)使用方法
★检验溶液:
取一小块试纸放在表面皿或玻璃瓶上,用玻璃棒蘸取待测液点在试纸上,观察颜色变化。PH试纸变色后要和标准比色卡对照。
★检验气体:
用蒸馏水把试纸润湿再黏贴在玻璃棒的一端,置于待测气体的出口处,观察颜色变化。
(3)注意
试纸不能深入溶液以下,也不能与管口接触;PH试纸不能润湿
一、化学实验基本操作
5. 气密性检查
一、化学实验基本操作
6. 物质加热
常见给物质加热的方式有三种,分别是(1) ;(2)隔 加热;(3) 加热.
思考:水浴加热的优点是什么?
直接加热
石棉网
水浴
答案:(1)便于控制反应的温度.
(2)使反应混合物受热均匀.
(3)温度高于100℃时,可用油代替水
1.(2009·广东化学,3)下列有关实验操作的说法正确的是 ( ) A.可用25 mL碱式滴定管量取20.00 mL KMnO4溶液 B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干 D.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
C
2.(2010·石家庄质检一)下列所示的实验装置中,能达到实验目的的是( )
C
二、常见仪器的使用
类别 仪器名称 识别 主要用途 使用注意事项
直接
加热 试管 少量物质反应器,简易气体发生器
蒸发皿 浓缩溶液,蒸干固体
坩埚 灼烧少量固体
1.可以加热仪器
加热液体不超过容积的1/3,试管夹夹持在离管口1/3处,固体加热试管口略向下倾斜
加热液体不超过2/3,
快干时停止加热,
取放时用坩埚钳
与泥三角配套使用,冷却时放在干燥器内干燥
类别 仪器名称 识别 主要用途 使用注意事项
隔石棉网加热 烧杯 配制、稀释溶液,作反应器、给试管水浴加热
烧瓶
圆底烧瓶 固—液或液—液反应器(蒸馏烧瓶用于蒸馏分离互溶的沸点不同的物质)
平底烧瓶
蒸馏烧瓶
二、常见仪器的使用
1.可以加热仪器
加热液体以容
积的1/2为宜
①圆底烧瓶和蒸馏烧瓶可用于加热,加热时要垫石棉网,也可用于其他热浴(如水浴加热等)。
②液体加入量不要超过烧瓶容积的2/3。
类别 仪器名称 识别 主要用途 使用注意事项
隔石棉
网加热 锥形瓶 常用于中和滴定,也可作反应器 振荡时向同一方向旋转
不直接加热 集气瓶 用于收集和贮存少量气体 所用玻璃片涂凡士林(防漏气),如进行燃烧反应且有固体生成时,底部加少量水或细沙
二、常见仪器的使用
1.可以加热仪器
二、常见仪器的使用
2.计量仪器
仪器名称 识别 主要用途 使用注意事项
量筒
容量瓶
滴定管
粗略量取一定体积液体
用于配制一定物质的量浓度的溶液
用于中和滴定,准确量取液体的体积
不作反应器,无0刻度线,读数平视刻度线。精确度为0.1ml
用前检查是否漏水,定容时平视刻度线
使用前检查是否漏水,
0刻度在上方,要用待
装液润洗。不能混用,
强氧化性的用酸性,
精确度为0.01ml
二、常见仪器的使用
2.计量仪器
仪器名称 识别 主要用途 使用注意事项
温度计 分馏时量馏分的沸点;量反应物温度;量水浴温度
托盘天平 称量固体物质
不可当搅拌器用,
根据用途将水银
球插在不同部位
用前调平,药品不能直接放托盘上,左物右码,
先大后小,精确到0.1g
二、常见仪器的使用
3.分离仪器
类别 仪器名称 识别 主要用途 使用注意事项
分离仪器
分液漏斗
(短颈)漏斗
长颈漏斗
用于分离互不相溶液体,气体发生装置,以随时加液体
用于过滤或向
小口容器注入
液体
向反应器中
直接加液体
用前查漏,放
液时要打开上
盖,上层液体
由上口倒出
滤纸边缘低
于漏斗边缘
适合液—液反应,下端必须插入液体中
二、常见仪器的使用
3.分离仪器
1.下列选用的相关仪器符合实验要求的是( )
A B C D
存放浓硝酸 分离水和
乙酸乙酯 准确量取
9.50 mL水 实验室
制取乙烯
A B C D
存放浓硝酸 分离水和
乙酸乙酯 准确量取
9.50 mL水 实验室
制取乙烯
B
2.指出下面3个实验中各存在的一个错误:
A ____________________________________,
B_____________________________________ ,
C __________________________________
将胶头滴管伸入试管内
试管口向上倾斜
进气管和出气管反了(混合气体从短管进入洗气瓶)
4.
g
c
bcef
dgh
解析
【知识归纳】仪器使用过程中应注意的几个问题
(1)几个“零”
①滴定管的“零”刻度在滴定管的上部(但不在最上部),量取液体的体积时液面不一定要在“零”刻度,但要在“零”刻度或“零”刻度以下。
②量筒没有“零”刻度,容量瓶没有“零”刻度。
③托盘天平的“零”刻度在标尺的最左边,天平在使用时先调“零”,使用后要回“零”。
④实验记录中一切非“零”数字都是有效数字。
⑤温度计的零刻度在温度计的中下部。
(2)几个“数据”
①托盘天平的精确度为0.1 g。
②滴定管的精确度为0.01 mL。
③量程为5 mL、10 mL的量筒的精确度一般为0.1 mL。
④酒精灯内酒精的量不能少于容积的1/4,也不能多于2/3。
⑤试管在加热液体时所加液体不能超过试管容积的1/3,且要与桌面成45°角;用试管夹夹试管时,应夹在离管口约1/3处。
⑥烧杯、烧瓶加热时盛液体量均在容积的1/3~2/3,蒸发皿加热时盛液量不宜超过容积的2/3。
(3)使用前需检验是否漏液的仪器
①容量瓶:检查口部塞子是否漏液。
方法:加入水塞上塞子,用食指摁住瓶塞,另一只手托住瓶底把瓶倒立观察,然后将容量瓶正立,再将塞子旋转180°,再倒立观察。
②分液漏斗和滴定管:要检查活塞处是否漏液,若在分液漏斗中萃取溶液,还要检验口部的塞子是否漏液。
(4)
三、有关实验安全问题
腐蚀品
剧毒品
爆炸品
易燃品
2.实验事故七防
(1)防爆炸
点燃可燃气体(如H2、CO、CH4、C2H2、C2H4)
或用CO、H2还原Fe2O3、CuO之前,要检验气体纯度;
三、有关实验安全问题
2.实验事故七防
(2)防爆沸
配制硫酸的水溶液时,要将密度大的浓硫酸缓慢倒入
水中;加热液体混合物时要加沸石
(3)防失火
实验室中的可燃物质一定要远离火源
(4)防中毒
制取有毒气体(如:Cl2、CO、SO2、H2S、NO2、NO)时
,应在通风橱中进行;且要进行尾气处理。
三、有关实验安全问题
2.实验事故七防
(5)防倒吸
加热法制取并用排水法收集气体,要注意先撤导管
后熄灯或加装安全瓶;或吸收溶解度较大气
体时要防倒吸装置。
三、有关实验安全问题
2.实验事故七防
(6)防污染
(7)防堵塞
三、有关实验安全问题
3.实验意外事故处理
意外事故 处理方法
酸洒在皮肤上
碱洒在皮肤上
液溴、苯酚洒
在皮肤上
水银洒在桌面上
酸液溅到眼中
酒精等有机物
在实验台上着火
立即用较多的水冲洗(皮肤上不慎洒上
浓H2SO4,不得先用水冲洗而要根据
情况迅速用布擦去,再用水冲洗),再涂
上3%~5%的NaHCO3溶液
用较多的水冲洗,再涂上硼酸溶液
用酒精擦洗
进行回收后再撒上硫粉
立即用大量水冲洗,边洗边眨眼睛
用湿抹布、石棉或沙子盖灭,火势较
大时,可用灭火器扑救
(2009·广东理基,21)下列实验能达到实验目的的且符合安全要求的是( )
B
四、物质的分离和提纯
方法 装置 适用范围 应用实例 注意事项
过滤
蒸发
沉淀和
溶液
从溶液中
得到溶质
净化
食盐
水
从食盐
的水
溶液
中提
取食
盐晶
体
①要注意一贴二
低三靠;
②必要时要
(在过滤器中)
洗涤沉淀物
①蒸发过程要用玻璃棒不断搅拌,防止局部过热造成液体飞溅②,有大量晶体析出时停止加热,用余热蒸干
四、物质的分离和提纯
方法 装置 适用范围 应用实例 注意事项
蒸馏
利用互溶液体
中各成分沸点
的不同进行
分离
制取
蒸馏
水
①蒸馏烧瓶中放
少量碎瓷片,防
止暴沸;②温度
计水银球的位置
应在蒸馏烧瓶支
管口处;③蒸馏
烧瓶中所盛放液
体不能超过其容
积的2/3,也不能
少于1/3;④冷凝
管中冷却水下进
上出
四、物质的分离和提纯
方法 装置 适用范围 应用实例 注意事项
萃取
分液
利用溶质在互
不相溶的溶剂
里溶解性的不
同,用一种溶
剂把溶质从它
与另一种溶剂
所组成的溶液
中提取出来的
方法
用有机溶剂(如四氯化碳)从碘水中萃取碘
①萃取剂和溶剂互
不相溶、不反应;
②溶质在萃取剂
中溶解度较大,
且不反应;
把两种互不相
溶,密度也
不相同的液
体分离开的方法
把CCl4和
NaCl溶液
分开
③分液体时打开上
口活塞下层液体从
下口流出,上层液
体从上口倒出;
方法 装置 适用范围 应用实例 注意事项
渗析 用半透膜将离子或小分子从胶体中分离出来 把NaCl从淀粉胶体中分离出来 需多次渗析才能得到纯净的胶体
盐析 加入无机盐,使某些物质的溶解度降低,从而形成沉淀 从肥皂液中分离出高级脂肪酸钠 蛋白质盐析的条件:浓的铵盐或轻金属盐
洗气 气态混合物中的某种组分易溶于某种液体 除去CO2气体中的HCl气体 ①注意防止倒吸②长管进,短管出
四、物质的分离和提纯
1. (2009·广东理基,24)下列除去杂质的方法正确的是( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤 洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤 洗涤
C
2.如下表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是( )
不纯物质 除杂试剂 分离方法
A 蛋白质溶液(NaCl) 蒸馏水 渗析
B NH4Cl溶液(AlCl3) NaOH溶液 过滤
C 乙酸乙酯(乙酸) KOH水溶液 分液
D 苯(苯酚) 浓溴水 过滤
A
3.海带中含有丰富的碘 为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是____(从下列仪器中选出所需的仪器,用标号字母填写在空白处) A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
BDE
3.海带中含有丰富的碘 为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
2)步骤③的实验操作名称是______;步骤⑥的目的是从含碘苯
溶液中分离出单质碘和回收苯,该步骤的实验操作名称是____
过滤
蒸馏
第一节 化学实验基本方法
高考第一轮总复习
第一章 从实验学化学
一、化学实验基本操作
1.药品的取用
取用药品 固体药品 液体药品
粉末 块状 一定量 少量 大量 定量
使用仪器
操作方法
钥匙或纸槽
镊子
天平
胶头滴管
量筒、滴定管
一横二送三慢竖
一横二放三慢竖
左物右码
垂直于试管正上方
标签朝手心
一、化学实验基本操作
2.仪器的洗涤
(1)方法: (2)标准
使用毛刷,用去污剂和水冲洗
内壁均匀地附着一层水膜,既不聚成水滴,也不成股流下
(3)常见污染物洗涤
①容器内壁附有油污,可用______________________洗刷
②容器内壁附有“银镜”或“铜镜”,可注入__________经
微热使银或铜溶解
热纯碱溶液或NaOH溶液
稀硝酸
③容器内壁附着MnO2,可用__________。
浓盐酸
一、化学实验基本操作
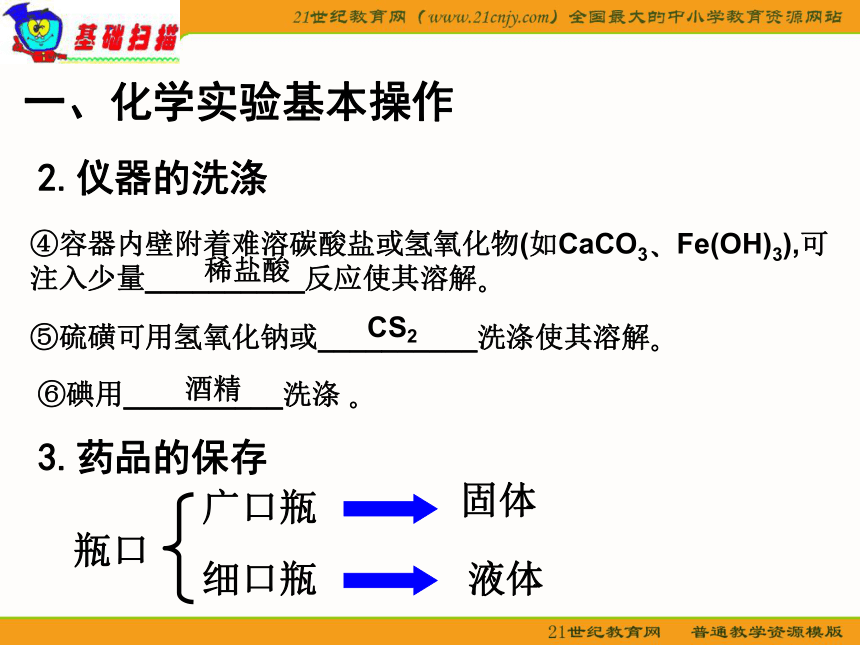
2.仪器的洗涤
④容器内壁附着难溶碳酸盐或氢氧化物(如CaCO3 Fe(OH)3),可
注入少量__________反应使其溶解
稀盐酸
⑤硫磺可用氢氧化钠或__________洗涤使其溶解
⑥碘用__________洗涤
CS2
酒精
3.药品的保存
瓶口
广口瓶
细口瓶
固体
液体
瓶塞
一、化学实验基本操作
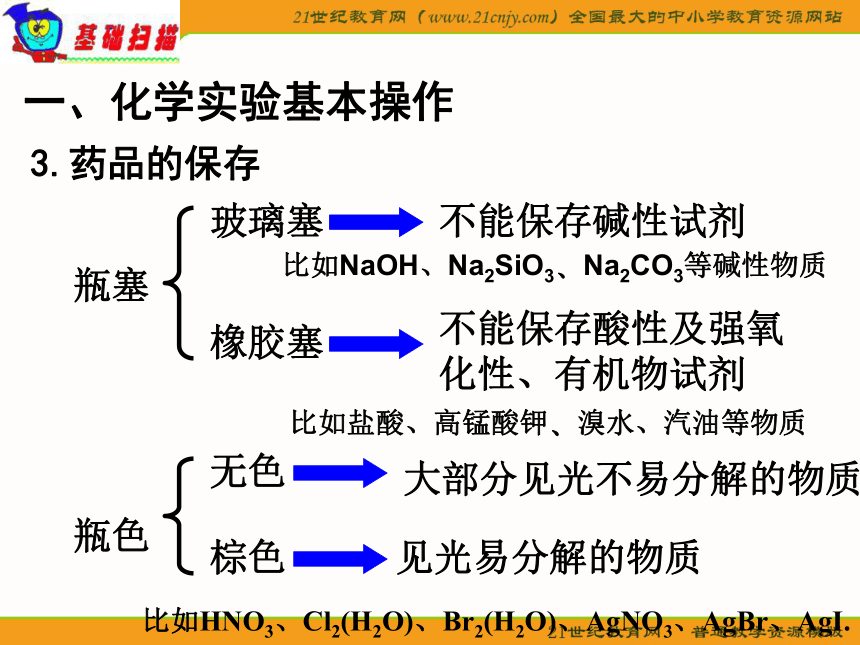
3.药品的保存
玻璃塞
橡胶塞
不能保存碱性试剂
比如NaOH、Na2SiO3 Na2CO3等碱性物质
不能保存酸性及强氧化性、有机物试剂
比如盐酸、高锰酸钾 溴水、汽油等物质
瓶色
无色
棕色
大部分见光不易分解的物质
见光易分解的物质
比如HNO3、Cl2(H2O)、Br2(H2O)、AgNO3、AgBr、AgI.
一、化学实验基本操作
3.药品的保存
特殊保存方式
Na、Ka
Li
白磷
HF
保存煤油中,不能保存在四氯化碳中
石蜡
冷水
塑料试剂瓶
解析
解析
一、化学实验基本操作
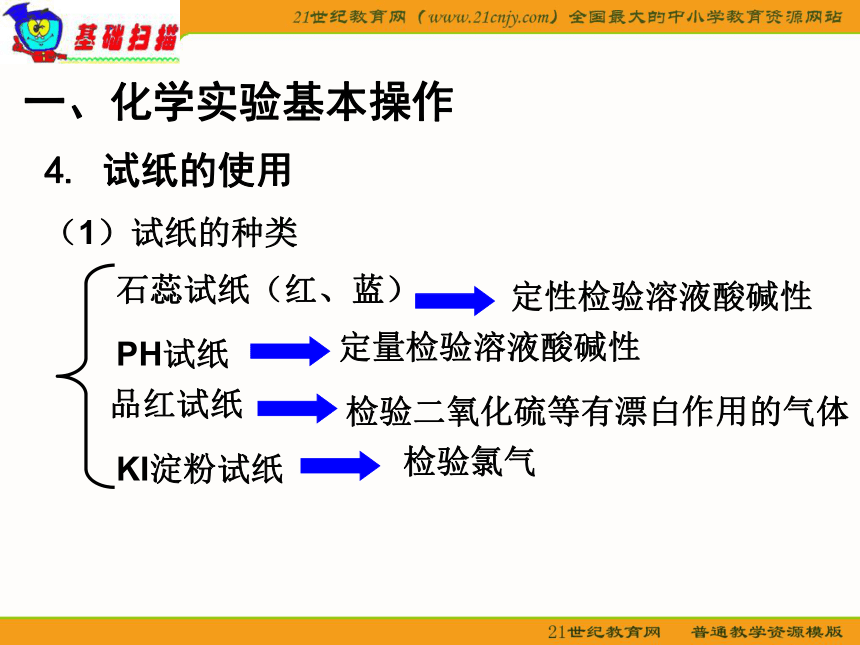
4. 试纸的使用
(1)试纸的种类
石蕊试纸(红、蓝)
PH试纸
品红试纸
KI淀粉试纸
定性检验溶液酸碱性
定量检验溶液酸碱性
检验二氧化硫等有漂白作用的气体
检验氯气
一、化学实验基本操作
4. 试纸的使用
(2)使用方法
★检验溶液:
取一小块试纸放在表面皿或玻璃瓶上,用玻璃棒蘸取待测液点在试纸上,观察颜色变化。PH试纸变色后要和标准比色卡对照。
★检验气体:
用蒸馏水把试纸润湿再黏贴在玻璃棒的一端,置于待测气体的出口处,观察颜色变化。
(3)注意
试纸不能深入溶液以下,也不能与管口接触;PH试纸不能润湿
一、化学实验基本操作
5. 气密性检查
一、化学实验基本操作
6. 物质加热
常见给物质加热的方式有三种,分别是(1) ;(2)隔 加热;(3) 加热.
思考:水浴加热的优点是什么?
直接加热
石棉网
水浴
答案:(1)便于控制反应的温度.
(2)使反应混合物受热均匀.
(3)温度高于100℃时,可用油代替水
1.(2009·广东化学,3)下列有关实验操作的说法正确的是 ( ) A.可用25 mL碱式滴定管量取20.00 mL KMnO4溶液 B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干 D.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
C
2.(2010·石家庄质检一)下列所示的实验装置中,能达到实验目的的是( )
C
二、常见仪器的使用
类别 仪器名称 识别 主要用途 使用注意事项
直接
加热 试管 少量物质反应器,简易气体发生器
蒸发皿 浓缩溶液,蒸干固体
坩埚 灼烧少量固体
1.可以加热仪器
加热液体不超过容积的1/3,试管夹夹持在离管口1/3处,固体加热试管口略向下倾斜
加热液体不超过2/3,
快干时停止加热,
取放时用坩埚钳
与泥三角配套使用,冷却时放在干燥器内干燥
类别 仪器名称 识别 主要用途 使用注意事项
隔石棉网加热 烧杯 配制、稀释溶液,作反应器、给试管水浴加热
烧瓶
圆底烧瓶 固—液或液—液反应器(蒸馏烧瓶用于蒸馏分离互溶的沸点不同的物质)
平底烧瓶
蒸馏烧瓶
二、常见仪器的使用
1.可以加热仪器
加热液体以容
积的1/2为宜
①圆底烧瓶和蒸馏烧瓶可用于加热,加热时要垫石棉网,也可用于其他热浴(如水浴加热等)。
②液体加入量不要超过烧瓶容积的2/3。
类别 仪器名称 识别 主要用途 使用注意事项
隔石棉
网加热 锥形瓶 常用于中和滴定,也可作反应器 振荡时向同一方向旋转
不直接加热 集气瓶 用于收集和贮存少量气体 所用玻璃片涂凡士林(防漏气),如进行燃烧反应且有固体生成时,底部加少量水或细沙
二、常见仪器的使用
1.可以加热仪器
二、常见仪器的使用
2.计量仪器
仪器名称 识别 主要用途 使用注意事项
量筒
容量瓶
滴定管
粗略量取一定体积液体
用于配制一定物质的量浓度的溶液
用于中和滴定,准确量取液体的体积
不作反应器,无0刻度线,读数平视刻度线。精确度为0.1ml
用前检查是否漏水,定容时平视刻度线
使用前检查是否漏水,
0刻度在上方,要用待
装液润洗。不能混用,
强氧化性的用酸性,
精确度为0.01ml
二、常见仪器的使用
2.计量仪器
仪器名称 识别 主要用途 使用注意事项
温度计 分馏时量馏分的沸点;量反应物温度;量水浴温度
托盘天平 称量固体物质
不可当搅拌器用,
根据用途将水银
球插在不同部位
用前调平,药品不能直接放托盘上,左物右码,
先大后小,精确到0.1g
二、常见仪器的使用
3.分离仪器
类别 仪器名称 识别 主要用途 使用注意事项
分离仪器
分液漏斗
(短颈)漏斗
长颈漏斗
用于分离互不相溶液体,气体发生装置,以随时加液体
用于过滤或向
小口容器注入
液体
向反应器中
直接加液体
用前查漏,放
液时要打开上
盖,上层液体
由上口倒出
滤纸边缘低
于漏斗边缘
适合液—液反应,下端必须插入液体中
二、常见仪器的使用
3.分离仪器
1.下列选用的相关仪器符合实验要求的是( )
A B C D
存放浓硝酸 分离水和
乙酸乙酯 准确量取
9.50 mL水 实验室
制取乙烯
A B C D
存放浓硝酸 分离水和
乙酸乙酯 准确量取
9.50 mL水 实验室
制取乙烯
B
2.指出下面3个实验中各存在的一个错误:
A ____________________________________,
B_____________________________________ ,
C __________________________________
将胶头滴管伸入试管内
试管口向上倾斜
进气管和出气管反了(混合气体从短管进入洗气瓶)
4.
g
c
bcef
dgh
解析
【知识归纳】仪器使用过程中应注意的几个问题
(1)几个“零”
①滴定管的“零”刻度在滴定管的上部(但不在最上部),量取液体的体积时液面不一定要在“零”刻度,但要在“零”刻度或“零”刻度以下。
②量筒没有“零”刻度,容量瓶没有“零”刻度。
③托盘天平的“零”刻度在标尺的最左边,天平在使用时先调“零”,使用后要回“零”。
④实验记录中一切非“零”数字都是有效数字。
⑤温度计的零刻度在温度计的中下部。
(2)几个“数据”
①托盘天平的精确度为0.1 g。
②滴定管的精确度为0.01 mL。
③量程为5 mL、10 mL的量筒的精确度一般为0.1 mL。
④酒精灯内酒精的量不能少于容积的1/4,也不能多于2/3。
⑤试管在加热液体时所加液体不能超过试管容积的1/3,且要与桌面成45°角;用试管夹夹试管时,应夹在离管口约1/3处。
⑥烧杯、烧瓶加热时盛液体量均在容积的1/3~2/3,蒸发皿加热时盛液量不宜超过容积的2/3。
(3)使用前需检验是否漏液的仪器
①容量瓶:检查口部塞子是否漏液。
方法:加入水塞上塞子,用食指摁住瓶塞,另一只手托住瓶底把瓶倒立观察,然后将容量瓶正立,再将塞子旋转180°,再倒立观察。
②分液漏斗和滴定管:要检查活塞处是否漏液,若在分液漏斗中萃取溶液,还要检验口部的塞子是否漏液。
(4)
三、有关实验安全问题
腐蚀品
剧毒品
爆炸品
易燃品
2.实验事故七防
(1)防爆炸
点燃可燃气体(如H2、CO、CH4、C2H2、C2H4)
或用CO、H2还原Fe2O3、CuO之前,要检验气体纯度;
三、有关实验安全问题
2.实验事故七防
(2)防爆沸
配制硫酸的水溶液时,要将密度大的浓硫酸缓慢倒入
水中;加热液体混合物时要加沸石
(3)防失火
实验室中的可燃物质一定要远离火源
(4)防中毒
制取有毒气体(如:Cl2、CO、SO2、H2S、NO2、NO)时
,应在通风橱中进行;且要进行尾气处理。
三、有关实验安全问题
2.实验事故七防
(5)防倒吸
加热法制取并用排水法收集气体,要注意先撤导管
后熄灯或加装安全瓶;或吸收溶解度较大气
体时要防倒吸装置。
三、有关实验安全问题
2.实验事故七防
(6)防污染
(7)防堵塞
三、有关实验安全问题
3.实验意外事故处理
意外事故 处理方法
酸洒在皮肤上
碱洒在皮肤上
液溴、苯酚洒
在皮肤上
水银洒在桌面上
酸液溅到眼中
酒精等有机物
在实验台上着火
立即用较多的水冲洗(皮肤上不慎洒上
浓H2SO4,不得先用水冲洗而要根据
情况迅速用布擦去,再用水冲洗),再涂
上3%~5%的NaHCO3溶液
用较多的水冲洗,再涂上硼酸溶液
用酒精擦洗
进行回收后再撒上硫粉
立即用大量水冲洗,边洗边眨眼睛
用湿抹布、石棉或沙子盖灭,火势较
大时,可用灭火器扑救
(2009·广东理基,21)下列实验能达到实验目的的且符合安全要求的是( )
B
四、物质的分离和提纯
方法 装置 适用范围 应用实例 注意事项
过滤
蒸发
沉淀和
溶液
从溶液中
得到溶质
净化
食盐
水
从食盐
的水
溶液
中提
取食
盐晶
体
①要注意一贴二
低三靠;
②必要时要
(在过滤器中)
洗涤沉淀物
①蒸发过程要用玻璃棒不断搅拌,防止局部过热造成液体飞溅②,有大量晶体析出时停止加热,用余热蒸干
四、物质的分离和提纯
方法 装置 适用范围 应用实例 注意事项
蒸馏
利用互溶液体
中各成分沸点
的不同进行
分离
制取
蒸馏
水
①蒸馏烧瓶中放
少量碎瓷片,防
止暴沸;②温度
计水银球的位置
应在蒸馏烧瓶支
管口处;③蒸馏
烧瓶中所盛放液
体不能超过其容
积的2/3,也不能
少于1/3;④冷凝
管中冷却水下进
上出
四、物质的分离和提纯
方法 装置 适用范围 应用实例 注意事项
萃取
分液
利用溶质在互
不相溶的溶剂
里溶解性的不
同,用一种溶
剂把溶质从它
与另一种溶剂
所组成的溶液
中提取出来的
方法
用有机溶剂(如四氯化碳)从碘水中萃取碘
①萃取剂和溶剂互
不相溶、不反应;
②溶质在萃取剂
中溶解度较大,
且不反应;
把两种互不相
溶,密度也
不相同的液
体分离开的方法
把CCl4和
NaCl溶液
分开
③分液体时打开上
口活塞下层液体从
下口流出,上层液
体从上口倒出;
方法 装置 适用范围 应用实例 注意事项
渗析 用半透膜将离子或小分子从胶体中分离出来 把NaCl从淀粉胶体中分离出来 需多次渗析才能得到纯净的胶体
盐析 加入无机盐,使某些物质的溶解度降低,从而形成沉淀 从肥皂液中分离出高级脂肪酸钠 蛋白质盐析的条件:浓的铵盐或轻金属盐
洗气 气态混合物中的某种组分易溶于某种液体 除去CO2气体中的HCl气体 ①注意防止倒吸②长管进,短管出
四、物质的分离和提纯
1. (2009·广东理基,24)下列除去杂质的方法正确的是( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤 洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤 洗涤
C
2.如下表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是( )
不纯物质 除杂试剂 分离方法
A 蛋白质溶液(NaCl) 蒸馏水 渗析
B NH4Cl溶液(AlCl3) NaOH溶液 过滤
C 乙酸乙酯(乙酸) KOH水溶液 分液
D 苯(苯酚) 浓溴水 过滤
A
3.海带中含有丰富的碘 为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是____(从下列仪器中选出所需的仪器,用标号字母填写在空白处) A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
BDE
3.海带中含有丰富的碘 为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
2)步骤③的实验操作名称是______;步骤⑥的目的是从含碘苯
溶液中分离出单质碘和回收苯,该步骤的实验操作名称是____
过滤
蒸馏
同课章节目录
