黑龙江省虎林市高级中学化学课件2.1 物质的分类
文档属性
| 名称 | 黑龙江省虎林市高级中学化学课件2.1 物质的分类 |

|
|
| 格式 | zip | ||
| 文件大小 | 154.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-29 00:00:00 | ||
图片预览







文档简介
(共23张PPT)
第一节 物质的分类
*
基础知识回顾
1.元素是具有相同核电荷数的一类原子的总称,构成物质的基本微粒有原子、离子、分子,在化学变化中最小的微粒是 ,保持物质化学性质的最小微粒是 。
2.混合物是由两种或两种以上的物质组成,纯净物是由一种物质组成,单质是指由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物。
原子
分子
*
3.对物质进行分类时必须明确分类的标准。根据化学键的类型不同,可把化合物分成离子化合物和共价化合物,根据能否发生电离,可将化合物分为 和 ,根据物质的组成和性质,可把化合物分成酸、
、 和氧化物。氧化物按照元素的组成可分成金属氧化物和非金属氧化物,按照化学性质可分成碱性氧化物、酸性氧化物、 。
等。
电解质
非电解质
碱
盐
两性
氧化物
*
4.化学变化的特征是有新物质生成,化学变化的本质是有化学键的断裂和形成,化学反应的类型按照反应物和生成物的形式可分为 、 、 和 。
,按照化合价有无变化可分为 。
和 ,按照参加反应的微粒可分为 和 ,按照反应的热量变化可分为 和放热反应。
化合反应
分解反应
置换反应
复
分解反应
氧化
还原反应
非氧化还原反应
离子反应
分子反应
吸热反应
*
重点知识归纳
1.物质的组成
从宏观与微观角度分析如下:
*
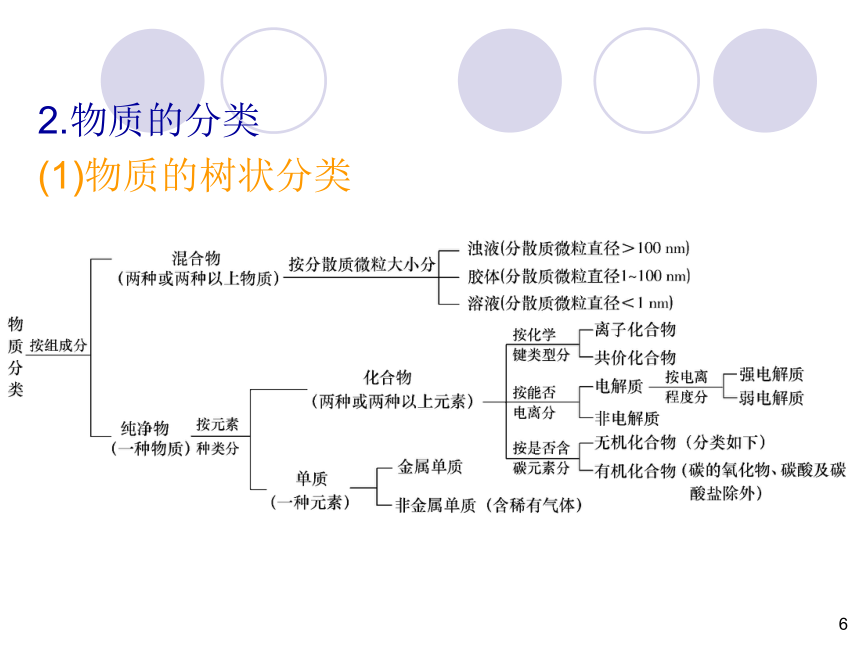
2.物质的分类
(1)物质的树状分类
*
按溶解性分:可溶性盐、微溶性盐、难溶性盐
按组成分:正盐、酸式盐、碱式盐、复盐
无机化合物
氧化物
按元素组成分:金属氧化物、非金属氧化物
按性质分:碱性氧化物、酸性氧化物、两性氧化物
酸
按酸根分:含氧酸、无氧酸
按一个酸分子最多能电离出的氢离子数分:一元酸、二元酸、多元酸
按酸性强弱分:强酸、中强酸、弱酸
碱
按溶解性分:可溶性碱、难溶性碱
按碱电离出氢氧根个数分:一元碱、二元碱、多元碱
按碱性强弱分:强碱、中强碱、弱碱
盐
*
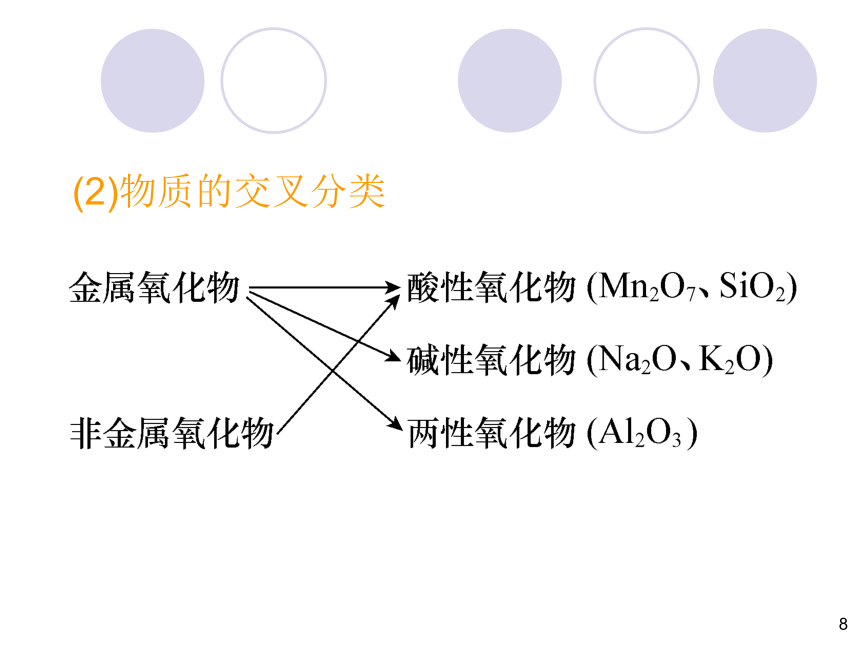
(2)物质的交叉分类
*
(3)纯净物和混合物的比较
纯净物 混合物
组成 有固定的组成(组成物质的各元素有一定的比例关系)和结构 无固定的组成和结构
性质 有固定的熔沸点,能保持物质的化学性质 无固定的熔沸点,每种物质保持原有物质各自的性质
分离 不能用物理方法将组成纯净物的各元素分开,只能通过化学方法才能达到分离各元素的目的 可以用物理方法将混合物中各物质分离开来,如过滤、蒸发、盐析、渗析、结晶、升华、萃取、分液等
*
3.物质的变化与性质
(1)物理变化与化学变化
物理变化 化学变化
特征 无新物质生成 有新物质生成
本质 无新化学键的形成 有化学键的断裂和形成
现象 大小、形状、状态改变 发光、发热、变色、析出沉淀等
实例 蒸馏(分馏)、液化、汽化、吸附、蒸发、升华、焰色反应、金属导电等 干馏、电解、水解、电解质溶液导电、同素异形体转变等
*
(2)化学反应类型的分类
化学反
应类型
按物质类别
和种数分类
化合反应:A+B=AB
分解反应:AB=A+B
置换反应:A+BC=B+AC
复分解反应:AB+CD=AD+CB
按化合价
有无变化
氧化还原反应:有化合价升降变化
非氧化还原反应:无化合价升降变化
按实际参加反
应的微粒分类
离子反应:有离子参加的反应
分子反应:分子之间的反应
按反应中的
热量变化分
放热反应:放出热量的反应
吸热反应:吸收热量的反应
*
(3)物理性质与化学性质
①物理性质:物理性质是物质不需要发生化学变化表现出来的性质,其实质是构成物质的微粒的化学组成、结构没有改变时,呈现的与微粒聚集状态有关的性质。它可由感觉器官直接感知或仪器测知,如物质的颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、挥发性、导热导电性等。
②化学性质:化学性质是物质通过化学变化表现出来的性质,其实质是微粒的化学组成、结构改变时表现出来的性质,包括物质的可燃性、氧化性、还原性、酸碱性、金属活动性、稳定性等。
*
(考查对化学基础知识的应用)海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
C
*
(考查对纯净物和混合物概念的理解)只含有一种元素的物质( )
A.一定是一种单质
B.可能是化合物
C.一定是纯净物
D.可能是纯净物也可能是混合物
D
*
(考查对分类方法的运用)下列化学反应,从反应类型看,与其他三个反应不同的是( )
A.用石墨电极电解稀硫酸
B.用饱和氯化铁溶液制取氢氧化铁胶体
C.过氧化氢与二氧化锰混合
D.浓硝酸见光发生的反应
B
基础知识回顾
1.分散系属于 (填“混合物”或“纯净物”),根据分散质微粒的直径大小不同,可以将分散系分成溶液、胶体和浊液三种类型,在这三种类型的分散系中,最不稳定的是 。
2.溶液中溶质的微粒直径小于 m,溶液具有 、 、 的特点。不同固体物质在水中的溶解能力不同,多数固体在水中的溶解能力随着温度的升高而 ,气体物质在水中的溶解能力随着温度的升高而 ____,随着压强的增大而 。
混合物
浊液
10-9
均一
稳定
透明
增大
降低
增大
3.溶液的浓度可用溶质的质量分数和物质的量浓度来表示,溶质的质量分数表示单位质量的溶液中所含溶质的质量的多少;物质的量浓度表示单位体积的溶液中所含溶质的物质的量的多少。在对同浓度溶液的溶质的质量分数和物质的量浓度进行换算时,必须要知道的量是 。
4.胶体区别于其他分散系的本质在于其微粒直径范围在10-9 m与10-7 m之间,鉴别胶体与溶液最简单的方法是利用 。
该溶液的密度
丁达尔效应
重点知识归纳
1.分散系的概念和类型
分散系是一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。分散系的类型常分成以下三类:
分散系分类 溶液 胶体 悬浊液 乳浊液
分散质直径 <10-9m能透过半透膜 10-9m~10-7m能透过滤纸 >10-7m不能透过滤纸
分散质微粒 单个小分子或离子 小分子和离子的聚集颗粒或高分子颗粒 固体小颗粒 小液滴
续表
分散系分类 溶液 胶体 悬浊液 乳浊液
分散质状态 固、液、气 固、液、气 固 液
主要特征 均一、透
明、稳定 较均一、
较稳定 不均一、不稳定
实例 NaCl溶液
蛋清、Fe(OH)3胶体 泥浆水 油与水
鉴别 无丁达尔现象 有丁达尔现象 静置
沉淀 静置分层
分离方法 蒸发、结晶 渗析、盐析 过滤 分液
动态平衡:在一定温度下固体物质在液态溶剂里当溶解速率和结晶速率相等形成饱和溶液的状态(动态平衡)
表示方法:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq)
(1)溶液的组成
溶质:被溶解的物质,可以是
气体、液体或固体
溶剂:能溶解物质的物质,常
用的溶剂是水
(2)溶解过程
2.溶液
4.胶体
(1)胶体的主要性质
丁达尔现象:光束通过胶体时,形成光亮的“通路”的现象。这是由于胶粒对光的散射而形成的,可用于鉴别胶体与溶液。
(2)胶体的应用
胶体凝聚沉降是解释制豆腐、江河入海口处形成的三角洲、明矾净水、除尘器等的原理。
(考查胶体的知识)
下列关于胶体和溶液的说法中,正确的是( )
A.胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀
B.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分
C.光线通过时,胶体产生丁达尔效应,溶液无丁达尔效应
D.只有胶状物如胶水、果冻类的物质才能称为胶体
C
第一节 物质的分类
*
基础知识回顾
1.元素是具有相同核电荷数的一类原子的总称,构成物质的基本微粒有原子、离子、分子,在化学变化中最小的微粒是 ,保持物质化学性质的最小微粒是 。
2.混合物是由两种或两种以上的物质组成,纯净物是由一种物质组成,单质是指由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物。
原子
分子
*
3.对物质进行分类时必须明确分类的标准。根据化学键的类型不同,可把化合物分成离子化合物和共价化合物,根据能否发生电离,可将化合物分为 和 ,根据物质的组成和性质,可把化合物分成酸、
、 和氧化物。氧化物按照元素的组成可分成金属氧化物和非金属氧化物,按照化学性质可分成碱性氧化物、酸性氧化物、 。
等。
电解质
非电解质
碱
盐
两性
氧化物
*
4.化学变化的特征是有新物质生成,化学变化的本质是有化学键的断裂和形成,化学反应的类型按照反应物和生成物的形式可分为 、 、 和 。
,按照化合价有无变化可分为 。
和 ,按照参加反应的微粒可分为 和 ,按照反应的热量变化可分为 和放热反应。
化合反应
分解反应
置换反应
复
分解反应
氧化
还原反应
非氧化还原反应
离子反应
分子反应
吸热反应
*
重点知识归纳
1.物质的组成
从宏观与微观角度分析如下:
*
2.物质的分类
(1)物质的树状分类
*
按溶解性分:可溶性盐、微溶性盐、难溶性盐
按组成分:正盐、酸式盐、碱式盐、复盐
无机化合物
氧化物
按元素组成分:金属氧化物、非金属氧化物
按性质分:碱性氧化物、酸性氧化物、两性氧化物
酸
按酸根分:含氧酸、无氧酸
按一个酸分子最多能电离出的氢离子数分:一元酸、二元酸、多元酸
按酸性强弱分:强酸、中强酸、弱酸
碱
按溶解性分:可溶性碱、难溶性碱
按碱电离出氢氧根个数分:一元碱、二元碱、多元碱
按碱性强弱分:强碱、中强碱、弱碱
盐
*
(2)物质的交叉分类
*
(3)纯净物和混合物的比较
纯净物 混合物
组成 有固定的组成(组成物质的各元素有一定的比例关系)和结构 无固定的组成和结构
性质 有固定的熔沸点,能保持物质的化学性质 无固定的熔沸点,每种物质保持原有物质各自的性质
分离 不能用物理方法将组成纯净物的各元素分开,只能通过化学方法才能达到分离各元素的目的 可以用物理方法将混合物中各物质分离开来,如过滤、蒸发、盐析、渗析、结晶、升华、萃取、分液等
*
3.物质的变化与性质
(1)物理变化与化学变化
物理变化 化学变化
特征 无新物质生成 有新物质生成
本质 无新化学键的形成 有化学键的断裂和形成
现象 大小、形状、状态改变 发光、发热、变色、析出沉淀等
实例 蒸馏(分馏)、液化、汽化、吸附、蒸发、升华、焰色反应、金属导电等 干馏、电解、水解、电解质溶液导电、同素异形体转变等
*
(2)化学反应类型的分类
化学反
应类型
按物质类别
和种数分类
化合反应:A+B=AB
分解反应:AB=A+B
置换反应:A+BC=B+AC
复分解反应:AB+CD=AD+CB
按化合价
有无变化
氧化还原反应:有化合价升降变化
非氧化还原反应:无化合价升降变化
按实际参加反
应的微粒分类
离子反应:有离子参加的反应
分子反应:分子之间的反应
按反应中的
热量变化分
放热反应:放出热量的反应
吸热反应:吸收热量的反应
*
(3)物理性质与化学性质
①物理性质:物理性质是物质不需要发生化学变化表现出来的性质,其实质是构成物质的微粒的化学组成、结构没有改变时,呈现的与微粒聚集状态有关的性质。它可由感觉器官直接感知或仪器测知,如物质的颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、挥发性、导热导电性等。
②化学性质:化学性质是物质通过化学变化表现出来的性质,其实质是微粒的化学组成、结构改变时表现出来的性质,包括物质的可燃性、氧化性、还原性、酸碱性、金属活动性、稳定性等。
*
(考查对化学基础知识的应用)海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
C
*
(考查对纯净物和混合物概念的理解)只含有一种元素的物质( )
A.一定是一种单质
B.可能是化合物
C.一定是纯净物
D.可能是纯净物也可能是混合物
D
*
(考查对分类方法的运用)下列化学反应,从反应类型看,与其他三个反应不同的是( )
A.用石墨电极电解稀硫酸
B.用饱和氯化铁溶液制取氢氧化铁胶体
C.过氧化氢与二氧化锰混合
D.浓硝酸见光发生的反应
B
基础知识回顾
1.分散系属于 (填“混合物”或“纯净物”),根据分散质微粒的直径大小不同,可以将分散系分成溶液、胶体和浊液三种类型,在这三种类型的分散系中,最不稳定的是 。
2.溶液中溶质的微粒直径小于 m,溶液具有 、 、 的特点。不同固体物质在水中的溶解能力不同,多数固体在水中的溶解能力随着温度的升高而 ,气体物质在水中的溶解能力随着温度的升高而 ____,随着压强的增大而 。
混合物
浊液
10-9
均一
稳定
透明
增大
降低
增大
3.溶液的浓度可用溶质的质量分数和物质的量浓度来表示,溶质的质量分数表示单位质量的溶液中所含溶质的质量的多少;物质的量浓度表示单位体积的溶液中所含溶质的物质的量的多少。在对同浓度溶液的溶质的质量分数和物质的量浓度进行换算时,必须要知道的量是 。
4.胶体区别于其他分散系的本质在于其微粒直径范围在10-9 m与10-7 m之间,鉴别胶体与溶液最简单的方法是利用 。
该溶液的密度
丁达尔效应
重点知识归纳
1.分散系的概念和类型
分散系是一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。分散系的类型常分成以下三类:
分散系分类 溶液 胶体 悬浊液 乳浊液
分散质直径 <10-9m能透过半透膜 10-9m~10-7m能透过滤纸 >10-7m不能透过滤纸
分散质微粒 单个小分子或离子 小分子和离子的聚集颗粒或高分子颗粒 固体小颗粒 小液滴
续表
分散系分类 溶液 胶体 悬浊液 乳浊液
分散质状态 固、液、气 固、液、气 固 液
主要特征 均一、透
明、稳定 较均一、
较稳定 不均一、不稳定
实例 NaCl溶液
蛋清、Fe(OH)3胶体 泥浆水 油与水
鉴别 无丁达尔现象 有丁达尔现象 静置
沉淀 静置分层
分离方法 蒸发、结晶 渗析、盐析 过滤 分液
动态平衡:在一定温度下固体物质在液态溶剂里当溶解速率和结晶速率相等形成饱和溶液的状态(动态平衡)
表示方法:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq)
(1)溶液的组成
溶质:被溶解的物质,可以是
气体、液体或固体
溶剂:能溶解物质的物质,常
用的溶剂是水
(2)溶解过程
2.溶液
4.胶体
(1)胶体的主要性质
丁达尔现象:光束通过胶体时,形成光亮的“通路”的现象。这是由于胶粒对光的散射而形成的,可用于鉴别胶体与溶液。
(2)胶体的应用
胶体凝聚沉降是解释制豆腐、江河入海口处形成的三角洲、明矾净水、除尘器等的原理。
(考查胶体的知识)
下列关于胶体和溶液的说法中,正确的是( )
A.胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀
B.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分
C.光线通过时,胶体产生丁达尔效应,溶液无丁达尔效应
D.只有胶状物如胶水、果冻类的物质才能称为胶体
C
同课章节目录
