黑龙江省虎林市高级中学化学课件2.1.2 分子结构与性质
文档属性
| 名称 | 黑龙江省虎林市高级中学化学课件2.1.2 分子结构与性质 |

|
|
| 格式 | zip | ||
| 文件大小 | 341.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-29 21:32:00 | ||
图片预览







文档简介
(共35张PPT)
第二章
《分子结构与性质》
什么是化学键?
什么是离子键?
什么是共价键?
化学键:分子中相邻原子之间强烈的相互作用。
离子键:阴、阳离子之间通过静电作用形成的
化学键。
共价键:原子间通过共用电子对形成的化学键。
一、共价键
1、共价键具有饱和性
按照共价键的共用电子对理论,一个原子有几个未
成对电子,便可和几个自旋相反的电子配对成键,
这就共价键的“饱和性”。H 原子、Cl原子都只有一
个未成对电子,因而只能形成H2、HCl、Cl2分子,
不能形成H3、H2Cl、Cl3分子
电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
2、共价键的形成
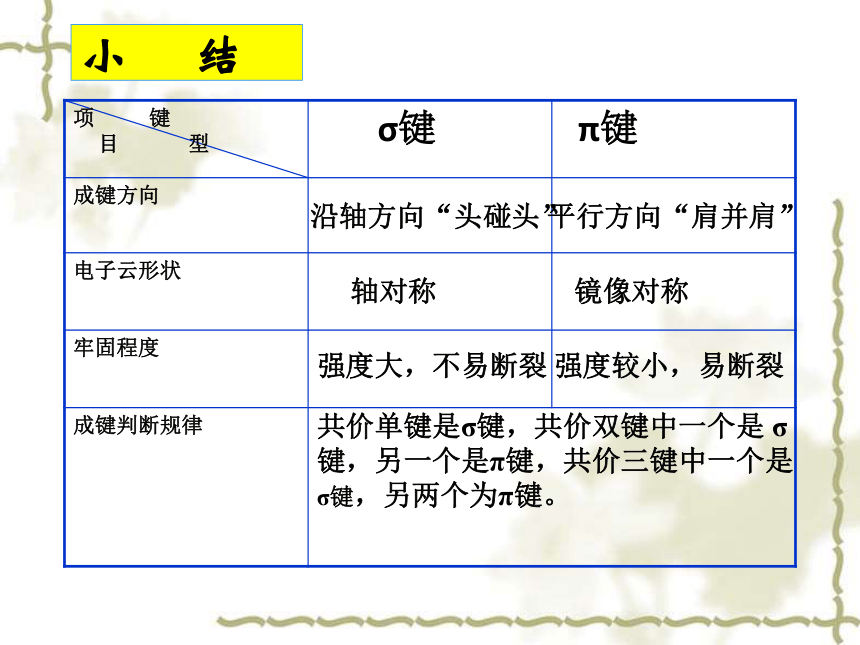
小 结
项 键
目 型 σ键 π键
成键方向
电子云形状
牢固程度
成键判断规律
沿轴方向“头碰头”
平行方向“肩并肩”
轴对称
镜像对称
强度大,不易断裂
强度较小,易断裂
共价单键是σ键,共价双键中一个是 σ键,另一个是π键,共价三键中一个是σ键,另两个为π键。
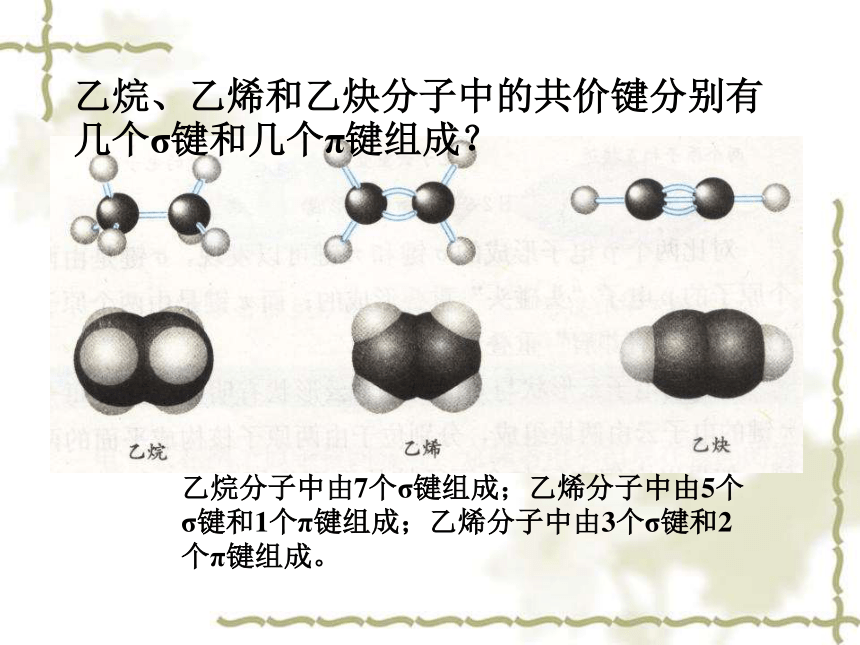
乙烷、乙烯和乙炔分子中的共价键分别有几个σ键和几个π键组成?
乙烷分子中由7个σ键组成;乙烯分子中由5个σ键和1个π键组成;乙烯分子中由3个σ键和2个π键组成。
1、下列说法正确的是
A、含有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物
D、只有非金属原子间才能形成共价键
2、氮分子中的化学键是 A、3个σ键 B、1个σ键,2个π键 C、个π键 D、个σ键,1个π键
B
B
3、下列说法中正确的是 A、p轨道之间以“肩并肩”重叠可形成σ键
B、p轨道之间以“头对头”重叠可形成π键
C、s和p轨道以“头对头”重叠可形成σ键
D、共价键是两个原子轨道以“头对头”重叠形成的
C
4、在氯化氢分子中,形成共价键的原子轨道是 A、 氯原子的2p轨道和氢原子的1s轨道
B、 氯原子的2p轨道和氢原子的2p轨道
C、氯原子的3p轨道和氢原子的1s轨道
D、氯原子的3p轨道和氢原子的3p轨道
C
C2H2
CH2O
COCl2
NH3
P4
CH4
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
写出CO2、H2O、NH3、CH2O、CH4等分子的电子式、结构式及分子的空间构型:
分子 CO2 H2O NH3 CH2O CH4
电子式
结构式
分子的空间构型
O C O
::
::
:
:
:
:
:
:
:
H O H
:
:
:
:
H N H
:
H
:
:
:
H C H
:
H
H
O=C=O
H-O-H
H-N-H
-
H
H-C-H
=
O
H-C-H
-
-
H
H
直线形
倒V 形
三角
锥 形
平面
三角形
正
四面体
H
H
. .
C
. .
. .
O
. .
. .
. .
对ABn型分子,B围绕A成键,则A为中心原子,n
值为中心原子结合的原子数。
1、内容:中心原子价电子层电子对(包括___ 电子对和 的孤对电子对)的互相 作用,使分子的几何构型总是采取电子对相互 的那种构型,即分子尽可能采取对称的空间构型。
(VSEPR模型)
成键
未成键
排斥
排斥最小
二、价层电子对互斥模型
只有一种角度,120°。
只有一种角度,109°28′。
5 对电子 三角双锥
3 对电子 正三角形
A
4 对电子 正四面体
A
电子对数和电子对空间构型的关系
电子对相互排斥,在空间达到平衡取向。
2 对电子 直线形
6 对电子 正八面体
课堂练习:
1、多原子分子的立体结构有多种,三原子分子的立体结构有___ 形和 形,大多数四原子分子采取 形和 ___ 形两种立体结构,五原子分子的立体结构中最常见的是
形。
2 、下列分子或离子中,不含有孤对电子的是 ___
A、H2O、B、H3O+、C、NH3、D、NH4+
3 、下列分子①BCl3、②CCl4、③H2S、④CS2中,其键角由小到大的顺序为___
4、以下分子或离子的结构为正四面体,且键角为109°28′ 的是____
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42-
A、①②③ B、①②④ C、①②⑤ D、①④⑤
5、用价层电子对互斥模型判断SO3的分子构型 ___
A、正四面体形 B、V形 C、三角锥形 D、平面三角形
直线
V
平面三角
三角锥
③ ② ① ④
D
C
D
正四面体
一、键的极性和分子的极性
极性键与非极性键
(1)何谓共价键?
(2)何谓电负性?
(3)分别以H2、HCl为例,探究电负性对共价键有何影响?
练习与巩固
1.含有非极性键的离子化合物是 ( )
A. NaOH B .Na2O2
C.NaCl D .NH4Cl
2.下列元素间形成的共价键中,极性最强的是 ( )
A.F―F B.H―F
C.H―Cl D.H―O
总结:键的极性与分子极性的关系
A、都是由非极性键构成的分子一定是非极 性分子。
B、极性键结合形成的双原子分子一定为极 性分子。
C、极性键结合形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
对范德华力的理解
①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点、溶解性等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力只存在于由分子构成的物质之间,离子化合物、原子化合物、金属之间不存在范德华力。
③分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
④分子的大小、分子的极性对范德华力有显著影响。结构相似的分子,相对分子质量越大范德华力越大;分子的极性越大,范德华力也越大。
三、氢键及其对物质性质的影响
氢键的本质
氢原子与电负性大的原子X以共价键结合时,H原子还能够跟另外一个电负性大的原子Y之间产生静电引力的作用,成为氢键,表示为:X-H…Y(X、Y为N、O、F)。
氢键的特征
氢键既有方向性(X-H…Y尽可能在同一条直线上),又有饱和性(X-H只能和一个Y原子结合)。
氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。
氢键的形成对化合物性质的影响
(1)对沸点和熔点的影响
分子间氢键使物质熔、沸点升高。而分子内氢键使物质的沸点和熔点降低。
(2)对溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子间氢键使恰好相反。
相似相溶原理
“凡是分子结构相似的物质,都是易于互相溶解的。”这是从大量事实总结出来的一条规律,叫做相似相溶原理。由于分子的极性是否相似对溶解性影响很大,所以,相似相溶原理又可以理解为“极性分子易溶于极性溶剂中,非极性分子易溶于非极性溶剂中。”例如:CCl4是非极性分子,作为溶剂它就是非极性溶剂;而H20是极性分子,所以它是极性溶剂。Br2、I2等都是非极性分子,所以易溶于CCl4、苯等非极性溶剂,而在水这一极性溶剂中溶解度就很小。相反,盐类(NaCl等)这些离子化合物可看做是极性最强的,它们就易溶于水而不溶于CCl4、苯等非极性溶剂。HCl、H2S04是强极性分手,易溶于水而难溶于CCl4。利用相似相溶原理,有助于我们判断物质在不同溶剂中的溶解性。
结论:影响溶解度的因素
(1)内因:相似相溶原理
(2)外因:影响固体溶解度的主要因素是温度;影响气体溶解度的主要因素是温度和压强。
(3)其他因素:
A)如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。如:NH3。
B)溶质与水发生反应时可增大其溶解度,如:SO2。
五、手性
例如:乳酸分子CH3CHOHCOOH有以下两种异构体:
图片
六、无机含氧酸分子的酸性
把含氧酸的化学式写成(HO)m ROn,
就能根据n值判断常见含氧酸的强弱。
n=0,极弱酸,如硼酸(H3BO3)。
n=1,弱酸,如亚硫酸(H2SO3)。
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)。
n=3,极强酸,如高氯酸(HClO4)。
无机含氧酸强度的变化本质
含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。
H4SiO4 H3PO4 H2SO4 HClO4
HClO HClO3 HClO4
HClO HBrO HIO
练习:比较下列含氧酸酸性的强弱
无氧酸的酸性强弱变化规律
若用通式R-H表示无氧酸,则其酸性的强弱主要取决于R的电负性。
如果R原子电负性大,对氢原子的束缚力强,则其酸性弱。
如果R原子的电负性小,对氢原子的束缚力弱,则其酸性就强。
练习:比较下列物质的酸性强弱,有何结论?
(1)CH4、NH3、H2O、HF
(2)HF、HCl、HBr、HI
第二章
《分子结构与性质》
什么是化学键?
什么是离子键?
什么是共价键?
化学键:分子中相邻原子之间强烈的相互作用。
离子键:阴、阳离子之间通过静电作用形成的
化学键。
共价键:原子间通过共用电子对形成的化学键。
一、共价键
1、共价键具有饱和性
按照共价键的共用电子对理论,一个原子有几个未
成对电子,便可和几个自旋相反的电子配对成键,
这就共价键的“饱和性”。H 原子、Cl原子都只有一
个未成对电子,因而只能形成H2、HCl、Cl2分子,
不能形成H3、H2Cl、Cl3分子
电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
2、共价键的形成
小 结
项 键
目 型 σ键 π键
成键方向
电子云形状
牢固程度
成键判断规律
沿轴方向“头碰头”
平行方向“肩并肩”
轴对称
镜像对称
强度大,不易断裂
强度较小,易断裂
共价单键是σ键,共价双键中一个是 σ键,另一个是π键,共价三键中一个是σ键,另两个为π键。
乙烷、乙烯和乙炔分子中的共价键分别有几个σ键和几个π键组成?
乙烷分子中由7个σ键组成;乙烯分子中由5个σ键和1个π键组成;乙烯分子中由3个σ键和2个π键组成。
1、下列说法正确的是
A、含有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物
D、只有非金属原子间才能形成共价键
2、氮分子中的化学键是 A、3个σ键 B、1个σ键,2个π键 C、个π键 D、个σ键,1个π键
B
B
3、下列说法中正确的是 A、p轨道之间以“肩并肩”重叠可形成σ键
B、p轨道之间以“头对头”重叠可形成π键
C、s和p轨道以“头对头”重叠可形成σ键
D、共价键是两个原子轨道以“头对头”重叠形成的
C
4、在氯化氢分子中,形成共价键的原子轨道是 A、 氯原子的2p轨道和氢原子的1s轨道
B、 氯原子的2p轨道和氢原子的2p轨道
C、氯原子的3p轨道和氢原子的1s轨道
D、氯原子的3p轨道和氢原子的3p轨道
C
C2H2
CH2O
COCl2
NH3
P4
CH4
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
写出CO2、H2O、NH3、CH2O、CH4等分子的电子式、结构式及分子的空间构型:
分子 CO2 H2O NH3 CH2O CH4
电子式
结构式
分子的空间构型
O C O
::
::
:
:
:
:
:
:
:
H O H
:
:
:
:
H N H
:
H
:
:
:
H C H
:
H
H
O=C=O
H-O-H
H-N-H
-
H
H-C-H
=
O
H-C-H
-
-
H
H
直线形
倒V 形
三角
锥 形
平面
三角形
正
四面体
H
H
. .
C
. .
. .
O
. .
. .
. .
对ABn型分子,B围绕A成键,则A为中心原子,n
值为中心原子结合的原子数。
1、内容:中心原子价电子层电子对(包括___ 电子对和 的孤对电子对)的互相 作用,使分子的几何构型总是采取电子对相互 的那种构型,即分子尽可能采取对称的空间构型。
(VSEPR模型)
成键
未成键
排斥
排斥最小
二、价层电子对互斥模型
只有一种角度,120°。
只有一种角度,109°28′。
5 对电子 三角双锥
3 对电子 正三角形
A
4 对电子 正四面体
A
电子对数和电子对空间构型的关系
电子对相互排斥,在空间达到平衡取向。
2 对电子 直线形
6 对电子 正八面体
课堂练习:
1、多原子分子的立体结构有多种,三原子分子的立体结构有___ 形和 形,大多数四原子分子采取 形和 ___ 形两种立体结构,五原子分子的立体结构中最常见的是
形。
2 、下列分子或离子中,不含有孤对电子的是 ___
A、H2O、B、H3O+、C、NH3、D、NH4+
3 、下列分子①BCl3、②CCl4、③H2S、④CS2中,其键角由小到大的顺序为___
4、以下分子或离子的结构为正四面体,且键角为109°28′ 的是____
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42-
A、①②③ B、①②④ C、①②⑤ D、①④⑤
5、用价层电子对互斥模型判断SO3的分子构型 ___
A、正四面体形 B、V形 C、三角锥形 D、平面三角形
直线
V
平面三角
三角锥
③ ② ① ④
D
C
D
正四面体
一、键的极性和分子的极性
极性键与非极性键
(1)何谓共价键?
(2)何谓电负性?
(3)分别以H2、HCl为例,探究电负性对共价键有何影响?
练习与巩固
1.含有非极性键的离子化合物是 ( )
A. NaOH B .Na2O2
C.NaCl D .NH4Cl
2.下列元素间形成的共价键中,极性最强的是 ( )
A.F―F B.H―F
C.H―Cl D.H―O
总结:键的极性与分子极性的关系
A、都是由非极性键构成的分子一定是非极 性分子。
B、极性键结合形成的双原子分子一定为极 性分子。
C、极性键结合形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
对范德华力的理解
①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点、溶解性等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力只存在于由分子构成的物质之间,离子化合物、原子化合物、金属之间不存在范德华力。
③分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
④分子的大小、分子的极性对范德华力有显著影响。结构相似的分子,相对分子质量越大范德华力越大;分子的极性越大,范德华力也越大。
三、氢键及其对物质性质的影响
氢键的本质
氢原子与电负性大的原子X以共价键结合时,H原子还能够跟另外一个电负性大的原子Y之间产生静电引力的作用,成为氢键,表示为:X-H…Y(X、Y为N、O、F)。
氢键的特征
氢键既有方向性(X-H…Y尽可能在同一条直线上),又有饱和性(X-H只能和一个Y原子结合)。
氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。
氢键的形成对化合物性质的影响
(1)对沸点和熔点的影响
分子间氢键使物质熔、沸点升高。而分子内氢键使物质的沸点和熔点降低。
(2)对溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子间氢键使恰好相反。
相似相溶原理
“凡是分子结构相似的物质,都是易于互相溶解的。”这是从大量事实总结出来的一条规律,叫做相似相溶原理。由于分子的极性是否相似对溶解性影响很大,所以,相似相溶原理又可以理解为“极性分子易溶于极性溶剂中,非极性分子易溶于非极性溶剂中。”例如:CCl4是非极性分子,作为溶剂它就是非极性溶剂;而H20是极性分子,所以它是极性溶剂。Br2、I2等都是非极性分子,所以易溶于CCl4、苯等非极性溶剂,而在水这一极性溶剂中溶解度就很小。相反,盐类(NaCl等)这些离子化合物可看做是极性最强的,它们就易溶于水而不溶于CCl4、苯等非极性溶剂。HCl、H2S04是强极性分手,易溶于水而难溶于CCl4。利用相似相溶原理,有助于我们判断物质在不同溶剂中的溶解性。
结论:影响溶解度的因素
(1)内因:相似相溶原理
(2)外因:影响固体溶解度的主要因素是温度;影响气体溶解度的主要因素是温度和压强。
(3)其他因素:
A)如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。如:NH3。
B)溶质与水发生反应时可增大其溶解度,如:SO2。
五、手性
例如:乳酸分子CH3CHOHCOOH有以下两种异构体:
图片
六、无机含氧酸分子的酸性
把含氧酸的化学式写成(HO)m ROn,
就能根据n值判断常见含氧酸的强弱。
n=0,极弱酸,如硼酸(H3BO3)。
n=1,弱酸,如亚硫酸(H2SO3)。
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)。
n=3,极强酸,如高氯酸(HClO4)。
无机含氧酸强度的变化本质
含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。
H4SiO4 H3PO4 H2SO4 HClO4
HClO HClO3 HClO4
HClO HBrO HIO
练习:比较下列含氧酸酸性的强弱
无氧酸的酸性强弱变化规律
若用通式R-H表示无氧酸,则其酸性的强弱主要取决于R的电负性。
如果R原子电负性大,对氢原子的束缚力强,则其酸性弱。
如果R原子的电负性小,对氢原子的束缚力弱,则其酸性就强。
练习:比较下列物质的酸性强弱,有何结论?
(1)CH4、NH3、H2O、HF
(2)HF、HCl、HBr、HI
同课章节目录
