黑龙江省虎林市高级中学化学课件3.3 氧化还原反
文档属性
| 名称 | 黑龙江省虎林市高级中学化学课件3.3 氧化还原反 |

|
|
| 格式 | zip | ||
| 文件大小 | 66.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-29 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
第三节 氧化还原反应
基础知识回顾
1.氧化还原反应是指有元素化合价升降的反应。在氧化还原反应中,化合价升高的元素有 电子,被氧化,发生氧化反应,其反应物是 剂,得到的产物称为氧化产物;化合价降低的元素 电子,被还原,发生还原反应,其反应物是 剂,得到的产物称为还原产物。
失去(或偏离)
还原
得到(或偏向)
氧化
2.活泼非金属元素的单质一般容易得到电子是 剂,氧化性越强的单质对应的离子 性就越弱,活泼金属元素的单质一般容易失去电子是 剂,还原性越弱的单质对应的离子的 性就越强。在化合物中的元素处于最高价态时容易表现氧化性,处于最低价态时容易表现还原性,处于中间价态时既能表现氧化性又能表现还原性。
氧化
还原
还原
氧化
3.在氧化还原反应中,除了遵循质量守恒定律,在反应前后原子的种类与个数不发生变化以外,反应过程中电子得失的总数或化合价升降的总数也守恒。
重点知识归纳
1.氧化还原反应的基本概念
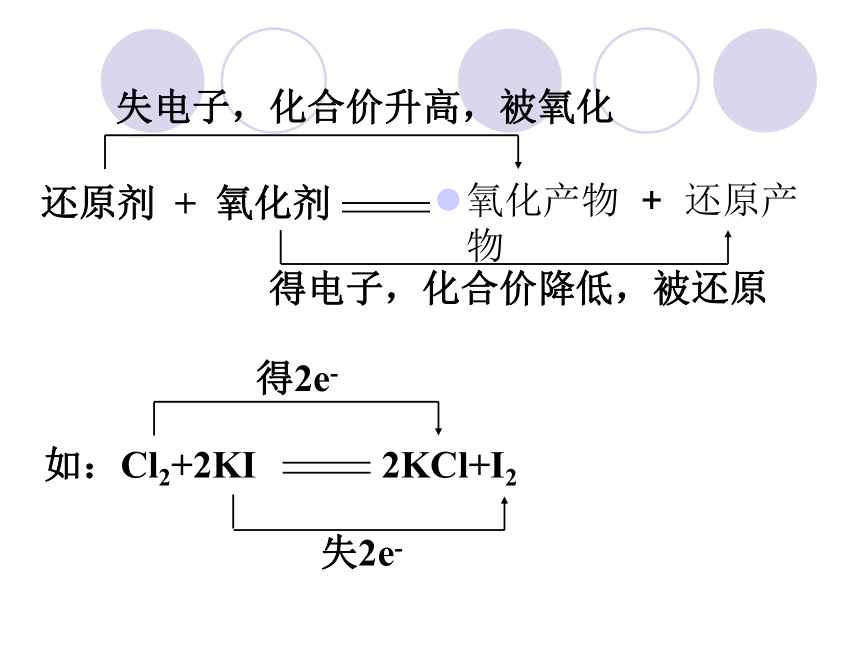
氧化还原反应的本质是有电子转移(电子得失或共用电子对偏移),表现的特征是化合价的升降。相互关系如下:
2.氧化还原反应电子转移方向和数目
(1)转移方向
电子总是由还原剂失去(或偏离)后,转移到氧化剂中,可以有两种表示方法:
方法一:双线桥法:用箭头表示氧化还原反应中同一元素化合价升降的情况,一条箭头由氧化剂指向还原产物,另一条箭头由还原剂指向氧化产物。即:
氧化产物 + 还原产物
还原剂 + 氧化剂
得2e-
失2e-
如:Cl2+2KI 2KCl+I2
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
(2)电子转移数目
氧化还原反应中电子转移数目=实际参加反应的氧化剂物质的量×每摩尔氧化剂得到电子的数目=实际参加反应的还原剂物质的量×每摩尔还原剂失去电子的数目。
例如:
MnO2+4HCl MnCl2+Cl2↑+2H2O,转移电子数=1×2e-=2×1e-=2e-。
△
方法二:单线桥法:用箭头表示反应物中原子或离子的电子转移情况,箭头由失电子的元素指向得电子的元素,标出电子转移的总数,在“电子数目”前一定不要注明“得”“失”字样。即:
电子数目
还原剂 + 氧化剂
还原产物 + 氧化产物
2e-
如:Cl2+2KI 2KCl+I2
3.氧化剂、还原剂及其强弱比较
(1)常见氧化剂
①活泼的非金属,如Cl2、Br2、O2等。
②元素(如Mn、Fe等)处于高化合价的氧化物,如MnO2、Fe2O3等。
③元素(如S、N等)处于高化合价时的含氧酸,如浓H2SO4、HNO3等。
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
(2)常见还原剂
①活泼的金属,如Na、Al、Zn、Fe等。
②元素(如C、S等)处于低化合价的氧化物,如CO、SO2等。
③元素(如Cl、S等)处于低化合价时的酸,如浓HCl、H2S等。
④元素(如S、Fe等)处于低化合价时的盐,如Na2SO3、FeSO4等。
⑤某些非金属单质,如H2、C、Si等。
4.氧化还原反应配平方法与步骤(以Cu与稀HNO3反应为例)
(1)标变价:标出氧化剂、还原剂、氧化产物、还原产物中变价元素的化合价。
Cu+HNO3 Cu (NO3)2+NO+H2O
0
+5
+2
+2
(2)求总数:求得失电子数的最小公倍数,以确定氧化剂、还原剂、氧化产物、还原产物四种物质的化学计量数。
Cu:0 +2升2×3
N:+5 +2降3×2
(3)配化学计量数:观察配平两边其他物质的化学计量数,并进行检查。
3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑
+K2SO4+2CO2↑+2H2O
下列说法正确的是( )
A.KClO3在反应中失去电子
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.1 mol KClO3参加反应有2 mol电子转移
C
(考查氧化还原反应计算问题)某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2∶1时,还原产物是( )
A.NO2 B.NO
C.N2O D.N2
C
(考查氧化还原反应综合知识的应用)(2010 上海卷)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
__ + __ + __
―→__HIO3 + __
I2
Cl2
5
6
H2O
HCl
2
10
(2)整个过程中的还原剂是__________。
(3)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是___________________________________。
(4)加碘盐中含碘量为20 mg~50 mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,保留2位小数)。
KI、I2
橙黄
HBrO3>Cl2>HIO3
10.58
第三节 氧化还原反应
基础知识回顾
1.氧化还原反应是指有元素化合价升降的反应。在氧化还原反应中,化合价升高的元素有 电子,被氧化,发生氧化反应,其反应物是 剂,得到的产物称为氧化产物;化合价降低的元素 电子,被还原,发生还原反应,其反应物是 剂,得到的产物称为还原产物。
失去(或偏离)
还原
得到(或偏向)
氧化
2.活泼非金属元素的单质一般容易得到电子是 剂,氧化性越强的单质对应的离子 性就越弱,活泼金属元素的单质一般容易失去电子是 剂,还原性越弱的单质对应的离子的 性就越强。在化合物中的元素处于最高价态时容易表现氧化性,处于最低价态时容易表现还原性,处于中间价态时既能表现氧化性又能表现还原性。
氧化
还原
还原
氧化
3.在氧化还原反应中,除了遵循质量守恒定律,在反应前后原子的种类与个数不发生变化以外,反应过程中电子得失的总数或化合价升降的总数也守恒。
重点知识归纳
1.氧化还原反应的基本概念
氧化还原反应的本质是有电子转移(电子得失或共用电子对偏移),表现的特征是化合价的升降。相互关系如下:
2.氧化还原反应电子转移方向和数目
(1)转移方向
电子总是由还原剂失去(或偏离)后,转移到氧化剂中,可以有两种表示方法:
方法一:双线桥法:用箭头表示氧化还原反应中同一元素化合价升降的情况,一条箭头由氧化剂指向还原产物,另一条箭头由还原剂指向氧化产物。即:
氧化产物 + 还原产物
还原剂 + 氧化剂
得2e-
失2e-
如:Cl2+2KI 2KCl+I2
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
(2)电子转移数目
氧化还原反应中电子转移数目=实际参加反应的氧化剂物质的量×每摩尔氧化剂得到电子的数目=实际参加反应的还原剂物质的量×每摩尔还原剂失去电子的数目。
例如:
MnO2+4HCl MnCl2+Cl2↑+2H2O,转移电子数=1×2e-=2×1e-=2e-。
△
方法二:单线桥法:用箭头表示反应物中原子或离子的电子转移情况,箭头由失电子的元素指向得电子的元素,标出电子转移的总数,在“电子数目”前一定不要注明“得”“失”字样。即:
电子数目
还原剂 + 氧化剂
还原产物 + 氧化产物
2e-
如:Cl2+2KI 2KCl+I2
3.氧化剂、还原剂及其强弱比较
(1)常见氧化剂
①活泼的非金属,如Cl2、Br2、O2等。
②元素(如Mn、Fe等)处于高化合价的氧化物,如MnO2、Fe2O3等。
③元素(如S、N等)处于高化合价时的含氧酸,如浓H2SO4、HNO3等。
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
(2)常见还原剂
①活泼的金属,如Na、Al、Zn、Fe等。
②元素(如C、S等)处于低化合价的氧化物,如CO、SO2等。
③元素(如Cl、S等)处于低化合价时的酸,如浓HCl、H2S等。
④元素(如S、Fe等)处于低化合价时的盐,如Na2SO3、FeSO4等。
⑤某些非金属单质,如H2、C、Si等。
4.氧化还原反应配平方法与步骤(以Cu与稀HNO3反应为例)
(1)标变价:标出氧化剂、还原剂、氧化产物、还原产物中变价元素的化合价。
Cu+HNO3 Cu (NO3)2+NO+H2O
0
+5
+2
+2
(2)求总数:求得失电子数的最小公倍数,以确定氧化剂、还原剂、氧化产物、还原产物四种物质的化学计量数。
Cu:0 +2升2×3
N:+5 +2降3×2
(3)配化学计量数:观察配平两边其他物质的化学计量数,并进行检查。
3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑
+K2SO4+2CO2↑+2H2O
下列说法正确的是( )
A.KClO3在反应中失去电子
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.1 mol KClO3参加反应有2 mol电子转移
C
(考查氧化还原反应计算问题)某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2∶1时,还原产物是( )
A.NO2 B.NO
C.N2O D.N2
C
(考查氧化还原反应综合知识的应用)(2010 上海卷)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
__ + __ + __
―→__HIO3 + __
I2
Cl2
5
6
H2O
HCl
2
10
(2)整个过程中的还原剂是__________。
(3)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是___________________________________。
(4)加碘盐中含碘量为20 mg~50 mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,保留2位小数)。
KI、I2
橙黄
HBrO3>Cl2>HIO3
10.58
同课章节目录
