黑龙江省虎林市高级中学化学课件4.1 碳、硅及其化合物
文档属性
| 名称 | 黑龙江省虎林市高级中学化学课件4.1 碳、硅及其化合物 |

|
|
| 格式 | zip | ||
| 文件大小 | 93.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-29 00:00:00 | ||
图片预览





文档简介
(共21张PPT)
第一节 碳 硅及其化合物
基础知识回顾
一、单质碳的性质
1.同素异形体
金刚石:原子晶体
石墨:混合晶体
C60、C70:分子晶体
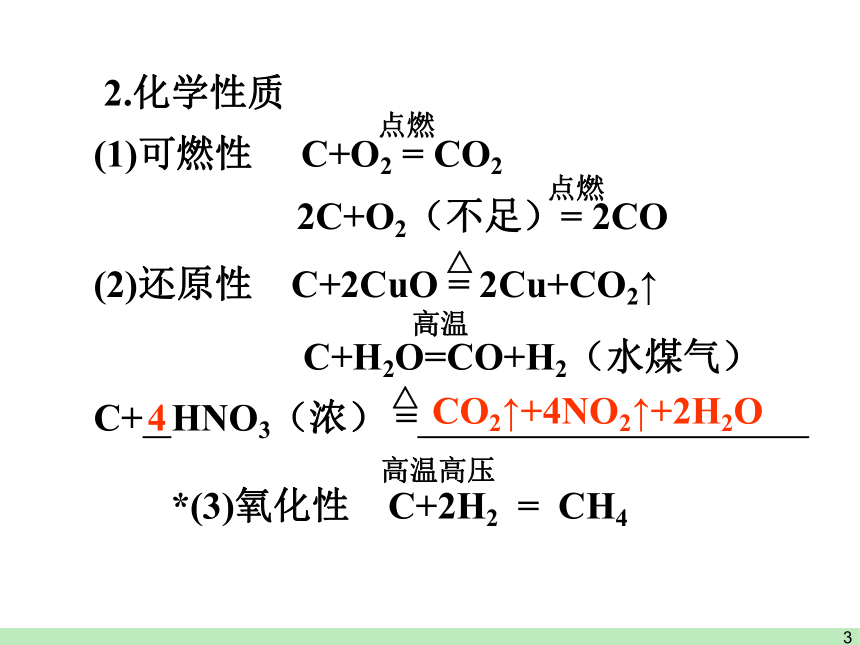
*(3)氧化性 C+2H2 = CH4
2.化学性质
(1)可燃性 C+O2 = CO2
点燃
2C+O2(不足)= 2CO
点燃
(2)还原性 C+2CuO = 2Cu+CO2↑
△
C+H2O=CO+H2(水煤气)
高温
4
CO2↑+4NO2↑+2H2O
C+ HNO3(浓) = .
△
高温高压
二、碳的氧化物的对比
CO CO2
物理
性质 无色无味,难溶于水,有毒 无色无味,可溶于水
化学
性质 (1)可燃性:
2CO+O2 = 2CO2
(2)还原性(高温下):
.CO+Fe2O3= .A (炼铁)
CO+CuO=
Cu+CO2 (1)跟水反应:
CO2+H2O H2CO3
H++HCO-3
(2)酸性氧化物:
CO2+CaO=CaCO3,
CO2+Ca(OH)2=CaCO3↓+H2O
(3)氧化性:CO2+C = 2CO
CO2+2Mg = 2MgO+C
△
点燃
点燃
3
△
+3CO2
2Fe
△
CO CO2
制取方法 CaCO3+2HCl=CaCl2+H2O+CO2↑(实验室)
CaCO3 =
高温
CaO+CO2↑(工业)
三、碳酸盐和酸式盐的性质
1.水溶性:正盐除钾、钠、铵盐易溶于水外,其余均不溶于水;酸式盐都溶于水。
2.热稳定性:正盐大于酸式盐。
3.相互转化:正盐→酸式盐的离子反应:
CO32-+CO2+H2O = 。
酸式盐→正盐的离子反应:
HCO3-+OH- = 或加热分解。
H2O+CO32-
2HCO3-
四、硅及其化合物
1.硅的结构及性质
(1)晶体结构:正四面体型空间网状结构,原子晶体。
(2)主要性质
①物理性质:熔点高,硬度大,具有金属光泽、半导体,只能以化合态存在于自然界。
②化学性质:
在常温下,除与F2、HF和强碱溶液反应外,硅不易和其他物质反应。
SiCl4+2H2 = Si+4HCl
Si+2NaOH+H2O = Na2SiO3+2H2↑
加热条件下,能与一些物质反应。
Si+O2 = SiO2
△
③Si的制备:
SiO2+2C = Si(粗硅)+2CO↑
高温
Si+2Cl2 = 2SiCl4,
高温
高温
2.二氧化硅
(1)存在广泛存在于自然界中(沙子、石英、水晶的主要成分均是二氧化硅)。
(2)物理性质纯SiO2是无色透明的晶体,硬度大、沸点高。
SiO2+2NaOH = Na2SiO3+H2O,
与CaO反应
SiO2+CaO = CaSiO3。
②和氢氟酸反应(腐蚀玻璃)
③在高温下,可与Na2CO3、CaCO3等碳酸盐反应。
(4)用途沙子用于建筑,石英用于制造玻璃,纯SiO2用于制造光学器材和光导纤维。
(3)化学性质
①酸性氧化物
与NaOH反应
高温
五、硅酸盐
(1)硅酸钠
大多数硅酸盐不溶于水,化学性质稳定。但硅酸钠可溶于水,其水溶液俗称“水玻璃”,可作黏合剂、防腐剂、防火剂。
普通玻璃 普通硅酸盐水泥 陶瓷
主要
原料 纯碱、石灰石、石英 石灰石、黏土、适量的石膏等 含铝、硅酸盐材料的黏土
主要
成分
及
用途 硅酸盐;各种用途的玻璃制品 硅酸盐;重要建筑材料 硅酸盐;应用于生活领域,工业、农业、航天、电子、原子能等领域
(2)硅酸盐产品
重点知识归纳
一、碳及其化合物转化关系
2.碳酸的电离平衡及跟碱的反应:
H2CO3 H++HCO-3
HCO-3 H++CO2-3
1.正盐与酸式盐相互转化:
碳酸碳酸 氢盐
盐酸性条件(H+)
碱性条件(OH-)或△(加热)
碱少时(酸过量)生成酸式盐,碱过量(酸少)生成正盐。
二、二氧化硅与二氧化碳
二氧化碳 二氧化硅
结构特点 由二氧化碳分子构成 由氧原子与硅原子
构成网状结构
物理性质 熔、沸点低、可溶于水 坚硬难熔的
固体、不溶于水
CO2+2NaOH =Na2CO3+H2O SiO2+2NaOH=
Na2SiO3+H2O
二氧化碳 二氧化硅
CO2+H2O=
H2CO3 不反应
CaO+CO2=
CaCO3
不反应 *4HF+SiO2=
SiF4↑+2H2O
用途 制饮料、制碳酸盐 光导纤维、光学仪器、电子部件
存在 空气 岩石、砂石、
水晶、硅藻土
高温
CaO+SiO2 = CaSiO3
三、硅及其化合物的特性
1.非金属单质一般不跟非氧化性酸反应,但Si能与HF反应。
2.非金属单质跟碱溶液反应一般无H2放出,但Si却能生成H2。
3.非金属单质一般为非导体,但Si为半导体。
4.SiO2是酸性氧化物,但它不溶于水,不能直接与H2O反应制备H2SiO3。
5.酸性氧化物一般不与酸反应,但SiO2能与HF反应。
6.无机酸一般易溶于水,但H2SiO3难溶于水。
(考查碳的化合物性质)向下列溶液中通入过量CO2,最终出现浑浊的是( )
A.饱和石灰水
B.水玻璃
C.BaCl2溶液
D.氯化钙饱和溶液
B
(考查硅的化合物性质)①浓硝酸、②水、③王水、④氢氟酸、⑤氢氧化钾溶液中,能与二氧化硅起化学反应的是( )
A.①② B.②④
C.④⑤ D.③④⑤
C
第一节 碳 硅及其化合物
基础知识回顾
一、单质碳的性质
1.同素异形体
金刚石:原子晶体
石墨:混合晶体
C60、C70:分子晶体
*(3)氧化性 C+2H2 = CH4
2.化学性质
(1)可燃性 C+O2 = CO2
点燃
2C+O2(不足)= 2CO
点燃
(2)还原性 C+2CuO = 2Cu+CO2↑
△
C+H2O=CO+H2(水煤气)
高温
4
CO2↑+4NO2↑+2H2O
C+ HNO3(浓) = .
△
高温高压
二、碳的氧化物的对比
CO CO2
物理
性质 无色无味,难溶于水,有毒 无色无味,可溶于水
化学
性质 (1)可燃性:
2CO+O2 = 2CO2
(2)还原性(高温下):
.CO+Fe2O3= .A (炼铁)
CO+CuO=
Cu+CO2 (1)跟水反应:
CO2+H2O H2CO3
H++HCO-3
(2)酸性氧化物:
CO2+CaO=CaCO3,
CO2+Ca(OH)2=CaCO3↓+H2O
(3)氧化性:CO2+C = 2CO
CO2+2Mg = 2MgO+C
△
点燃
点燃
3
△
+3CO2
2Fe
△
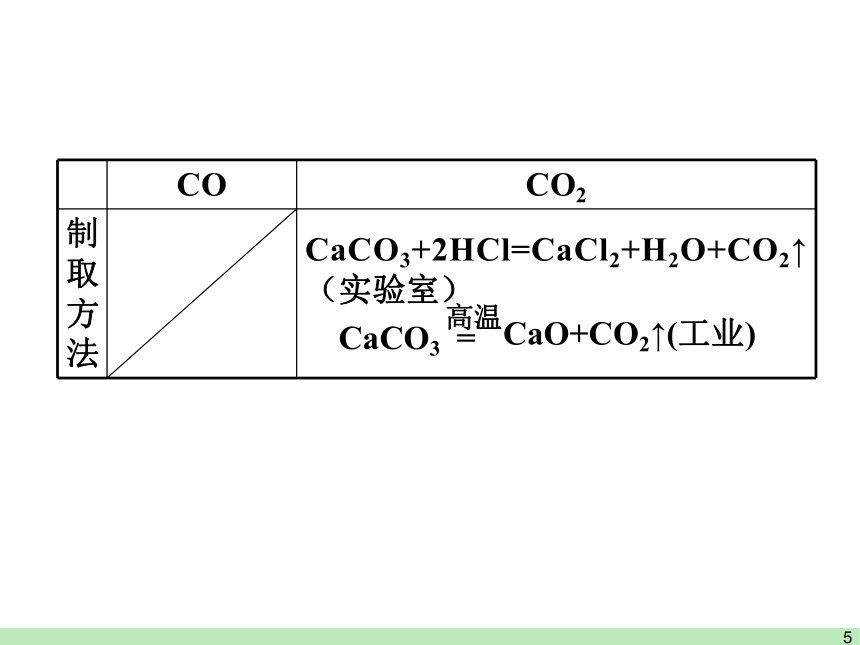
CO CO2
制取方法 CaCO3+2HCl=CaCl2+H2O+CO2↑(实验室)
CaCO3 =
高温
CaO+CO2↑(工业)
三、碳酸盐和酸式盐的性质
1.水溶性:正盐除钾、钠、铵盐易溶于水外,其余均不溶于水;酸式盐都溶于水。
2.热稳定性:正盐大于酸式盐。
3.相互转化:正盐→酸式盐的离子反应:
CO32-+CO2+H2O = 。
酸式盐→正盐的离子反应:
HCO3-+OH- = 或加热分解。
H2O+CO32-
2HCO3-
四、硅及其化合物
1.硅的结构及性质
(1)晶体结构:正四面体型空间网状结构,原子晶体。
(2)主要性质
①物理性质:熔点高,硬度大,具有金属光泽、半导体,只能以化合态存在于自然界。
②化学性质:
在常温下,除与F2、HF和强碱溶液反应外,硅不易和其他物质反应。
SiCl4+2H2 = Si+4HCl
Si+2NaOH+H2O = Na2SiO3+2H2↑
加热条件下,能与一些物质反应。
Si+O2 = SiO2
△
③Si的制备:
SiO2+2C = Si(粗硅)+2CO↑
高温
Si+2Cl2 = 2SiCl4,
高温
高温
2.二氧化硅
(1)存在广泛存在于自然界中(沙子、石英、水晶的主要成分均是二氧化硅)。
(2)物理性质纯SiO2是无色透明的晶体,硬度大、沸点高。
SiO2+2NaOH = Na2SiO3+H2O,
与CaO反应
SiO2+CaO = CaSiO3。
②和氢氟酸反应(腐蚀玻璃)
③在高温下,可与Na2CO3、CaCO3等碳酸盐反应。
(4)用途沙子用于建筑,石英用于制造玻璃,纯SiO2用于制造光学器材和光导纤维。
(3)化学性质
①酸性氧化物
与NaOH反应
高温
五、硅酸盐
(1)硅酸钠
大多数硅酸盐不溶于水,化学性质稳定。但硅酸钠可溶于水,其水溶液俗称“水玻璃”,可作黏合剂、防腐剂、防火剂。
普通玻璃 普通硅酸盐水泥 陶瓷
主要
原料 纯碱、石灰石、石英 石灰石、黏土、适量的石膏等 含铝、硅酸盐材料的黏土
主要
成分
及
用途 硅酸盐;各种用途的玻璃制品 硅酸盐;重要建筑材料 硅酸盐;应用于生活领域,工业、农业、航天、电子、原子能等领域
(2)硅酸盐产品
重点知识归纳
一、碳及其化合物转化关系
2.碳酸的电离平衡及跟碱的反应:
H2CO3 H++HCO-3
HCO-3 H++CO2-3
1.正盐与酸式盐相互转化:
碳酸碳酸 氢盐
盐酸性条件(H+)
碱性条件(OH-)或△(加热)
碱少时(酸过量)生成酸式盐,碱过量(酸少)生成正盐。
二、二氧化硅与二氧化碳
二氧化碳 二氧化硅
结构特点 由二氧化碳分子构成 由氧原子与硅原子
构成网状结构
物理性质 熔、沸点低、可溶于水 坚硬难熔的
固体、不溶于水
CO2+2NaOH =Na2CO3+H2O SiO2+2NaOH=
Na2SiO3+H2O
二氧化碳 二氧化硅
CO2+H2O=
H2CO3 不反应
CaO+CO2=
CaCO3
不反应 *4HF+SiO2=
SiF4↑+2H2O
用途 制饮料、制碳酸盐 光导纤维、光学仪器、电子部件
存在 空气 岩石、砂石、
水晶、硅藻土
高温
CaO+SiO2 = CaSiO3
三、硅及其化合物的特性
1.非金属单质一般不跟非氧化性酸反应,但Si能与HF反应。
2.非金属单质跟碱溶液反应一般无H2放出,但Si却能生成H2。
3.非金属单质一般为非导体,但Si为半导体。
4.SiO2是酸性氧化物,但它不溶于水,不能直接与H2O反应制备H2SiO3。
5.酸性氧化物一般不与酸反应,但SiO2能与HF反应。
6.无机酸一般易溶于水,但H2SiO3难溶于水。
(考查碳的化合物性质)向下列溶液中通入过量CO2,最终出现浑浊的是( )
A.饱和石灰水
B.水玻璃
C.BaCl2溶液
D.氯化钙饱和溶液
B
(考查硅的化合物性质)①浓硝酸、②水、③王水、④氢氟酸、⑤氢氧化钾溶液中,能与二氧化硅起化学反应的是( )
A.①② B.②④
C.④⑤ D.③④⑤
C
同课章节目录
