黑龙江省虎林市高级中学化学课件4.2 氯、溴、碘及其化合物
文档属性
| 名称 | 黑龙江省虎林市高级中学化学课件4.2 氯、溴、碘及其化合物 |

|
|
| 格式 | zip | ||
| 文件大小 | 272.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-29 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
第三节 氯、溴、碘及其化合物
基础知识回顾
一、氯气的性质
1.通常情况下,氯气是 色、有 气味、密度比空气大的有毒气体,能溶于水。
2.氯气的化学性质很活泼,是一种活泼的非金属单质和强氧化剂。
(1)跟金属反应(变价金属均氧化至最高价)
2Na+Cl2=2NaCl(现象:产生白烟)
点燃
Cu+Cl2=CuCl2(现象:产生棕黄色的烟)
点燃
2Fe+3Cl2=2FeCl3(现象:产生棕色的烟)
点燃
黄绿
刺激性
点燃:发出苍白色火焰,有白雾,工业制盐酸;
光照:会发生爆炸。
(2)跟非金属反应
点燃或光照
H2+Cl2 2HCl
(3)跟水的反应
Cl2+H2O HCl+HClO,离子方程式:
HClO是一元弱酸,酸性比H2CO3弱,不稳定易分解:
氯水保存方法:密封储存于棕色试剂瓶里。
2HClO=2HCl+O2↑
光照
. .
. .
Cl2+H2O = H++Cl-+HClO
主要成分为CaCl2和Ca(ClO)2,有效成分:Ca(ClO)2。漂白粉的作用原理
(4)跟碱反应
Cl2+2NaOH=NaCl+NaClO+H2O(制漂白液)
制漂白粉:
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ,
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(5)与还原性化合物反应
Cl2+2FeCl2=2FeCl3
Cl2+H2S=2HCl+S↓
Cl2+2KI=KCl+I2
Cl2+2NaBr=2NaCl+Br2
Cl2+SO2+2H2O=2HCl+H2SO4
(6)与有机物反应
Cl2+CH4 CH3Cl+HCl(取代)
光照
CH2=CH2+Cl2 CH2ClCH2Cl(加成)
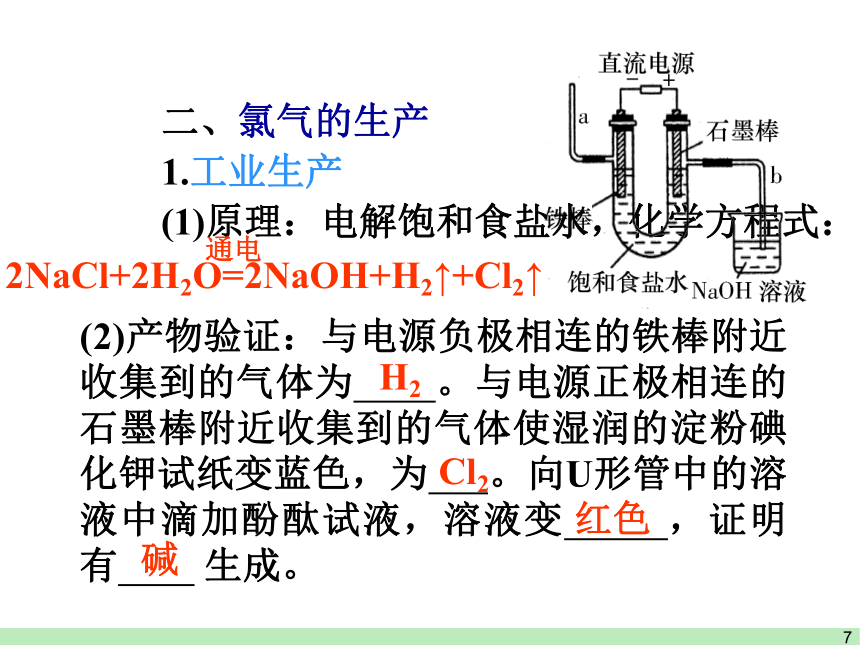
二、氯气的生产
1.工业生产
(1)原理:电解饱和食盐水,化学方程式:
(2)产物验证:与电源负极相连的铁棒附近收集到的气体为 。与电源正极相连的石墨棒附近收集到的气体使湿润的淀粉碘化钾试纸变蓝色,为 。向U形管中的溶液中滴加酚酞试液,溶液变 ,证明有 .生成。
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
通电
H2
Cl2
红色
碱
氯气的收集方法是向上排空气或排饱和食盐水;检验方法是使湿润碘化钾淀粉试纸变蓝或使湿润蓝色石蕊试纸先变红后褪色。
除杂:实验室制得的Cl2常含有HCl、H2O等杂质,通常使混合气体通过饱和食盐水,以除去HCl,再通过浓硫酸以除去H2O。
尾气处理:实验室制取Cl2时应防止尾气对空气的污染,多余的Cl2用NaOH溶液吸收。
2.实验室制法
实验室用二氧化锰和浓盐酸反应制得,化学方程式为:
MnO2+4HCl(浓)= MnCl2+Cl2↑+2H2O
△
实验室制氯气装置如下:
三、溴、碘的提取及性质
1.溴、碘的提取
(1)海水中的溴主要以Br-形式存在,被人们称为“海洋元素”,从海水中提取溴的一般过程为:
(2)海水中的碘浓度很低,一般从海产品,如海带中提取。
NaCl
Cl2
热空气或水蒸气
海水
母液
溴溶液
吹出
粗溴
精制
溴单质
水
氯气
干海带
浸泡液
氧化
过滤
提纯
碘单质
2.溴、碘的性质
(1)单质的物理性质
Br2 I2
颜色 深红棕色 紫黑色
状态 液体 固体
溶解性 水中 溶解度不大 溶解度不大
有机溶剂中 易溶 易溶
以上实验说明了三种单质间的氧化性强弱顺序为: 。
(2)化学性质——单质间的置换反应
Cl2+2KBr=2KCl+Br2
Cl2+2KI=2KCl+I2
Cl2与KBr反应:___________________
Cl2与KI反应:____________________
Br2与KI反应:____________________
Br2+2KI=2KBr+I2
Cl2>Br2>I2
1.氯气、液氯和氯水的比较
比较 氯气或液氯 氯水
组成成分 Cl2 Cl2、H2O、HClO、H+、
Cl-、ClO-(少)、OH-(少)
化学性质 强氧化性 ( Cl2、HClO)的强氧化性、
H+(酸性)等
主要用途 化工原料 杀菌、消毒、漂白
二、卤族元素
卤素原子最外层电子数均为7,最高价为+7价(氟除外),负价为-1价,均能形成气态氢化物(HX),最高价氧化物对应的水化物(HXO4)为酸(F除外)。卤素单质按F2、Cl2、Br2、I2的顺序,颜色加深,密度增大,熔沸点升高。从F→I随着原子序数的递增,卤素得电子能力逐渐减弱,元素的非金属性逐渐减弱。单质氧化性逐渐减弱,与H2化合由易到难,氢化物的稳定性减小,最高价氧化物对应水化物的酸性减弱,卤素离子或氢化物的还原性增强。
卤素的特殊性:①单质溴常温下为红棕色液体,极易挥发,实验室保存时常用水封,盛溴的试剂瓶不能用胶塞。②碘单质为紫黑色固体,加热易升华(用于分离),遇淀粉变蓝(用来检验),碘的氧化性较其他卤素单质弱,与变价金属铁反应生成FeI2。③F2在黑暗处就可与H2爆炸化合。④卤离子在溶液中与银离子生成的AgCl、AgBr、AgI分别为白色、浅黄色、黄色沉淀。
(考查氯及其化合物的性质)下列物质在空气中久置变质,在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是( )
A.食盐 B.氯化亚铁溶液
C.氯水 D.漂白粉
D
(考查卤素的性质)甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-、I-)。向甲中加淀粉溶液和氯水,则溶液变橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有( )
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I-、Br-
B
(考查有关氯的计算问题)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-和ClO-3的浓度之比为1∶3,则Cl2与NaOH反应时,被还原的氯元素与被氧化的氯元素物质的量之比为( )
A.21∶5 B.11∶3
C.3∶1 D.4∶1
D
第三节 氯、溴、碘及其化合物
基础知识回顾
一、氯气的性质
1.通常情况下,氯气是 色、有 气味、密度比空气大的有毒气体,能溶于水。
2.氯气的化学性质很活泼,是一种活泼的非金属单质和强氧化剂。
(1)跟金属反应(变价金属均氧化至最高价)
2Na+Cl2=2NaCl(现象:产生白烟)
点燃
Cu+Cl2=CuCl2(现象:产生棕黄色的烟)
点燃
2Fe+3Cl2=2FeCl3(现象:产生棕色的烟)
点燃
黄绿
刺激性
点燃:发出苍白色火焰,有白雾,工业制盐酸;
光照:会发生爆炸。
(2)跟非金属反应
点燃或光照
H2+Cl2 2HCl
(3)跟水的反应
Cl2+H2O HCl+HClO,离子方程式:
HClO是一元弱酸,酸性比H2CO3弱,不稳定易分解:
氯水保存方法:密封储存于棕色试剂瓶里。
2HClO=2HCl+O2↑
光照
. .
. .
Cl2+H2O = H++Cl-+HClO
主要成分为CaCl2和Ca(ClO)2,有效成分:Ca(ClO)2。漂白粉的作用原理
(4)跟碱反应
Cl2+2NaOH=NaCl+NaClO+H2O(制漂白液)
制漂白粉:
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ,
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(5)与还原性化合物反应
Cl2+2FeCl2=2FeCl3
Cl2+H2S=2HCl+S↓
Cl2+2KI=KCl+I2
Cl2+2NaBr=2NaCl+Br2
Cl2+SO2+2H2O=2HCl+H2SO4
(6)与有机物反应
Cl2+CH4 CH3Cl+HCl(取代)
光照
CH2=CH2+Cl2 CH2ClCH2Cl(加成)
二、氯气的生产
1.工业生产
(1)原理:电解饱和食盐水,化学方程式:
(2)产物验证:与电源负极相连的铁棒附近收集到的气体为 。与电源正极相连的石墨棒附近收集到的气体使湿润的淀粉碘化钾试纸变蓝色,为 。向U形管中的溶液中滴加酚酞试液,溶液变 ,证明有 .生成。
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
通电
H2
Cl2
红色
碱
氯气的收集方法是向上排空气或排饱和食盐水;检验方法是使湿润碘化钾淀粉试纸变蓝或使湿润蓝色石蕊试纸先变红后褪色。
除杂:实验室制得的Cl2常含有HCl、H2O等杂质,通常使混合气体通过饱和食盐水,以除去HCl,再通过浓硫酸以除去H2O。
尾气处理:实验室制取Cl2时应防止尾气对空气的污染,多余的Cl2用NaOH溶液吸收。
2.实验室制法
实验室用二氧化锰和浓盐酸反应制得,化学方程式为:
MnO2+4HCl(浓)= MnCl2+Cl2↑+2H2O
△
实验室制氯气装置如下:
三、溴、碘的提取及性质
1.溴、碘的提取
(1)海水中的溴主要以Br-形式存在,被人们称为“海洋元素”,从海水中提取溴的一般过程为:
(2)海水中的碘浓度很低,一般从海产品,如海带中提取。
NaCl
Cl2
热空气或水蒸气
海水
母液
溴溶液
吹出
粗溴
精制
溴单质
水
氯气
干海带
浸泡液
氧化
过滤
提纯
碘单质
2.溴、碘的性质
(1)单质的物理性质
Br2 I2
颜色 深红棕色 紫黑色
状态 液体 固体
溶解性 水中 溶解度不大 溶解度不大
有机溶剂中 易溶 易溶
以上实验说明了三种单质间的氧化性强弱顺序为: 。
(2)化学性质——单质间的置换反应
Cl2+2KBr=2KCl+Br2
Cl2+2KI=2KCl+I2
Cl2与KBr反应:___________________
Cl2与KI反应:____________________
Br2与KI反应:____________________
Br2+2KI=2KBr+I2
Cl2>Br2>I2
1.氯气、液氯和氯水的比较
比较 氯气或液氯 氯水
组成成分 Cl2 Cl2、H2O、HClO、H+、
Cl-、ClO-(少)、OH-(少)
化学性质 强氧化性 ( Cl2、HClO)的强氧化性、
H+(酸性)等
主要用途 化工原料 杀菌、消毒、漂白
二、卤族元素
卤素原子最外层电子数均为7,最高价为+7价(氟除外),负价为-1价,均能形成气态氢化物(HX),最高价氧化物对应的水化物(HXO4)为酸(F除外)。卤素单质按F2、Cl2、Br2、I2的顺序,颜色加深,密度增大,熔沸点升高。从F→I随着原子序数的递增,卤素得电子能力逐渐减弱,元素的非金属性逐渐减弱。单质氧化性逐渐减弱,与H2化合由易到难,氢化物的稳定性减小,最高价氧化物对应水化物的酸性减弱,卤素离子或氢化物的还原性增强。
卤素的特殊性:①单质溴常温下为红棕色液体,极易挥发,实验室保存时常用水封,盛溴的试剂瓶不能用胶塞。②碘单质为紫黑色固体,加热易升华(用于分离),遇淀粉变蓝(用来检验),碘的氧化性较其他卤素单质弱,与变价金属铁反应生成FeI2。③F2在黑暗处就可与H2爆炸化合。④卤离子在溶液中与银离子生成的AgCl、AgBr、AgI分别为白色、浅黄色、黄色沉淀。
(考查氯及其化合物的性质)下列物质在空气中久置变质,在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是( )
A.食盐 B.氯化亚铁溶液
C.氯水 D.漂白粉
D
(考查卤素的性质)甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-、I-)。向甲中加淀粉溶液和氯水,则溶液变橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有( )
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I-、Br-
B
(考查有关氯的计算问题)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-和ClO-3的浓度之比为1∶3,则Cl2与NaOH反应时,被还原的氯元素与被氧化的氯元素物质的量之比为( )
A.21∶5 B.11∶3
C.3∶1 D.4∶1
D
同课章节目录
