第二单元 课题3 制取氧气(共35张PPT)人教版九年级化学上册
文档属性
| 名称 | 第二单元 课题3 制取氧气(共35张PPT)人教版九年级化学上册 |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-09 11:01:27 | ||
图片预览








文档简介
(共35张PPT)
观察与思考
潜水员在潜水时总是在身后背着一个氧气瓶。你知道氧气瓶中的氧气是怎样制取的吗?
课题3
制取氧气
第二单元
我们周围的空气
导入新课
讲授新课
课堂小结
随堂训练
1.初步学习在实验室制取氧气的原理和方法。(重点)
3.知道什么是分解反应。(重点)
2.了解催化剂的概念和催化剂的作用。(重点)
学习目标
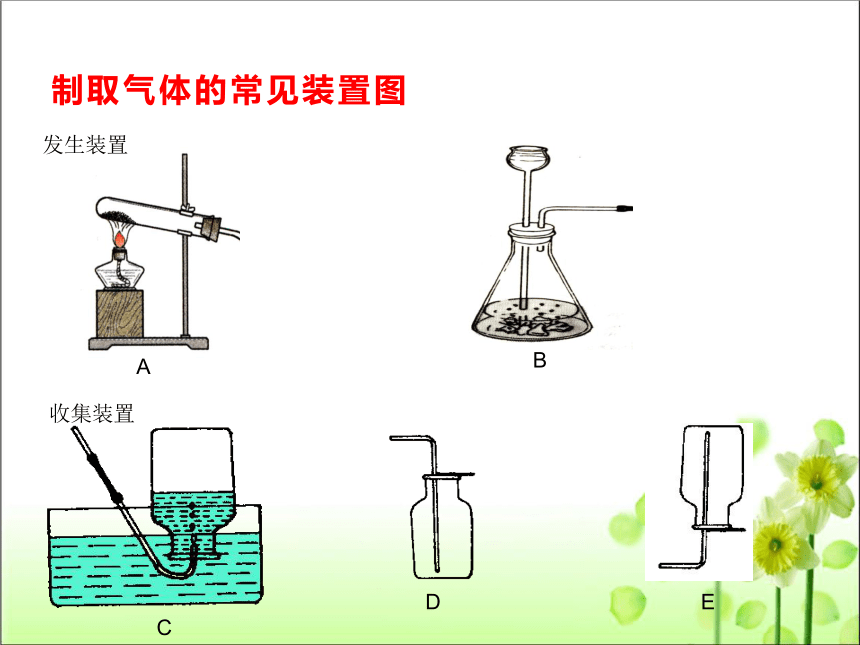
制取气体的常见装置图
发生装置
收集装置
A
B
C
D
E
反应物状态:
反应条件:
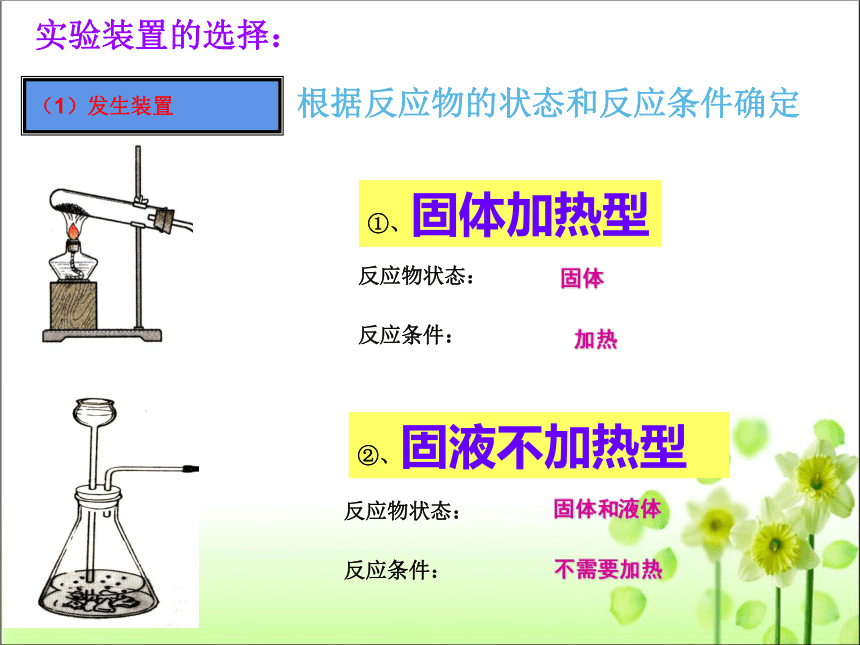
②、固液不加热型
①、固体加热型
固体
加热
固体和液体
不需要加热
实验装置的选择:
根据反应物的状态和反应条件确定
(1)发生装置
反应物状态:
反应条件:
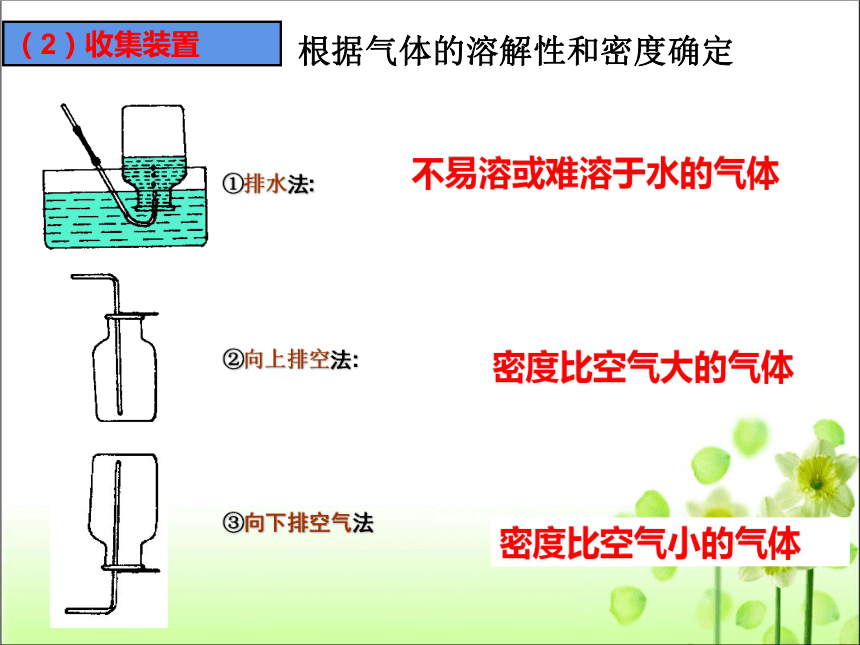
密度比空气大的气体
(2)收集装置
①排水法:
②向上排空法:
不易溶或难溶于水的气体
③向下排空气法
根据气体的溶解性和密度确定
密度比空气小的气体
思考:我们知道氧气有许多用途,那么我们如何制取氧气呢?
常用药品及其颜色
过氧化氢溶液
H2O2
(无色液体)
高锰酸钾
KMnO4
(紫黑色固体)
氯酸钾KClO3
(白色固体)
二氧化锰
MnO2
(黑色固体)
目标导学一:实验室制取氧气
分解过氧化氢(H2O2)
加热氯酸钾(KClO3)
加热高锰酸钾(KMnO4)
实验室制取氧气的方法:
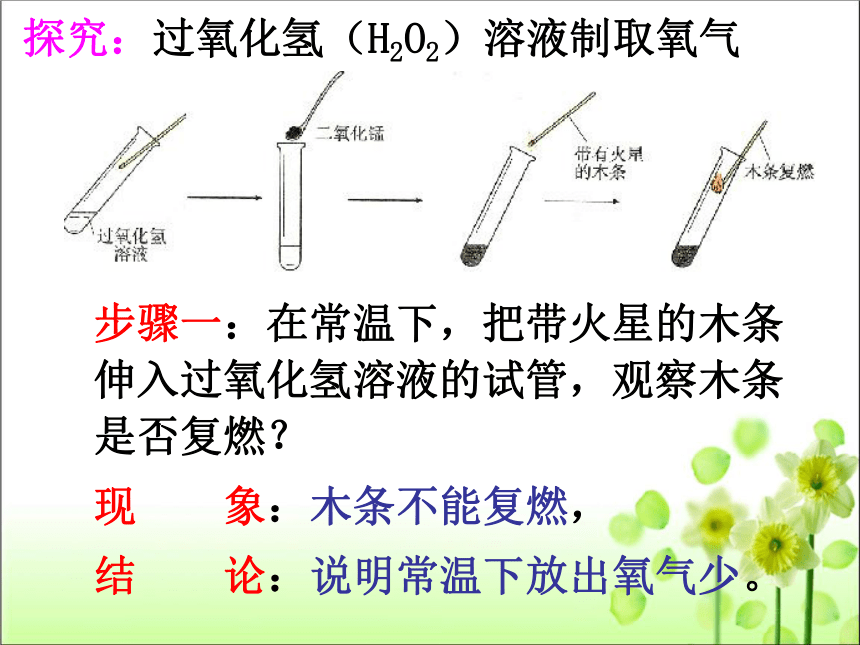
步骤一:在常温下,把带火星的木条伸入过氧化氢溶液的试管,观察木条是否复燃?
现
象:木条不能复燃,
结
论:说明常温下放出氧气少。
探究:过氧化氢(H2O2)溶液制取氧气
步骤二:向上述试管中,加入少量二氧化锰,把带火星的木条伸入试管。观察发生的现象。
现
象:木条复燃了
结
论:说明在常温下过氧化氢溶液遇到二氧化锰(MnO2)时迅速产生氧气。
步骤三:反应停止后,重新加入过氧化氢溶液,把带火星的木条伸入试管。观察发生的现象。
现
象:木条复燃了
结
论:说明二氧化锰(MnO2)仍然起作用时产生氧气。
催化剂:在化学反应里能改变其他物质的化学反应速率,而本身质量和化学性质在化学反应前后都没有发生变化的物质。催化剂的特点
一
变:化学反应速率变
二不变:质量不变、化学性质不变
加热氯酸钾制取氧气
【实验步骤】
将氯酸钾和二氧化锰混合后放入小试管中加热,用带火星的小木条检验。
带火星的木条复燃。
反应表达式:
氯酸钾
氯化钾+氧气
二氧化锰
加热
发生装置
收集装置
试管底部略高于管口,防止湿存水倒流炸裂试管
先预热,再用酒精灯外焰加热
铁夹夹在试管中上部,距管口1/3处
管口塞棉花,防止高锰酸钾粉末堵塞导管或影响实验(氯酸钾不塞棉花)
导气管出胶塞少许即可
导气管放集气瓶口,当连续均匀气泡冒出时才开始收集
高锰酸钾制取氧气
用高锰酸钾制氧实验步骤
1、检查装置气密性
2、装药品,塞棉花,塞带导管的塞子
3、固定装置在铁架台上,准备集气瓶
4、点燃酒精灯给试管加热
5、收集氧气
6、把导管移离水槽
7、熄灭酒精灯,停止加热
下面我们将亲自体验制取氧气并收集氧气,再用氧气试验氧气的化学性质
操作步骤
操作方法及注意事项
检查装置气密性
将导管一端浸入水中,用手紧握试管外壁,若水中导管口有手泡放出,证明装置不漏气。否则,应塞紧或更换橡皮塞
药品装入试管
按固体药品的取用方法,取少量高锰酸钾装入试管,平铺在试管底部,管口塞一团棉花,防固体颗粒随氧气排出进入水槽或堵塞导管
将试管固定在铁架台上
点燃酒精灯加热
先使酒精灯火焰在试管下方来回移动,让试管均匀受热,然后对准试管中的药品部位加热
排水法收集氧气
集气瓶内装满水,不留空气泡,当导管口产生连续气泡时才开始收集,瓶中水排尽,瓶颈氧气集满
收集完毕导管撤离水槽
熄灭酒精灯
当导管撤离水槽后才能熄灭酒精灯,否则水会倒流入试管,使试管炸裂
铁夹夹在距试管口1/3处,试管口略向下倾斜
导管不离开水槽不能熄灭酒精灯
氯酸钾
氯化钾
+
氧气
二氧化锰
加热
KClO3
KCl
+
O2
MnO2
加热
文字表达式
符号表达式
(1)用排水法收集:当集气瓶的一侧有气泡放出时,证
明已收集满。
(2)用向上排空气法收集:将带火星的木条放在集气瓶
口,若木条复燃,证明已收集满。
实验与探究
验满方法
实验与探究
实验室制取氧气的反应装置:
分解氯酸钾制取氧气
分解高锰酸钾制取氧气
分解过氧化氢制取氧气
观察与思考
实验室制取氧气的反应原理:
上述三个反应的共同点有哪些?它们属于哪种反应类型?
(2)
加热
高锰酸钾
KMnO4
锰酸钾
K2MnO4
O2
氧气
+
+
二氧化锰
MnO2
二氧化锰
(3)
过氧化氢
H2O2
O2
氧气
+
水
H2O
(1)
氯酸钾
KClO3
氯化钾
KCl
+
氧气
O2
二氧化锰
加热
目标导学二:分解反应
化合反应与分解反应的特点可以表示如下:
化合反应:A
+
B
→
AB
分解反应:AB
→
A
+
B
分解反应
由一种反应物生成两种或两种以上其他物质的反应。
归纳与小结
硫+氧气
二氧化硫
点燃
铝+氧气
氧化铝
点燃
分解反应、化合反应、氧化反应
高锰酸钾
锰酸钾+二氧化锰+氧气
加热
氯酸钾
氯化钾+氧气
二氧化锰
加热
化合反应
分解反应
氧化反应
不是氧化反应
催化剂
【说明】此反应中,二氧化锰既不是反应物也不是生成物,只是一种催化剂,应算作一个反应条件,所以二氧化锰写在箭头的上方。
催化作用
催化剂在化学反应中所起的作用叫催化作用。
过氧化氢
水+氧气
二氧化锰
催化剂可以重复使用。除了二氧化锰外,活性炭、氧化铜、氧化铁、硫酸铜溶液、酶都可以作为催化剂。
应用:生产汽油、煤油;酿造业(酿酒)、制药业等都用生物酶作催化剂
例:下列对催化剂描述正确的是
(
)
A.任何化学反应都需要催化剂
B.催化剂在反应前后本身质量发生了变化
C.只有分解反应才需要催化剂
D.某些化学反应可以有很多种催化剂
观察与思考
思考2:工业制取氧气与实验室制取氧气在反应类型上是否相同?
思考1:工业上如何大量制取氧气?
目标导学三:氧气的工业制法
氧气的工业制法:
分离液态空气法
(物理变化)
空气
降温
加压
液态空气
贮在天蓝色钢瓶中
氮气
液态氧
蒸发
-196?C
~
-183?C
1.5×107Pa
根据液态氮与液态氧的沸点不同。
实验室
制取氧气
高锰酸钾
锰酸钾+二氧化锰+氧气
加热
过氧化氢
水+氧气
二氧化锰
氯酸钾
氯化钾+氧气
二氧化锰
加热
检验:将带火星的木条放入瓶内,木条复燃,说明是氧气。
验满:将带火星的木条放在瓶口,木条复燃,说明已收集满。
分解反应
催化剂
一变
两不变
课堂小结
1、工业上制取大量氧气的方法是
(
)
A
加热氯酸钾
B
加热高锰酸钾
C
分离液态空气
D
加热二氧化锰
C
检测目标
2.实验室制取氧气时,装药品的大试管口应(
)
A.朝下
B.朝上
C.略向下倾斜
D.略向上倾斜
C
检测目标
3、催化剂在化学反应中所起的作用是(
)
A
加快化学反应速率
B
使生成物质量增加
C
改变化学反应速率
D
减慢化学反应速率
C
检测目标
4.下列化学反应中,属于氧化反应的是(
),属于化合反应的是(
)属于分解反应的是(
)
A.甲烷+氧气
水+二氧化碳
B.水
氢气+氧气
C.氧气+二氧化碳+铜+水
碱式碳酸铜
D.氯酸钾
氯化钾+氧气
点燃
通电
加热
二氧化锰
AC
C
BD
检测目标
5、实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在(
)
A
加热固体药品前
B
与加热固体药品同时
C
开始有气泡放出时
D
气泡连续并均匀放出时
检测目标
D
课堂总结
同学们,本节课你收获了什么?
1.再读教材,加深理解
2.
同步检测题
观察与思考
潜水员在潜水时总是在身后背着一个氧气瓶。你知道氧气瓶中的氧气是怎样制取的吗?
课题3
制取氧气
第二单元
我们周围的空气
导入新课
讲授新课
课堂小结
随堂训练
1.初步学习在实验室制取氧气的原理和方法。(重点)
3.知道什么是分解反应。(重点)
2.了解催化剂的概念和催化剂的作用。(重点)
学习目标
制取气体的常见装置图
发生装置
收集装置
A
B
C
D
E
反应物状态:
反应条件:
②、固液不加热型
①、固体加热型
固体
加热
固体和液体
不需要加热
实验装置的选择:
根据反应物的状态和反应条件确定
(1)发生装置
反应物状态:
反应条件:
密度比空气大的气体
(2)收集装置
①排水法:
②向上排空法:
不易溶或难溶于水的气体
③向下排空气法
根据气体的溶解性和密度确定
密度比空气小的气体
思考:我们知道氧气有许多用途,那么我们如何制取氧气呢?
常用药品及其颜色
过氧化氢溶液
H2O2
(无色液体)
高锰酸钾
KMnO4
(紫黑色固体)
氯酸钾KClO3
(白色固体)
二氧化锰
MnO2
(黑色固体)
目标导学一:实验室制取氧气
分解过氧化氢(H2O2)
加热氯酸钾(KClO3)
加热高锰酸钾(KMnO4)
实验室制取氧气的方法:
步骤一:在常温下,把带火星的木条伸入过氧化氢溶液的试管,观察木条是否复燃?
现
象:木条不能复燃,
结
论:说明常温下放出氧气少。
探究:过氧化氢(H2O2)溶液制取氧气
步骤二:向上述试管中,加入少量二氧化锰,把带火星的木条伸入试管。观察发生的现象。
现
象:木条复燃了
结
论:说明在常温下过氧化氢溶液遇到二氧化锰(MnO2)时迅速产生氧气。
步骤三:反应停止后,重新加入过氧化氢溶液,把带火星的木条伸入试管。观察发生的现象。
现
象:木条复燃了
结
论:说明二氧化锰(MnO2)仍然起作用时产生氧气。
催化剂:在化学反应里能改变其他物质的化学反应速率,而本身质量和化学性质在化学反应前后都没有发生变化的物质。催化剂的特点
一
变:化学反应速率变
二不变:质量不变、化学性质不变
加热氯酸钾制取氧气
【实验步骤】
将氯酸钾和二氧化锰混合后放入小试管中加热,用带火星的小木条检验。
带火星的木条复燃。
反应表达式:
氯酸钾
氯化钾+氧气
二氧化锰
加热
发生装置
收集装置
试管底部略高于管口,防止湿存水倒流炸裂试管
先预热,再用酒精灯外焰加热
铁夹夹在试管中上部,距管口1/3处
管口塞棉花,防止高锰酸钾粉末堵塞导管或影响实验(氯酸钾不塞棉花)
导气管出胶塞少许即可
导气管放集气瓶口,当连续均匀气泡冒出时才开始收集
高锰酸钾制取氧气
用高锰酸钾制氧实验步骤
1、检查装置气密性
2、装药品,塞棉花,塞带导管的塞子
3、固定装置在铁架台上,准备集气瓶
4、点燃酒精灯给试管加热
5、收集氧气
6、把导管移离水槽
7、熄灭酒精灯,停止加热
下面我们将亲自体验制取氧气并收集氧气,再用氧气试验氧气的化学性质
操作步骤
操作方法及注意事项
检查装置气密性
将导管一端浸入水中,用手紧握试管外壁,若水中导管口有手泡放出,证明装置不漏气。否则,应塞紧或更换橡皮塞
药品装入试管
按固体药品的取用方法,取少量高锰酸钾装入试管,平铺在试管底部,管口塞一团棉花,防固体颗粒随氧气排出进入水槽或堵塞导管
将试管固定在铁架台上
点燃酒精灯加热
先使酒精灯火焰在试管下方来回移动,让试管均匀受热,然后对准试管中的药品部位加热
排水法收集氧气
集气瓶内装满水,不留空气泡,当导管口产生连续气泡时才开始收集,瓶中水排尽,瓶颈氧气集满
收集完毕导管撤离水槽
熄灭酒精灯
当导管撤离水槽后才能熄灭酒精灯,否则水会倒流入试管,使试管炸裂
铁夹夹在距试管口1/3处,试管口略向下倾斜
导管不离开水槽不能熄灭酒精灯
氯酸钾
氯化钾
+
氧气
二氧化锰
加热
KClO3
KCl
+
O2
MnO2
加热
文字表达式
符号表达式
(1)用排水法收集:当集气瓶的一侧有气泡放出时,证
明已收集满。
(2)用向上排空气法收集:将带火星的木条放在集气瓶
口,若木条复燃,证明已收集满。
实验与探究
验满方法
实验与探究
实验室制取氧气的反应装置:
分解氯酸钾制取氧气
分解高锰酸钾制取氧气
分解过氧化氢制取氧气
观察与思考
实验室制取氧气的反应原理:
上述三个反应的共同点有哪些?它们属于哪种反应类型?
(2)
加热
高锰酸钾
KMnO4
锰酸钾
K2MnO4
O2
氧气
+
+
二氧化锰
MnO2
二氧化锰
(3)
过氧化氢
H2O2
O2
氧气
+
水
H2O
(1)
氯酸钾
KClO3
氯化钾
KCl
+
氧气
O2
二氧化锰
加热
目标导学二:分解反应
化合反应与分解反应的特点可以表示如下:
化合反应:A
+
B
→
AB
分解反应:AB
→
A
+
B
分解反应
由一种反应物生成两种或两种以上其他物质的反应。
归纳与小结
硫+氧气
二氧化硫
点燃
铝+氧气
氧化铝
点燃
分解反应、化合反应、氧化反应
高锰酸钾
锰酸钾+二氧化锰+氧气
加热
氯酸钾
氯化钾+氧气
二氧化锰
加热
化合反应
分解反应
氧化反应
不是氧化反应
催化剂
【说明】此反应中,二氧化锰既不是反应物也不是生成物,只是一种催化剂,应算作一个反应条件,所以二氧化锰写在箭头的上方。
催化作用
催化剂在化学反应中所起的作用叫催化作用。
过氧化氢
水+氧气
二氧化锰
催化剂可以重复使用。除了二氧化锰外,活性炭、氧化铜、氧化铁、硫酸铜溶液、酶都可以作为催化剂。
应用:生产汽油、煤油;酿造业(酿酒)、制药业等都用生物酶作催化剂
例:下列对催化剂描述正确的是
(
)
A.任何化学反应都需要催化剂
B.催化剂在反应前后本身质量发生了变化
C.只有分解反应才需要催化剂
D.某些化学反应可以有很多种催化剂
观察与思考
思考2:工业制取氧气与实验室制取氧气在反应类型上是否相同?
思考1:工业上如何大量制取氧气?
目标导学三:氧气的工业制法
氧气的工业制法:
分离液态空气法
(物理变化)
空气
降温
加压
液态空气
贮在天蓝色钢瓶中
氮气
液态氧
蒸发
-196?C
~
-183?C
1.5×107Pa
根据液态氮与液态氧的沸点不同。
实验室
制取氧气
高锰酸钾
锰酸钾+二氧化锰+氧气
加热
过氧化氢
水+氧气
二氧化锰
氯酸钾
氯化钾+氧气
二氧化锰
加热
检验:将带火星的木条放入瓶内,木条复燃,说明是氧气。
验满:将带火星的木条放在瓶口,木条复燃,说明已收集满。
分解反应
催化剂
一变
两不变
课堂小结
1、工业上制取大量氧气的方法是
(
)
A
加热氯酸钾
B
加热高锰酸钾
C
分离液态空气
D
加热二氧化锰
C
检测目标
2.实验室制取氧气时,装药品的大试管口应(
)
A.朝下
B.朝上
C.略向下倾斜
D.略向上倾斜
C
检测目标
3、催化剂在化学反应中所起的作用是(
)
A
加快化学反应速率
B
使生成物质量增加
C
改变化学反应速率
D
减慢化学反应速率
C
检测目标
4.下列化学反应中,属于氧化反应的是(
),属于化合反应的是(
)属于分解反应的是(
)
A.甲烷+氧气
水+二氧化碳
B.水
氢气+氧气
C.氧气+二氧化碳+铜+水
碱式碳酸铜
D.氯酸钾
氯化钾+氧气
点燃
通电
加热
二氧化锰
AC
C
BD
检测目标
5、实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在(
)
A
加热固体药品前
B
与加热固体药品同时
C
开始有气泡放出时
D
气泡连续并均匀放出时
检测目标
D
课堂总结
同学们,本节课你收获了什么?
1.再读教材,加深理解
2.
同步检测题
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
