2021-2022学年高二化学人教版(2019)选择性必修13.4.1难溶电解质的沉淀溶解平衡 课件 (19张ppt)
文档属性
| 名称 | 2021-2022学年高二化学人教版(2019)选择性必修13.4.1难溶电解质的沉淀溶解平衡 课件 (19张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 752.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-10 19:47:33 | ||
图片预览






文档简介
(共19张PPT)
第三章
水溶液中的离子反应与平衡
第四节
沉淀溶解平衡
第1课时
难溶电解质的沉淀溶解平衡
1.能描述沉淀溶解平衡,知道溶解平衡的特征。
2.根据化学平衡理论,分析影响沉淀溶解平衡的因素。
课程目标
变化观念与平衡思想
学科素养
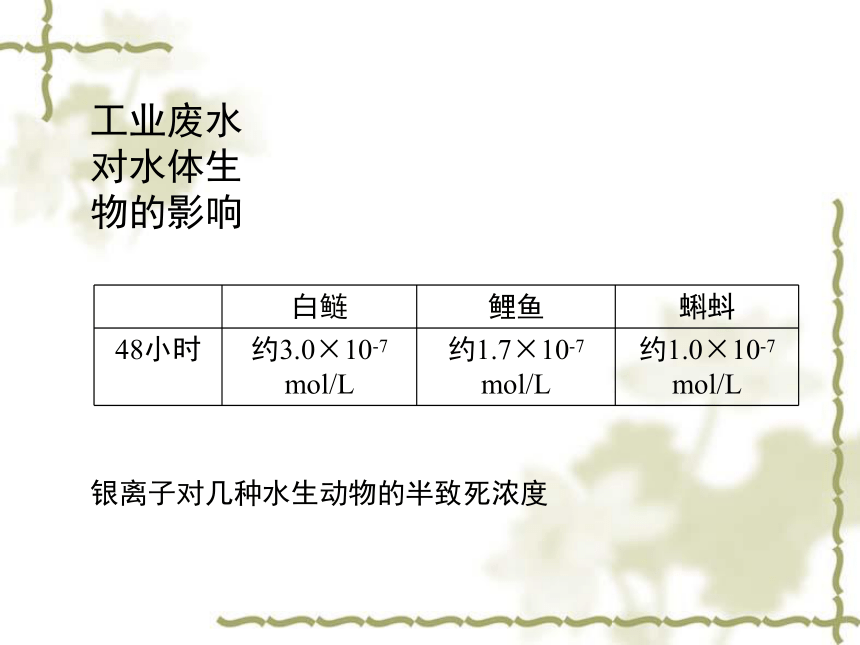
工业废水对水体生物的影响
白鲢
鲤鱼
蝌蚪
48小时
约3.0×10-7
mol/L
约1.7×10-7
mol/L
约1.0×10-7
mol/L
银离子对几种水生动物的半致死浓度
几种电解质的溶解度(20℃)
化学式
溶解度/g
化学式
溶解度/g
AgCl
1.5×10-4
Ba(OH)2
3.89
AgNO3
222
BaSO4
2.4×10-4
AgBr
8.4×10-6
Ca(OH)2
0.165
Ag2SO4
0.796
CaSO4
0.21
Ag2S
1.3×10-16
Mg(OH)2
9×10-4
BaCl2
35.7
Fe(OH)3
3×10-9
查阅资料
思考:生成AgCl沉淀的离子反应完成后,溶液中是否还有Ag+?
人们习惯上将溶解度小于0.01g的电解质称为难溶电解质。尽管难溶电解质的溶解质的溶解度很小,但在水中并不是绝对不溶。
分析过程
AgCl
得出结论
生成AgCl沉淀后,AgCl(s)、Ag+(aq)、Cl-(aq)共存
沉淀溶解平衡的建立
v溶解
v沉淀
,固体溶解;
v溶解
v沉淀
,溶解平衡;
v溶解
v沉淀
,析出晶体。
>
=
<
在一定温度下,当沉淀溶解和生成的速率
时,即达到了沉淀溶解平衡。
沉淀溶解平衡
概念
相等
特征
可逆
动态
=
离子浓度
表达式
难溶电解质用“s”标明状态,溶液中的离子用“
”标明状态,并用“
”连接。
aq
练习
请写出BaSO4、CaCO3、Ag2S的沉淀溶解平衡表达式。
Ag2S(s)
2Ag+(aq)
+
S2-(aq)
CaCO3(s)
Ca2+(aq)
+
CO
(aq)
2?
3
BaSO4(s)
Ba2+(aq)
+
SO
(aq)
2?
4
上述1
mL
0.012
mol/L的
NaCl溶液与1
mL
0.010
mol/L
AgNO3溶液充分反应后,溶液中剩余Ag+的浓度是多少?
涉及化学平衡的计算常需要哪些数据?
活动二
在一定温度下,沉淀达溶解平衡后的溶液为
溶液,其离子浓度
,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用
表示。
溶度积
饱和
不再发生变化
Ksp
Ag2S(s)
2Ag+(aq)
+
S2-(aq)
Ksp
=
c2(Ag+)·c(S2-
)
常见难溶电解质的溶度积常数(25
℃)
化学式
Ksp
化学式
Ksp
AgCl
1.8×10-10
CuS
6.3×10-36
AgBr
5.4×10-13
ZnS
1.6×10-24
AgI
8.5×10-17
PbS
8.0×10-28
Ag2S
6.3×10-50
FeS
6.3×10-18
Ag2SO4
1.2×10-5
HgS
1.6×10-52
观察发现
关于溶度积(Ksp)几点说明:
①Ksp反映了难溶电解质在水中的溶解能力。
Ksp越小,越难溶。
对同类型的难溶电解质,如AgCl、AgBr、AgI,在相同温度下,Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI),则溶解度
。
S(AgCl)<S(AgBr)<S(AgI)
②Ksp与温度有关。
其它条件一定时,一般温度越高,Ksp越大。
通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:
①Qc>Ksp,溶液过饱和,有
析出,直至溶液饱和,达到新的平衡。
②Qc=Ksp,溶液饱和,沉淀与溶解处于
。
③Qc析出,若加入过量难溶电解质,难溶电解质
直至溶液
。
沉淀
平衡状态
沉淀
溶解
饱和
【计算】
1
mL
0.012
mol/L
NaCl溶液与1
mL
0.010
mol/L
AgNO3溶液充分反应后剩余Ag+的浓度为(忽略溶液体积变化):
c(Cl-)
=
1
mL×0.012
mol/L-1
mL×0.010
mol/L
1
mL+1
mL
=
0.001
mol/L
c(Ag+)
=
Ksp
c(Cl-)
=
1.8×10-7
mol/L
=
0.001
1.8×10-10
根据:
Ksp
=
c(Ag+)·c(Cl-)
=
1.8×10-10
国家各行业污染物排放标准中,规定了不同的Ag+
排放标准,例如有些行业规定不能超过约1×10-7
mol/L。
一般情况,当溶液中剩余离子的浓度小于1×10-5
mol/L时,化学上通常认为生成沉淀的反应就进行完全了。
根据本节课所学内容,请思考如何使沉淀反应完成后,溶液中的Ag+浓度能够尽量小?
你能想出几种办法?
活动三
沉淀溶解平衡的影响因素
内因:难溶电解质本身的性质,这是决定因素。
外因:
温度——绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向
方向移动;少量平衡向生成沉淀的方向移动,如
的沉淀溶解平衡。
浓度——加水稀释,平衡向
的方向移动
同离子效应——向平衡体系中加入难溶物相应的离子,平衡向
的方向移动
其他——向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向
的方向移动
沉淀溶解
Ca(OH)2
溶解
生成沉淀
溶解
Thank
you
for
watching
!
本部分内容讲解结束
第三章
水溶液中的离子反应与平衡
第四节
沉淀溶解平衡
第1课时
难溶电解质的沉淀溶解平衡
1.能描述沉淀溶解平衡,知道溶解平衡的特征。
2.根据化学平衡理论,分析影响沉淀溶解平衡的因素。
课程目标
变化观念与平衡思想
学科素养
工业废水对水体生物的影响
白鲢
鲤鱼
蝌蚪
48小时
约3.0×10-7
mol/L
约1.7×10-7
mol/L
约1.0×10-7
mol/L
银离子对几种水生动物的半致死浓度
几种电解质的溶解度(20℃)
化学式
溶解度/g
化学式
溶解度/g
AgCl
1.5×10-4
Ba(OH)2
3.89
AgNO3
222
BaSO4
2.4×10-4
AgBr
8.4×10-6
Ca(OH)2
0.165
Ag2SO4
0.796
CaSO4
0.21
Ag2S
1.3×10-16
Mg(OH)2
9×10-4
BaCl2
35.7
Fe(OH)3
3×10-9
查阅资料
思考:生成AgCl沉淀的离子反应完成后,溶液中是否还有Ag+?
人们习惯上将溶解度小于0.01g的电解质称为难溶电解质。尽管难溶电解质的溶解质的溶解度很小,但在水中并不是绝对不溶。
分析过程
AgCl
得出结论
生成AgCl沉淀后,AgCl(s)、Ag+(aq)、Cl-(aq)共存
沉淀溶解平衡的建立
v溶解
v沉淀
,固体溶解;
v溶解
v沉淀
,溶解平衡;
v溶解
v沉淀
,析出晶体。
>
=
<
在一定温度下,当沉淀溶解和生成的速率
时,即达到了沉淀溶解平衡。
沉淀溶解平衡
概念
相等
特征
可逆
动态
=
离子浓度
表达式
难溶电解质用“s”标明状态,溶液中的离子用“
”标明状态,并用“
”连接。
aq
练习
请写出BaSO4、CaCO3、Ag2S的沉淀溶解平衡表达式。
Ag2S(s)
2Ag+(aq)
+
S2-(aq)
CaCO3(s)
Ca2+(aq)
+
CO
(aq)
2?
3
BaSO4(s)
Ba2+(aq)
+
SO
(aq)
2?
4
上述1
mL
0.012
mol/L的
NaCl溶液与1
mL
0.010
mol/L
AgNO3溶液充分反应后,溶液中剩余Ag+的浓度是多少?
涉及化学平衡的计算常需要哪些数据?
活动二
在一定温度下,沉淀达溶解平衡后的溶液为
溶液,其离子浓度
,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用
表示。
溶度积
饱和
不再发生变化
Ksp
Ag2S(s)
2Ag+(aq)
+
S2-(aq)
Ksp
=
c2(Ag+)·c(S2-
)
常见难溶电解质的溶度积常数(25
℃)
化学式
Ksp
化学式
Ksp
AgCl
1.8×10-10
CuS
6.3×10-36
AgBr
5.4×10-13
ZnS
1.6×10-24
AgI
8.5×10-17
PbS
8.0×10-28
Ag2S
6.3×10-50
FeS
6.3×10-18
Ag2SO4
1.2×10-5
HgS
1.6×10-52
观察发现
关于溶度积(Ksp)几点说明:
①Ksp反映了难溶电解质在水中的溶解能力。
Ksp越小,越难溶。
对同类型的难溶电解质,如AgCl、AgBr、AgI,在相同温度下,Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI),则溶解度
。
S(AgCl)<S(AgBr)<S(AgI)
②Ksp与温度有关。
其它条件一定时,一般温度越高,Ksp越大。
通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:
①Qc>Ksp,溶液过饱和,有
析出,直至溶液饱和,达到新的平衡。
②Qc=Ksp,溶液饱和,沉淀与溶解处于
。
③Qc
直至溶液
。
沉淀
平衡状态
沉淀
溶解
饱和
【计算】
1
mL
0.012
mol/L
NaCl溶液与1
mL
0.010
mol/L
AgNO3溶液充分反应后剩余Ag+的浓度为(忽略溶液体积变化):
c(Cl-)
=
1
mL×0.012
mol/L-1
mL×0.010
mol/L
1
mL+1
mL
=
0.001
mol/L
c(Ag+)
=
Ksp
c(Cl-)
=
1.8×10-7
mol/L
=
0.001
1.8×10-10
根据:
Ksp
=
c(Ag+)·c(Cl-)
=
1.8×10-10
国家各行业污染物排放标准中,规定了不同的Ag+
排放标准,例如有些行业规定不能超过约1×10-7
mol/L。
一般情况,当溶液中剩余离子的浓度小于1×10-5
mol/L时,化学上通常认为生成沉淀的反应就进行完全了。
根据本节课所学内容,请思考如何使沉淀反应完成后,溶液中的Ag+浓度能够尽量小?
你能想出几种办法?
活动三
沉淀溶解平衡的影响因素
内因:难溶电解质本身的性质,这是决定因素。
外因:
温度——绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向
方向移动;少量平衡向生成沉淀的方向移动,如
的沉淀溶解平衡。
浓度——加水稀释,平衡向
的方向移动
同离子效应——向平衡体系中加入难溶物相应的离子,平衡向
的方向移动
其他——向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向
的方向移动
沉淀溶解
Ca(OH)2
溶解
生成沉淀
溶解
Thank
you
for
watching
!
本部分内容讲解结束
