2021-2022学年高二化学人教版(2019)选择性必修1第二章 第一节 化学反应速率第3课时 活 化 能(21张ppt)
文档属性
| 名称 | 2021-2022学年高二化学人教版(2019)选择性必修1第二章 第一节 化学反应速率第3课时 活 化 能(21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-10 19:51:31 | ||
图片预览







文档简介
第一节 化学反应速率第3课时 活 化 能
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.知道化学反应是有历程的;
2.认识基元反应活化能对化学反应速率的影响;
3.能用一定的理论模型说明外界条件改变对化学反应速率的影响。
1.证据推理与模型认知:能根据碰撞理论模型推断温度、浓度、催化剂等是如何影响化学反应速率的。
2.科学探究与创新意识:初步形成探究化学规律的思路与方法,发展创造性体验和想象创新能力。
引入新课
不同的化学反应,反应速率千差万别。
例如溶洞的形成、气体的爆炸。
绝大多数的化学反应,并不是简单一步就完成的,化学反应是有历程的。
同一反应,条件不同,反应速率也会有很大不同。
你对“化学反应是有历程的”这一说法有哪些认识?
分步进行
时间
研究发现大多数化学反应不是经过简单碰撞完成的,而是经过多个反应步骤。
问题思考
2HI===H2+I2
2HI → H2+2I·
2I· → I2
一、有效碰撞理论
基元反应
大多数的化学反应往往经过多个反应步骤才能实现,每一步反应都称为基元反应。
反应机理
先后进行的基元反应反映了化学反应的反应历程,反应历程又称反应机理。
1.基元反应和反应历程
自由基
带有单电子的原子或原子团
分两步
2.基元反应发生的条件
是什么启动了“基元反应” ?
※ 先决条件是反应物的分子必须发生碰撞 。
反应分子的每一次碰撞都能发生化学反应吗?
※ 反应物分子必须具有一定的能量;
※ 碰撞时有合适的取向。
通常情况下,当气体的浓度为1 mol/L时,在每立方厘米、每秒内反应物分子间的碰撞可达到1028次。如果反应物分子间的任何一次碰撞都能发生反应的话,反应只需10-5 s就可以完成。换言之,任何气体的反应均可以瞬间完成。但实际并非如此。
一、有效碰撞理论
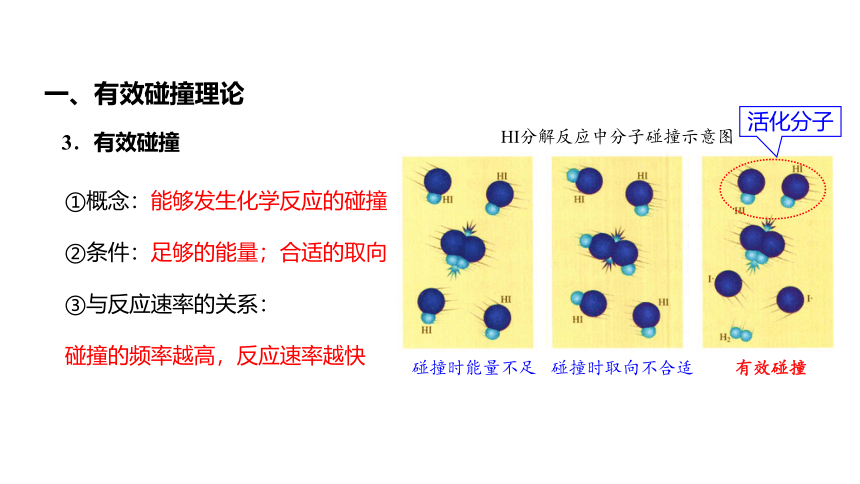
HI分解反应中分子碰撞示意图
3.有效碰撞
碰撞时能量不足
碰撞时取向不合适
有效碰撞
①概念:能够发生化学反应的碰撞
②条件:足够的能量;合适的取向
③与反应速率的关系:
碰撞的频率越高,反应速率越快
活化分子
一、有效碰撞理论
4.活化分子和活化能
①活化分子:能够发生有效碰撞的分子
注意:某化学反应一定条件下,反应物分子中活化分子百分数是一定的
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差
思考讨论:
反应物、生成物的能量与活化能有什么关系?
化学反应速率与活化分子、有效碰撞有什么关系?
一、有效碰撞理论
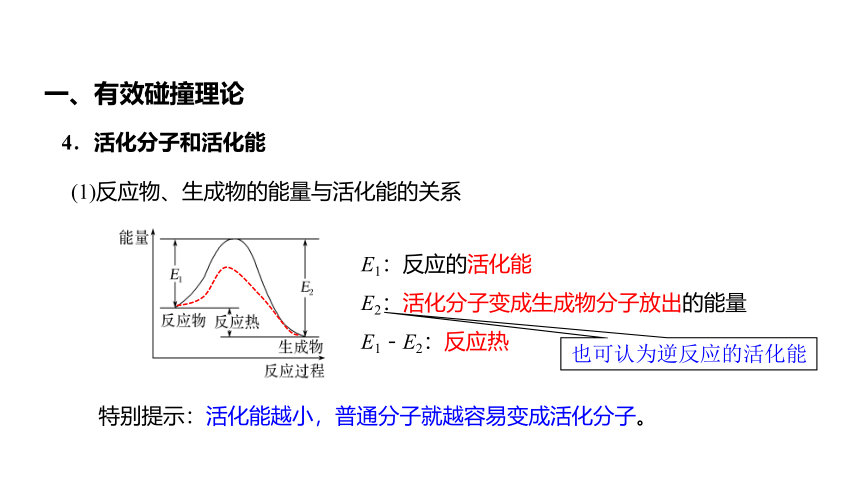
E1:反应的活化能
E2:活化分子变成生成物分子放出的能量
E1-E2:反应热
(1)反应物、生成物的能量与活化能的关系
特别提示:活化能越小,普通分子就越容易变成活化分子。
也可认为逆反应的活化能
4.活化分子和活化能
一、有效碰撞理论
(2)化学反应速率与活化分子、有效碰撞的关系
反应物分子中活化分子的百分数越大、单位体积内活化分子数越多,
单位时间内有效碰撞的次数越多,化学反应速率越快。
4.活化分子和活化能
一、有效碰撞理论
能否用碰撞理论解释:
当其他条件相同时,为什么增大反应物浓度化学反应速率增大,而反之速率减小?
升温会使化学反应速率增大,而降温使速率减小?
探究分析
应结合外界条件改变后,反应物中单位体积内活化分子数目、
单位体积内活化分子百分数及单位时间内有效碰撞的次数来讨论。
1.浓度
(1)规律:其他条件不变时,反应物浓度增大,反应速率增大;反之则速率减小。
(2)解释:
某化学反应,一定条件,反应物分子中活化分子的百分数是一定的,而单位体积内活化分子的数目与反应物分子的总数成正比,即与反应物的浓度成正比。
二、有效碰撞理论对影响化学反应速率因素的解释
1.浓度
(1)规律:其他条件不变时,反应物浓度增大,反应速率增大;反之则速率减小。
(2)解释:
二、有效碰撞理论对影响化学反应速率因素的解释
1.浓度
(1)规律:其他条件不变时,反应物浓度增大,反应速率增大;反之则速率减小。
(2)解释:
二、有效碰撞理论对影响化学反应速率因素的解释
单位体积内活化分子数增多
单位时间内有效碰撞次数增多
增大
浓度
同理,可以解释反应物浓度降低会使化学反应速率减小。
反应速率增大
思考:反应物分子中活化分子百分数变了吗?
2.压强(有气体参加,压强变化仅由容器容积变化引起的反应)
(1)规律:其他条件不变时,压强增大,反应速率增大;反之则速率减小。
气体体积
缩小
压强增大
单位体积内活化分子数增多
单位时间内有效碰撞次数增多
浓度
增大
反应速率增大
即压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
(2)解释:
二、有效碰撞理论对影响化学反应速率因素的解释
3.温度
(1)规律:其他条件不变时,升温,反应速率增大;反之则速率减小。
(2)解释:
反应物分子能量增加
活化分子百分数增多
单位时间内有效碰撞次数增多
升高温度
反应速率增大
同理,可以解释降低温度会使化学反应速率减小。
二、有效碰撞理论对影响化学反应速率因素的解释
4.催化剂
(1)规律:其他条件不变,催化剂可以加快化学反应速率。(通常指正催化剂)
(2)解释:
改变了反应历程,降低了活化能
活化分子百分数增多
单位时间内有效碰撞次数增多
催化剂
反应速率增大
二、有效碰撞理论对影响化学反应速率因素的解释
知识拓展
艾哈迈德·泽维尔(???? ????,Ahmed Hassan Zewail),埃及化学家,飞秒化学专家。他研究的技术能将研究化学反应的时间尺度缩减至飞秒,透过摄影将化学反应中每个微细变化忠实地纪录。
飞秒化学 —— 参照课本 P28
一、有效碰撞理论
二、有效碰撞理论对影响化学反应速率因素的解释
增大反应物浓度
单位体积内分子总数增多,百分数不变,活化分子数增多
单位时间内、单位体积内有效碰撞次数增多
增大气体压强
增大化学反应速率
单位体积内分子总数不变,活化分子百分数增多,活化分子数增多
升高温度
吸收能量
降低活化能
加入催化剂
课堂小结
1.下列有关活化分子的说法正确的是 ( )
A.增大反应物浓度可以提高活化分子百分数
B.增大体系的压强一定能提高活化分子百分数
C.使用合适的催化剂可以增大活化分子的能量
D.升高温度能提高活化分子百分数
当堂训练
D
解析:升高温度、加入催化剂能提高活化分子百分数,且加入催化剂可降低反应的活化能;增加反应物浓度、增大体系压强只增大单位体积活化分子的数目,活化分子百分数不变;只有D正确。
2.某温度下,体积一定的密闭容器中进行如下反应:
2X(g)+Y(g) Z(g)+W(s) ΔH>0,下列叙述正确的是 ( )
A.在容器中通入氩气,反应速率不变
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的体积缩小,可增大活化分子的百分数,有效碰撞次数增大
A
解析:通入氩气,容器中压强增大,但各物质浓度不变,所以反应速率不变,A正确;W是固体,固体量的增减不会引起化学反应速率的改变,所以加入少量固体W,正、逆反应速率均不变,B不正确;升温,正逆反应速率均增大,C不正确;容器的体积缩小,活化分子的百分数不变,D不正确。
当堂训练
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.知道化学反应是有历程的;
2.认识基元反应活化能对化学反应速率的影响;
3.能用一定的理论模型说明外界条件改变对化学反应速率的影响。
1.证据推理与模型认知:能根据碰撞理论模型推断温度、浓度、催化剂等是如何影响化学反应速率的。
2.科学探究与创新意识:初步形成探究化学规律的思路与方法,发展创造性体验和想象创新能力。
引入新课
不同的化学反应,反应速率千差万别。
例如溶洞的形成、气体的爆炸。
绝大多数的化学反应,并不是简单一步就完成的,化学反应是有历程的。
同一反应,条件不同,反应速率也会有很大不同。
你对“化学反应是有历程的”这一说法有哪些认识?
分步进行
时间
研究发现大多数化学反应不是经过简单碰撞完成的,而是经过多个反应步骤。
问题思考
2HI===H2+I2
2HI → H2+2I·
2I· → I2
一、有效碰撞理论
基元反应
大多数的化学反应往往经过多个反应步骤才能实现,每一步反应都称为基元反应。
反应机理
先后进行的基元反应反映了化学反应的反应历程,反应历程又称反应机理。
1.基元反应和反应历程
自由基
带有单电子的原子或原子团
分两步
2.基元反应发生的条件
是什么启动了“基元反应” ?
※ 先决条件是反应物的分子必须发生碰撞 。
反应分子的每一次碰撞都能发生化学反应吗?
※ 反应物分子必须具有一定的能量;
※ 碰撞时有合适的取向。
通常情况下,当气体的浓度为1 mol/L时,在每立方厘米、每秒内反应物分子间的碰撞可达到1028次。如果反应物分子间的任何一次碰撞都能发生反应的话,反应只需10-5 s就可以完成。换言之,任何气体的反应均可以瞬间完成。但实际并非如此。
一、有效碰撞理论
HI分解反应中分子碰撞示意图
3.有效碰撞
碰撞时能量不足
碰撞时取向不合适
有效碰撞
①概念:能够发生化学反应的碰撞
②条件:足够的能量;合适的取向
③与反应速率的关系:
碰撞的频率越高,反应速率越快
活化分子
一、有效碰撞理论
4.活化分子和活化能
①活化分子:能够发生有效碰撞的分子
注意:某化学反应一定条件下,反应物分子中活化分子百分数是一定的
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差
思考讨论:
反应物、生成物的能量与活化能有什么关系?
化学反应速率与活化分子、有效碰撞有什么关系?
一、有效碰撞理论
E1:反应的活化能
E2:活化分子变成生成物分子放出的能量
E1-E2:反应热
(1)反应物、生成物的能量与活化能的关系
特别提示:活化能越小,普通分子就越容易变成活化分子。
也可认为逆反应的活化能
4.活化分子和活化能
一、有效碰撞理论
(2)化学反应速率与活化分子、有效碰撞的关系
反应物分子中活化分子的百分数越大、单位体积内活化分子数越多,
单位时间内有效碰撞的次数越多,化学反应速率越快。
4.活化分子和活化能
一、有效碰撞理论
能否用碰撞理论解释:
当其他条件相同时,为什么增大反应物浓度化学反应速率增大,而反之速率减小?
升温会使化学反应速率增大,而降温使速率减小?
探究分析
应结合外界条件改变后,反应物中单位体积内活化分子数目、
单位体积内活化分子百分数及单位时间内有效碰撞的次数来讨论。
1.浓度
(1)规律:其他条件不变时,反应物浓度增大,反应速率增大;反之则速率减小。
(2)解释:
某化学反应,一定条件,反应物分子中活化分子的百分数是一定的,而单位体积内活化分子的数目与反应物分子的总数成正比,即与反应物的浓度成正比。
二、有效碰撞理论对影响化学反应速率因素的解释
1.浓度
(1)规律:其他条件不变时,反应物浓度增大,反应速率增大;反之则速率减小。
(2)解释:
二、有效碰撞理论对影响化学反应速率因素的解释
1.浓度
(1)规律:其他条件不变时,反应物浓度增大,反应速率增大;反之则速率减小。
(2)解释:
二、有效碰撞理论对影响化学反应速率因素的解释
单位体积内活化分子数增多
单位时间内有效碰撞次数增多
增大
浓度
同理,可以解释反应物浓度降低会使化学反应速率减小。
反应速率增大
思考:反应物分子中活化分子百分数变了吗?
2.压强(有气体参加,压强变化仅由容器容积变化引起的反应)
(1)规律:其他条件不变时,压强增大,反应速率增大;反之则速率减小。
气体体积
缩小
压强增大
单位体积内活化分子数增多
单位时间内有效碰撞次数增多
浓度
增大
反应速率增大
即压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
(2)解释:
二、有效碰撞理论对影响化学反应速率因素的解释
3.温度
(1)规律:其他条件不变时,升温,反应速率增大;反之则速率减小。
(2)解释:
反应物分子能量增加
活化分子百分数增多
单位时间内有效碰撞次数增多
升高温度
反应速率增大
同理,可以解释降低温度会使化学反应速率减小。
二、有效碰撞理论对影响化学反应速率因素的解释
4.催化剂
(1)规律:其他条件不变,催化剂可以加快化学反应速率。(通常指正催化剂)
(2)解释:
改变了反应历程,降低了活化能
活化分子百分数增多
单位时间内有效碰撞次数增多
催化剂
反应速率增大
二、有效碰撞理论对影响化学反应速率因素的解释
知识拓展
艾哈迈德·泽维尔(???? ????,Ahmed Hassan Zewail),埃及化学家,飞秒化学专家。他研究的技术能将研究化学反应的时间尺度缩减至飞秒,透过摄影将化学反应中每个微细变化忠实地纪录。
飞秒化学 —— 参照课本 P28
一、有效碰撞理论
二、有效碰撞理论对影响化学反应速率因素的解释
增大反应物浓度
单位体积内分子总数增多,百分数不变,活化分子数增多
单位时间内、单位体积内有效碰撞次数增多
增大气体压强
增大化学反应速率
单位体积内分子总数不变,活化分子百分数增多,活化分子数增多
升高温度
吸收能量
降低活化能
加入催化剂
课堂小结
1.下列有关活化分子的说法正确的是 ( )
A.增大反应物浓度可以提高活化分子百分数
B.增大体系的压强一定能提高活化分子百分数
C.使用合适的催化剂可以增大活化分子的能量
D.升高温度能提高活化分子百分数
当堂训练
D
解析:升高温度、加入催化剂能提高活化分子百分数,且加入催化剂可降低反应的活化能;增加反应物浓度、增大体系压强只增大单位体积活化分子的数目,活化分子百分数不变;只有D正确。
2.某温度下,体积一定的密闭容器中进行如下反应:
2X(g)+Y(g) Z(g)+W(s) ΔH>0,下列叙述正确的是 ( )
A.在容器中通入氩气,反应速率不变
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的体积缩小,可增大活化分子的百分数,有效碰撞次数增大
A
解析:通入氩气,容器中压强增大,但各物质浓度不变,所以反应速率不变,A正确;W是固体,固体量的增减不会引起化学反应速率的改变,所以加入少量固体W,正、逆反应速率均不变,B不正确;升温,正逆反应速率均增大,C不正确;容器的体积缩小,活化分子的百分数不变,D不正确。
当堂训练
