2021-2022学年高一化学人教版(2019)必修第一册第二章 第三节物质的量(第1课时)课件(19张ppt)
文档属性
| 名称 | 2021-2022学年高一化学人教版(2019)必修第一册第二章 第三节物质的量(第1课时)课件(19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-10 19:52:17 | ||
图片预览






文档简介
(共19张PPT)
第三节 物质的量
第1课时 物质的量
如何用化学语言定量描述反应 C + O2 = CO2
C + O2 = CO2
宏观
(质量)
12g
32g
44g
微观
(粒子数)
1个
1个
1个
思考:如何将宏观质量和微观粒子数之间建立联系呢?
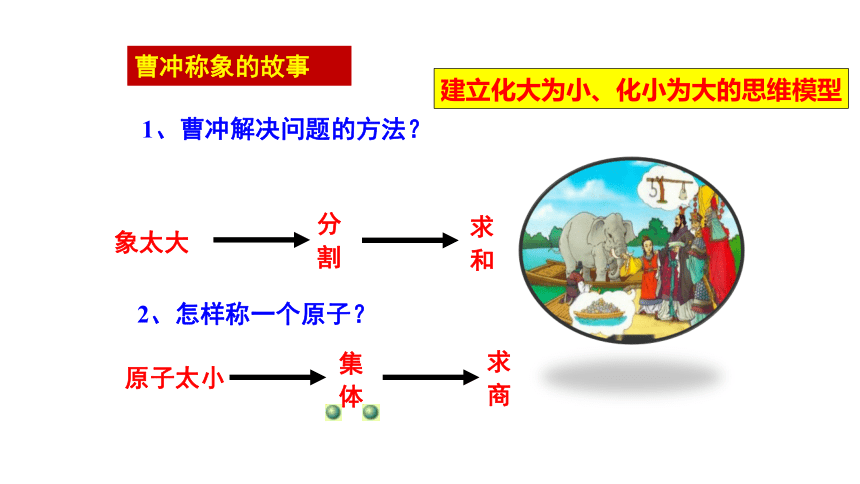
曹冲称象的故事
1、曹冲解决问题的方法?
2、怎样称一个原子?
象太大
分割
求和
原子太小
集体
求商
建立化大为小、化小为大的思维模型
如何用托盘天平确定1kg黄豆堆的黄豆个数?
运用模型
【总结方法】:
(1)数出一定数目的黄豆(100粒)
(2)用托盘天平称量100粒黄豆的质量
(3)求算1kg黄豆的质量
“堆量”:一定数目物质的集合体。
思考:生活中有哪些约定俗成的“堆量”?
物质的量
一、
参考资料
1971年,由41个国家参加的第14届国际计量大会上,正式宣布了国际纯粹和应用化学联合会、国际纯粹和应用物理联合会和国际标准化组织关于必须定义一个物理量单位的提议,并作出决议。从此,“物质的量”就成为了国际单位制中的一个基本物理量,物质的量的单位为摩尔。
表示含有一定数目粒子的集合体
物质的量
一、
单位是 摩尔、简称摩,符号:mol
微观
粒子
1mol 分子、离子、
原子……
参考资料
1971年,第14届国际计量大会上,正式宣布“物质的量”成为国际单位制中的一个基本物理量,物质的量的单位为摩尔。同时规定0.012 kg 12C中所含的碳原子数目作为1 mol的标准。
了解化学史,能更好地学好化学
符号: NA
单位: mol-1,
数值:约为6.02×1023
二、
阿伏加德罗常数: 1 mol 任何粒子的粒子数。
1971年,第14届国际计量大会上,正式宣布“物质的量”成为国际单位制中的一个基本物理量,物质的量的单位为摩尔。同时规定0.012 kg 12C中所含的碳原子数目作为1 mol的标准。
(1)1mol 碳原子含有 个 碳原子
(2)0.3mol H2SO4分子含有 个 H2SO4分子
(3)10mol Na+含有 个 Na+
(4)6mol 电子含有 个 电子
(5)0.5mol 中子含有 个 中子
物质的量是表示微粒的集体,可以用分数或小数表示。
物质的量( n )==
微粒数目(N)
阿伏加德罗常数(NA)
物质的量、阿伏加德罗常数与粒子数间的关系。
(6)3.01×1023个H2O的物质的量是多少?
1×NA
0.3×NA
10×NA
6×NA
0.5×NA
约为1×6.02×1023
约为0.3×6.02×1023
约为10×6.02×1023
约为6×6.02×1023
约为0.5×6.02×1023
1 摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子?
H2O
1
1 mol
NA
2H
O
2
1
2NA
NA
1 mol
2 mol
微粒个数
微粒集体
物质的量
知识链接
结论
微粒之间的个数之比等于其物质的量之比
n1︰n2=N1︰N2
6.02×1022个CO2分子中含多少个O原子 所含O原子的物质的量是多少? CO2分子的物质的量是多少?
探究学习:
N= n*NA
物质的量( n )==
微粒数目(N)
阿伏加德罗常数(NA)
摩尔质量
粒子符号 相对分子(原子)质量 每个粒子质量(g/个) 1mol的个数(个) 1mol的质量(g)
H2O 18 2.990×10-23
Al 27 4.484×10-23
Na 23 3.821×10-23
KCl 74.5 1.237×10-22
Cl2 71 1.179×10-22
NA
NA
NA
NA
NA
18
27
23
74.5
71
阅读表格,找出1mol物质的质量有什么规律。
1mol任何微粒或物质的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
三、
摩尔质量
定义:单位物质的量的物质所具有的质量叫做摩尔质量
符号:M
常用单位:g/mol 、Kg/mol
n
=
m
M
物质的量
(单位:mol)
物质的质量
(单位:Kg)
摩尔质量
(单位:Kg/mol)
(1)定义:
(2)定义式:
单位物质的量的物质所具有的质量叫摩尔质量。
M
=
m
n
物质的质量、物质的量、摩尔质量之间的关系
物质的量
(n)
质量(m)
粒子数
(N)
M×
÷M
×NA
NA÷
质量、物质的量、摩尔质量、阿伏伽德罗常数、粒子数之间的关系
物质的量是连接宏观与微观之间的“桥梁”
66gCO2的物质的量是多少?所含CO2分子多少个 所含O原子的物质的量是多少?
探究练习:
N= n*NA
物质的量( n )==
m
M
D
A
B
【练习1】下列说法正确的是( )
A.摩尔既是物质的数量单位,又是物质的质量单位
B.6.02×1023就是阿伏伽德罗常数
C.摩尔质量就是相对原子质量或相对分子质量
D.1mol氩气和1mol氧气具有相同的分子数
【练习2】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A.32 g O2所含的原子数目为NA
B.0.5 mol H2O含有的原子数目为1.5NA
C.1 mol H2O含有的H2O分子数目为NA
D.0.5NA个氯气分子的物质的量是0.5 mol
【练习3】若 m g H2含N个H2分子,则阿伏加德罗常数的数值可以表示为( )
A. N/m B.2N/m C. N D.2N
微观
符号
宏观
桥梁
物质的量
N
NA
__________
n
=
m
M
__________
=
化学三重表征
第三节 物质的量
第1课时 物质的量
如何用化学语言定量描述反应 C + O2 = CO2
C + O2 = CO2
宏观
(质量)
12g
32g
44g
微观
(粒子数)
1个
1个
1个
思考:如何将宏观质量和微观粒子数之间建立联系呢?
曹冲称象的故事
1、曹冲解决问题的方法?
2、怎样称一个原子?
象太大
分割
求和
原子太小
集体
求商
建立化大为小、化小为大的思维模型
如何用托盘天平确定1kg黄豆堆的黄豆个数?
运用模型
【总结方法】:
(1)数出一定数目的黄豆(100粒)
(2)用托盘天平称量100粒黄豆的质量
(3)求算1kg黄豆的质量
“堆量”:一定数目物质的集合体。
思考:生活中有哪些约定俗成的“堆量”?
物质的量
一、
参考资料
1971年,由41个国家参加的第14届国际计量大会上,正式宣布了国际纯粹和应用化学联合会、国际纯粹和应用物理联合会和国际标准化组织关于必须定义一个物理量单位的提议,并作出决议。从此,“物质的量”就成为了国际单位制中的一个基本物理量,物质的量的单位为摩尔。
表示含有一定数目粒子的集合体
物质的量
一、
单位是 摩尔、简称摩,符号:mol
微观
粒子
1mol 分子、离子、
原子……
参考资料
1971年,第14届国际计量大会上,正式宣布“物质的量”成为国际单位制中的一个基本物理量,物质的量的单位为摩尔。同时规定0.012 kg 12C中所含的碳原子数目作为1 mol的标准。
了解化学史,能更好地学好化学
符号: NA
单位: mol-1,
数值:约为6.02×1023
二、
阿伏加德罗常数: 1 mol 任何粒子的粒子数。
1971年,第14届国际计量大会上,正式宣布“物质的量”成为国际单位制中的一个基本物理量,物质的量的单位为摩尔。同时规定0.012 kg 12C中所含的碳原子数目作为1 mol的标准。
(1)1mol 碳原子含有 个 碳原子
(2)0.3mol H2SO4分子含有 个 H2SO4分子
(3)10mol Na+含有 个 Na+
(4)6mol 电子含有 个 电子
(5)0.5mol 中子含有 个 中子
物质的量是表示微粒的集体,可以用分数或小数表示。
物质的量( n )==
微粒数目(N)
阿伏加德罗常数(NA)
物质的量、阿伏加德罗常数与粒子数间的关系。
(6)3.01×1023个H2O的物质的量是多少?
1×NA
0.3×NA
10×NA
6×NA
0.5×NA
约为1×6.02×1023
约为0.3×6.02×1023
约为10×6.02×1023
约为6×6.02×1023
约为0.5×6.02×1023
1 摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子?
H2O
1
1 mol
NA
2H
O
2
1
2NA
NA
1 mol
2 mol
微粒个数
微粒集体
物质的量
知识链接
结论
微粒之间的个数之比等于其物质的量之比
n1︰n2=N1︰N2
6.02×1022个CO2分子中含多少个O原子 所含O原子的物质的量是多少? CO2分子的物质的量是多少?
探究学习:
N= n*NA
物质的量( n )==
微粒数目(N)
阿伏加德罗常数(NA)
摩尔质量
粒子符号 相对分子(原子)质量 每个粒子质量(g/个) 1mol的个数(个) 1mol的质量(g)
H2O 18 2.990×10-23
Al 27 4.484×10-23
Na 23 3.821×10-23
KCl 74.5 1.237×10-22
Cl2 71 1.179×10-22
NA
NA
NA
NA
NA
18
27
23
74.5
71
阅读表格,找出1mol物质的质量有什么规律。
1mol任何微粒或物质的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
三、
摩尔质量
定义:单位物质的量的物质所具有的质量叫做摩尔质量
符号:M
常用单位:g/mol 、Kg/mol
n
=
m
M
物质的量
(单位:mol)
物质的质量
(单位:Kg)
摩尔质量
(单位:Kg/mol)
(1)定义:
(2)定义式:
单位物质的量的物质所具有的质量叫摩尔质量。
M
=
m
n
物质的质量、物质的量、摩尔质量之间的关系
物质的量
(n)
质量(m)
粒子数
(N)
M×
÷M
×NA
NA÷
质量、物质的量、摩尔质量、阿伏伽德罗常数、粒子数之间的关系
物质的量是连接宏观与微观之间的“桥梁”
66gCO2的物质的量是多少?所含CO2分子多少个 所含O原子的物质的量是多少?
探究练习:
N= n*NA
物质的量( n )==
m
M
D
A
B
【练习1】下列说法正确的是( )
A.摩尔既是物质的数量单位,又是物质的质量单位
B.6.02×1023就是阿伏伽德罗常数
C.摩尔质量就是相对原子质量或相对分子质量
D.1mol氩气和1mol氧气具有相同的分子数
【练习2】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A.32 g O2所含的原子数目为NA
B.0.5 mol H2O含有的原子数目为1.5NA
C.1 mol H2O含有的H2O分子数目为NA
D.0.5NA个氯气分子的物质的量是0.5 mol
【练习3】若 m g H2含N个H2分子,则阿伏加德罗常数的数值可以表示为( )
A. N/m B.2N/m C. N D.2N
微观
符号
宏观
桥梁
物质的量
N
NA
__________
n
=
m
M
__________
=
化学三重表征
