2021-2022学年上学期高一化学人教版(2019)必修第一册第一章 第二节离子反应 第1课时 电解质的电离 (18张ppt)
文档属性
| 名称 | 2021-2022学年上学期高一化学人教版(2019)必修第一册第一章 第二节离子反应 第1课时 电解质的电离 (18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-10 19:54:29 | ||
图片预览




文档简介
202X
第二节 离子反应
第一课时 电解质的电离
01
学习目标
1.了解电离、电解质、离子反应和离子方程式的含义。
2.能从电离角度认识酸、碱、盐。
3.能够正确书写离子方程式。
4.掌握离子反应生成的条件以及常见离子能否共存的判断方法。
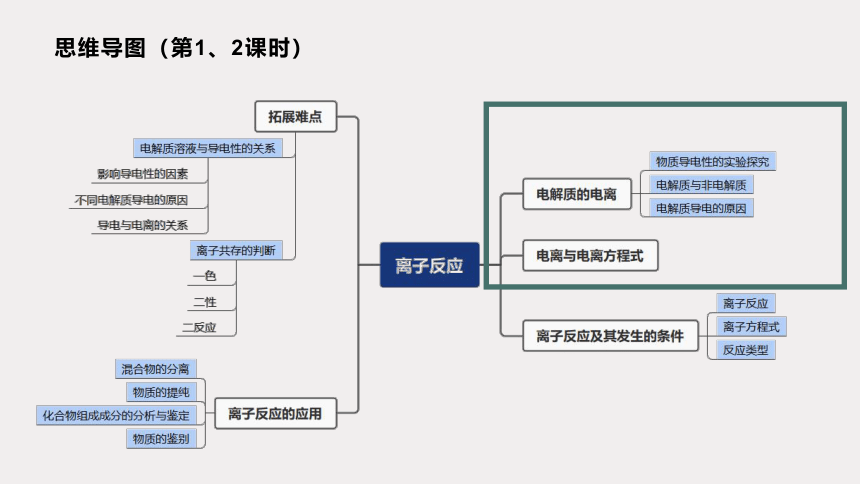
思维导图(第1、2课时)
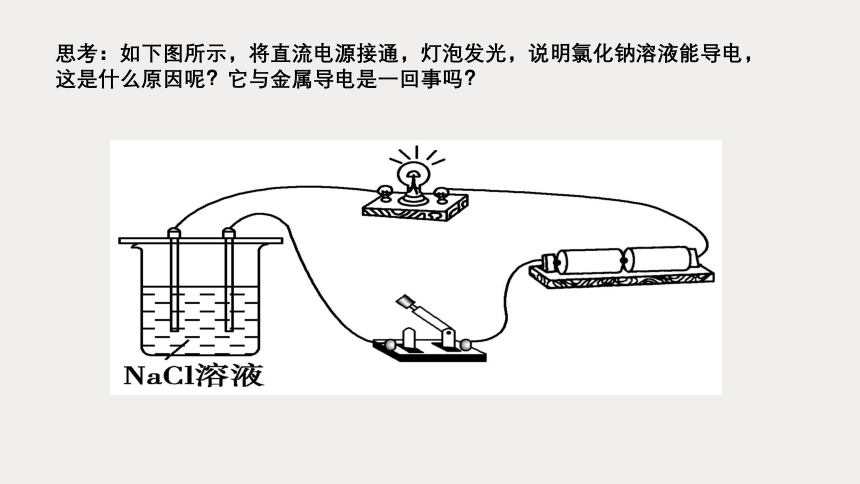
思考:如下图所示,将直流电源接通,灯泡发光,说明氯化钠溶液能导电,
这是什么原因呢?它与金属导电是一回事吗?
什么是电离?
定义:电解质溶于水或受热融化时,形成自由移动的离子的过程叫做电离。
注意:电解质溶于水时是由于水分子的作用而电离,熔融状态下是由于热能破坏化学键而电离成自由移动的离子,都不是因为通电而电离。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验装置
实验操作
实验操作
实验现象
实验结论
三个烧杯、
石墨电极、NaCl固体、KNO3固体
和蒸馏水
1
在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,将石墨电极依次放入三个烧杯中,分别接通电源
小灯泡不亮
干燥的NaCl固体、KNO3固体都不导电,蒸馏水也不导电
2
取上述烧杯中的少量NaCl固体,KNO3固体加入蒸馏水配成溶液,将石墨电极依次放入NaCl溶液、KNO3溶液中,分别接通电源
小灯泡发光
NaCl溶液、KNO3溶液可以导电
知识点一 物质导电性的实验探究
知识点二 电解质与非电解质
1、电解质
定义:在水溶液里或熔融状态下能导电的化合物叫做电解质。如HCl、NaOH、
NaCl、CaO等。
2、非电解质
定义:在水溶液里或熔融状态下不能导电的化合物叫做非电解质。如酒精、蔗糖、
CO2等。
知识点二 电解质与非电解质
?
电解质
非电解质
相同点
均为化合物
不同点
在水溶液里或熔融状态下能导电,
能导电的原因是在于自身能发生电离,
产生自由移动的离子
在水溶液里和熔融状态下都不能导电,
不能导电的原因是在于自身不能发生电离,
没有自由移动的离子
本质
区别
在水溶液里或熔融状态下能发生电离
在水溶液里和熔融状态下均不能发生电离
所含物
质类型
酸,如H2SO4、H2CO3等
碱,如NaOH、NH3·H2O等
盐,如NaCl、CaCO3等
活泼金属氧化物,如Na2O等
非金属氧化物,如CO2、CO等
非酸性气态氢化物,如NH3等
绝大多数有机物,如蔗糖、酒精、CH4等
疑问:怎么样看待是否能自身电离?
自身发何时能电离是指物质溶于水后是物质自身发生电离,而不是与水反应后的生成物发生电离。
举个栗子
NH3溶于水
生成NH3·H2O
电离出NH4+ 、OH-
但并不是NH3自身发生电离,所以NH3不是电解质!
H2SO4溶于水
直接电离出SO4、H+
但是H2SO4自身发生电离,所以H2SO4是电解质!
1.溶于水能导电的化合物不一定是电解质,如SO3。
看实质:电解质水溶液导电,其原因是电解质本身在水溶液中电离为自由移动的阴、阳离子。而SO3溶于水所形成的溶液能导电,原因是SO3与H2O反应生成了H2SO4, H2SO4是电解质,是水溶液中电离出了自由移动的阴、阳离子。
2.导电的物质不一定是电解质,如Cu和NaCl溶液。
看概念:电解质首先属于化合物,化合物又属于纯净物,而Cu是单质,NaCl溶液是混合物。
3.电解质不一定易溶于水,易溶于水的化合物不一定是电解质,如BaSO4不溶于水,却是电解质。
看概念:电解质是在水溶液中或熔融状态下能够导电的化合物。这里对化合物提出了两个选择性条件,溶于水时能够导电的可以,不溶于水而熔融时能够导电的也可以。
4.不是电解质的物质也不一定是非电解质。
看概念:在水溶液中和熔融状态下都不能导电的化合物是非电解质。非电解质首先属于化合物。
电解质和非电解质的四个“不一定”
知识点三 电解质导电的原因
(1)电解质的水溶液导电(以NaCl为例)
当将NaCl固体加入水中时,在水分子的作用下Na+与Cl-脱离NaCl固体的表面,进入水中,形成能够
自由移动的水合钠离子和水合氯离子
(1)电解质的水溶液导电(以NaCl为例)
当将NaCl固体加入水中时,在水分子的作用下Na+与Cl-脱离NaCl固体的表面,进入水中,形成能够
自由移动的水合钠离子和水合氯离子
当在NaCl溶液中插入电极并接通电源时,带正电后的水和钠离子向与电源负极极移动,带负电荷的水合氯离子相与电源正极相连的电极移动,因而NaCl溶液能够导电。
知识点三 电解质导电的原因
(1)熔融电解质导电(以NaCl为例)
当将NaCl固体受热融化时,离子的运动随温度升高而加快,克服离子之间相互的作用,
产生了能够自由移动的钠离子和氯离子,从而氯化钠在熔融状态时也能导电。
方法:模型
知识点三 电解质导电的原因
知识点四 电离方程式
(1)电离方程式的概念:
用化学符号来表示电解质电离过程的式子叫做电离方程式。
(2)电离方程式书写注意事项:
①阴阳离子拆开写,但原子团不能拆,
如:NO3-、SO42-、OH-、NH4+、CO32-等
②阴、阳离子的个数由化学式决定,
带电荷数由化合价决定。
③强酸的酸式根(HSO4-)要拆开写,而弱酸的酸式根(HCO3-、HSO3-等)不能拆。
酸:强酸:HCl、H2SO4、HNO3
弱酸:H2CO3、CH3COOH
碱:强碱:Ba(OH)2、KOH、Ca(OH)2、NaOH
弱碱:NH3?H2O
知识点四 电离方程式
书写下列物质的电离方程式:
HCl
H2SO4
NaOH
Ca(OH)2
NaCl
Na2SO4
NH4Cl
= H + + Cl-
= 2H + + SO42-
= Na + + OH-
= Ca2+ + 2OH-
= Na + + Cl-
= 2Na+ + SO42-
酸:
电离时生成的阳离子全部是氢离子的化合物。
碱:
电离时生成的阴离子全部是氢氧根离子的化合物。
盐:
电离时生成金属离子(或铵根离子)和酸根离子的化合物。
= NH4+ + Cl-
酸根离子:除OH-之外的阴离子
补充:几种“特殊电解质”在水中的电离
1.NaHCO3
NaHCO3的组成是Na+和HCO3-, HCO3-在水中很难再发生电离,故NaHCO3在水中的电离方程式,
应写为
NaHCO3== Na++HCO3-
不写为
NaHCO3== Na++H++CO32-
2.NaHSO4
NaHSO4的组成是Na+和HSO4-, HSO4-在水中易电离为H+和SO42-,故NaHSO4在水中的电离方程式,
应写为
NaHSO4== Na++H++SO42
-3.CH3COOH
每个CH3COOH有4个H,但CH3COOH是一元酸,在水中电离为H+的H只有OH中的这1个。 CH3COOH在水中的电离是可逆的。综合上述, CH3COOH在水中的电离方程式,应写为
CH3COOH ==CH3COO-+H+
补充:几种“特殊电解质”在水中的电离
4.BaSO4
BaSO4 难溶于水,其意思是溶解度很小,但不是不溶解。 BaSO4 溶于水的部分会全部电离为Ba2+和SO42-,故BaSO4在水中的电离方程式,应写为BaSO4 == Ba2++SO42-。
5.H2O
在液态水中, H2O与H2O相互作用,使少量H2O可逆性地电离为H+和OH-,故 H2O的电离方程式,应写为H2O H++OH-。
6. NH3·H2O
NH3·H2O是一种一元碱,但该化学式在形式上与一般的碱不同。 NH3·H2O在水中可逆性地电离为NH4+和OH-,故 NH3·H2O的电离方程式,应写为NH3·H2O == NH4++OH- 。
THANKS
感谢观看
第二节 离子反应
第一课时 电解质的电离
01
学习目标
1.了解电离、电解质、离子反应和离子方程式的含义。
2.能从电离角度认识酸、碱、盐。
3.能够正确书写离子方程式。
4.掌握离子反应生成的条件以及常见离子能否共存的判断方法。
思维导图(第1、2课时)
思考:如下图所示,将直流电源接通,灯泡发光,说明氯化钠溶液能导电,
这是什么原因呢?它与金属导电是一回事吗?
什么是电离?
定义:电解质溶于水或受热融化时,形成自由移动的离子的过程叫做电离。
注意:电解质溶于水时是由于水分子的作用而电离,熔融状态下是由于热能破坏化学键而电离成自由移动的离子,都不是因为通电而电离。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验装置
实验操作
实验操作
实验现象
实验结论
三个烧杯、
石墨电极、NaCl固体、KNO3固体
和蒸馏水
1
在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,将石墨电极依次放入三个烧杯中,分别接通电源
小灯泡不亮
干燥的NaCl固体、KNO3固体都不导电,蒸馏水也不导电
2
取上述烧杯中的少量NaCl固体,KNO3固体加入蒸馏水配成溶液,将石墨电极依次放入NaCl溶液、KNO3溶液中,分别接通电源
小灯泡发光
NaCl溶液、KNO3溶液可以导电
知识点一 物质导电性的实验探究
知识点二 电解质与非电解质
1、电解质
定义:在水溶液里或熔融状态下能导电的化合物叫做电解质。如HCl、NaOH、
NaCl、CaO等。
2、非电解质
定义:在水溶液里或熔融状态下不能导电的化合物叫做非电解质。如酒精、蔗糖、
CO2等。
知识点二 电解质与非电解质
?
电解质
非电解质
相同点
均为化合物
不同点
在水溶液里或熔融状态下能导电,
能导电的原因是在于自身能发生电离,
产生自由移动的离子
在水溶液里和熔融状态下都不能导电,
不能导电的原因是在于自身不能发生电离,
没有自由移动的离子
本质
区别
在水溶液里或熔融状态下能发生电离
在水溶液里和熔融状态下均不能发生电离
所含物
质类型
酸,如H2SO4、H2CO3等
碱,如NaOH、NH3·H2O等
盐,如NaCl、CaCO3等
活泼金属氧化物,如Na2O等
非金属氧化物,如CO2、CO等
非酸性气态氢化物,如NH3等
绝大多数有机物,如蔗糖、酒精、CH4等
疑问:怎么样看待是否能自身电离?
自身发何时能电离是指物质溶于水后是物质自身发生电离,而不是与水反应后的生成物发生电离。
举个栗子
NH3溶于水
生成NH3·H2O
电离出NH4+ 、OH-
但并不是NH3自身发生电离,所以NH3不是电解质!
H2SO4溶于水
直接电离出SO4、H+
但是H2SO4自身发生电离,所以H2SO4是电解质!
1.溶于水能导电的化合物不一定是电解质,如SO3。
看实质:电解质水溶液导电,其原因是电解质本身在水溶液中电离为自由移动的阴、阳离子。而SO3溶于水所形成的溶液能导电,原因是SO3与H2O反应生成了H2SO4, H2SO4是电解质,是水溶液中电离出了自由移动的阴、阳离子。
2.导电的物质不一定是电解质,如Cu和NaCl溶液。
看概念:电解质首先属于化合物,化合物又属于纯净物,而Cu是单质,NaCl溶液是混合物。
3.电解质不一定易溶于水,易溶于水的化合物不一定是电解质,如BaSO4不溶于水,却是电解质。
看概念:电解质是在水溶液中或熔融状态下能够导电的化合物。这里对化合物提出了两个选择性条件,溶于水时能够导电的可以,不溶于水而熔融时能够导电的也可以。
4.不是电解质的物质也不一定是非电解质。
看概念:在水溶液中和熔融状态下都不能导电的化合物是非电解质。非电解质首先属于化合物。
电解质和非电解质的四个“不一定”
知识点三 电解质导电的原因
(1)电解质的水溶液导电(以NaCl为例)
当将NaCl固体加入水中时,在水分子的作用下Na+与Cl-脱离NaCl固体的表面,进入水中,形成能够
自由移动的水合钠离子和水合氯离子
(1)电解质的水溶液导电(以NaCl为例)
当将NaCl固体加入水中时,在水分子的作用下Na+与Cl-脱离NaCl固体的表面,进入水中,形成能够
自由移动的水合钠离子和水合氯离子
当在NaCl溶液中插入电极并接通电源时,带正电后的水和钠离子向与电源负极极移动,带负电荷的水合氯离子相与电源正极相连的电极移动,因而NaCl溶液能够导电。
知识点三 电解质导电的原因
(1)熔融电解质导电(以NaCl为例)
当将NaCl固体受热融化时,离子的运动随温度升高而加快,克服离子之间相互的作用,
产生了能够自由移动的钠离子和氯离子,从而氯化钠在熔融状态时也能导电。
方法:模型
知识点三 电解质导电的原因
知识点四 电离方程式
(1)电离方程式的概念:
用化学符号来表示电解质电离过程的式子叫做电离方程式。
(2)电离方程式书写注意事项:
①阴阳离子拆开写,但原子团不能拆,
如:NO3-、SO42-、OH-、NH4+、CO32-等
②阴、阳离子的个数由化学式决定,
带电荷数由化合价决定。
③强酸的酸式根(HSO4-)要拆开写,而弱酸的酸式根(HCO3-、HSO3-等)不能拆。
酸:强酸:HCl、H2SO4、HNO3
弱酸:H2CO3、CH3COOH
碱:强碱:Ba(OH)2、KOH、Ca(OH)2、NaOH
弱碱:NH3?H2O
知识点四 电离方程式
书写下列物质的电离方程式:
HCl
H2SO4
NaOH
Ca(OH)2
NaCl
Na2SO4
NH4Cl
= H + + Cl-
= 2H + + SO42-
= Na + + OH-
= Ca2+ + 2OH-
= Na + + Cl-
= 2Na+ + SO42-
酸:
电离时生成的阳离子全部是氢离子的化合物。
碱:
电离时生成的阴离子全部是氢氧根离子的化合物。
盐:
电离时生成金属离子(或铵根离子)和酸根离子的化合物。
= NH4+ + Cl-
酸根离子:除OH-之外的阴离子
补充:几种“特殊电解质”在水中的电离
1.NaHCO3
NaHCO3的组成是Na+和HCO3-, HCO3-在水中很难再发生电离,故NaHCO3在水中的电离方程式,
应写为
NaHCO3== Na++HCO3-
不写为
NaHCO3== Na++H++CO32-
2.NaHSO4
NaHSO4的组成是Na+和HSO4-, HSO4-在水中易电离为H+和SO42-,故NaHSO4在水中的电离方程式,
应写为
NaHSO4== Na++H++SO42
-3.CH3COOH
每个CH3COOH有4个H,但CH3COOH是一元酸,在水中电离为H+的H只有OH中的这1个。 CH3COOH在水中的电离是可逆的。综合上述, CH3COOH在水中的电离方程式,应写为
CH3COOH ==CH3COO-+H+
补充:几种“特殊电解质”在水中的电离
4.BaSO4
BaSO4 难溶于水,其意思是溶解度很小,但不是不溶解。 BaSO4 溶于水的部分会全部电离为Ba2+和SO42-,故BaSO4在水中的电离方程式,应写为BaSO4 == Ba2++SO42-。
5.H2O
在液态水中, H2O与H2O相互作用,使少量H2O可逆性地电离为H+和OH-,故 H2O的电离方程式,应写为H2O H++OH-。
6. NH3·H2O
NH3·H2O是一种一元碱,但该化学式在形式上与一般的碱不同。 NH3·H2O在水中可逆性地电离为NH4+和OH-,故 NH3·H2O的电离方程式,应写为NH3·H2O == NH4++OH- 。
THANKS
感谢观看
