2021-2022学年高一化学人教版(2019)必修第一册第二章 第一节 钠及其化合物 课件(含视频) 20张ppt
文档属性
| 名称 | 2021-2022学年高一化学人教版(2019)必修第一册第二章 第一节 钠及其化合物 课件(含视频) 20张ppt |  | |
| 格式 | pptx | ||
| 文件大小 | 95.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-10 19:56:00 | ||
图片预览








文档简介
第一节 钠及其化合物
第1课时 活泼的金属单质—钠
滴水点灯
在酒精灯的灯芯处放置一小块金属钠,用胶头滴管向灯芯处滴加水。
钠的单质
钠单质性质的理论分析:
(1)从物质分类的角度分析:
钠属于金属单质
(2)从氧化还原的角度分析:
钠一定具有还原性
(3)根据初中的金属活动性分析:
钠是很活泼的金属
结论:钠是一种具有较强还原性的金属单质
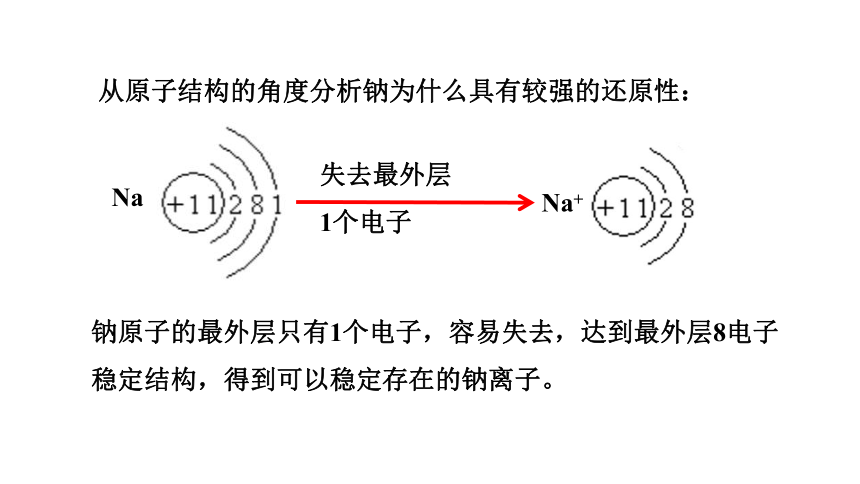
从原子结构的角度分析钠为什么具有较强的还原性:
Na
钠原子的最外层只有1个电子,容易失去,达到最外层8电子稳定结构,得到可以稳定存在的钠离子。
Na+
失去最外层
1个电子
实验2-1
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
你观察到了什么?
钠为固体保存在煤油中,用小刀可以切开,表面有银白色金属光泽。
钠的单质
一、钠的物理性质:
银白色有金属光泽的固体,硬度较小
思考:在上面的实验中,我们也观察到,金属钠是保存在煤油中的,为什么金属钠可以且需要保存在煤油中呢?
钠与氧气快速反应,
钠与煤油不反应,密度大于煤油。
思考:现在我们再回来观察一下刚才切开的金属钠,同学们又观察到了什么现象呢?
金属钠光亮的表面变暗了
空气对金属钠产生了作用
钠与空气中的氧气发生了反应
新切开的金属钠光亮的表面很快变暗了,是因为钠与氧气发生了反应,在钠的表面形成了一薄层氧化物,这种氧化物是白色的氧化钠。
钠的单质
二、钠的化学性质:
1. 与氧气的反应:4Na + O2 2Na2O
金属钠通常保存在石蜡油或煤油中,以隔绝空气。
上面的反应是金属钠在常温下与氧气的反应,如果加热,金属钠又会发生什么变化呢?
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
实验2-2
你观察到了什么?
钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体。
由于表面张力的问题,熔化的钠呈现球形,类似液态汞。得到的淡黄色固体是过氧化钠(Na2O2)。
2Na + O2 Na2O2
钠的单质
二、钠的化学性质:
1. 与氧气的反应:4Na + O2 2Na2O
金属钠通常保存在石蜡油或煤油中,以隔绝空气。
钠可以与很多非金属单质反应
加热钠,伸入盛有氯气的集气瓶中
在研钵中加入金属钠和硫粉,用力研磨
思考与交流:请同学们互相讨论,从物质组成和氧化还原的角度分析预测一下,钠与水反应的产物,并说明理由。
钠在反应中一定失电子转化为钠离子,由于水中氧元素呈现的-2价是其最低价,所以只能是+1价的氢得电子化合价降低,所以生成物应该有氢气。
另外的生成物一定有钠元素和氧元素,因为氧化钠会与水反应,所以只能认为是氢氧化钠。
即钠与水反应的产物应该是氢气和氢氧化钠。
通过实验验证同学们的推断
向水槽中加入一定量的水,滴加几滴酚酞,投入一块绿豆大的钠,待实验完后,观察实验现象。
仔细观察钠与水的反应现象,填写下表:
{5940675A-B579-460E-94D1-54222C63F5DA}
实验现象
分析结论
钠在水中的位置
钠的形状变化
钠的运动
反应的声音
溶液的颜色变化
反应方程式
离子方程式
浮于水面上
钠的密度小于水
0.971g·cm-3
熔成一个小球
反应放热,钠的熔点低
四处游动
生成气体
发出嘶嘶的响声
反应放热,热的钠使水蒸发
溶液变为红色
生成碱性物质
2Na + 2H2O == 2NaOH + H2↑
2Na + 2H2O == 2Na+ + 2OH- + H2↑
97.8℃
浮
熔
游
响
红
2. 与水的反应:
2Na + 2H2O 2NaOH + H2↑
2Na + O2 Na2O2
钠的单质
二、钠的化学性质:
1. 与氧气的反应:4Na + O2 2Na2O
金属钠通常保存在石蜡油或煤油中,以隔绝空气。
金属间的置换反应为什么不能用“K、Ca、Na”等金属呢?
这些金属过于活泼,加入水溶液中直接与水发生反应,不会置换金属。
钠投入硫酸铜溶液
钠投入氯化铁溶液
练习1:预测钠与浓盐酸反应的现象。
钠与酸反应比与水反应剧烈。钠与水反应,实质上是钠跟水电离出的H+反应;而酸中的H+浓度比水中H+浓度大。
练习2:预测钠投入煤油和水的混合物中的现象。
钠的密度介于水和煤油之间,所以钠在煤油和水的界面处,钠与水反应有气泡产生,固体上下跳动,至钠消失。
钠着火时,应如何灭火?
思考与交流
用干燥的沙土扑灭
1. 钠的物理性质:
2. 钠与氧气反应:
3. 钠与水反应:
4. 钠的保存和取用:
5. 钠的灭火:
银白色有金属光泽金属,密度小、质地软、熔点低。
2Na + 2H2O == 2NaOH + H2↑
现象:浮、熔、游、响、红。
用镊子夹取,剩余钠放回原瓶。
煤油或石蜡油中。
用干沙盖灭。
小结
4Na + O2 == 2Na2O(白色)
2Na + O2 Na2O2(淡黄色)
第1课时 活泼的金属单质—钠
滴水点灯
在酒精灯的灯芯处放置一小块金属钠,用胶头滴管向灯芯处滴加水。
钠的单质
钠单质性质的理论分析:
(1)从物质分类的角度分析:
钠属于金属单质
(2)从氧化还原的角度分析:
钠一定具有还原性
(3)根据初中的金属活动性分析:
钠是很活泼的金属
结论:钠是一种具有较强还原性的金属单质
从原子结构的角度分析钠为什么具有较强的还原性:
Na
钠原子的最外层只有1个电子,容易失去,达到最外层8电子稳定结构,得到可以稳定存在的钠离子。
Na+
失去最外层
1个电子
实验2-1
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
你观察到了什么?
钠为固体保存在煤油中,用小刀可以切开,表面有银白色金属光泽。
钠的单质
一、钠的物理性质:
银白色有金属光泽的固体,硬度较小
思考:在上面的实验中,我们也观察到,金属钠是保存在煤油中的,为什么金属钠可以且需要保存在煤油中呢?
钠与氧气快速反应,
钠与煤油不反应,密度大于煤油。
思考:现在我们再回来观察一下刚才切开的金属钠,同学们又观察到了什么现象呢?
金属钠光亮的表面变暗了
空气对金属钠产生了作用
钠与空气中的氧气发生了反应
新切开的金属钠光亮的表面很快变暗了,是因为钠与氧气发生了反应,在钠的表面形成了一薄层氧化物,这种氧化物是白色的氧化钠。
钠的单质
二、钠的化学性质:
1. 与氧气的反应:4Na + O2 2Na2O
金属钠通常保存在石蜡油或煤油中,以隔绝空气。
上面的反应是金属钠在常温下与氧气的反应,如果加热,金属钠又会发生什么变化呢?
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
实验2-2
你观察到了什么?
钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体。
由于表面张力的问题,熔化的钠呈现球形,类似液态汞。得到的淡黄色固体是过氧化钠(Na2O2)。
2Na + O2 Na2O2
钠的单质
二、钠的化学性质:
1. 与氧气的反应:4Na + O2 2Na2O
金属钠通常保存在石蜡油或煤油中,以隔绝空气。
钠可以与很多非金属单质反应
加热钠,伸入盛有氯气的集气瓶中
在研钵中加入金属钠和硫粉,用力研磨
思考与交流:请同学们互相讨论,从物质组成和氧化还原的角度分析预测一下,钠与水反应的产物,并说明理由。
钠在反应中一定失电子转化为钠离子,由于水中氧元素呈现的-2价是其最低价,所以只能是+1价的氢得电子化合价降低,所以生成物应该有氢气。
另外的生成物一定有钠元素和氧元素,因为氧化钠会与水反应,所以只能认为是氢氧化钠。
即钠与水反应的产物应该是氢气和氢氧化钠。
通过实验验证同学们的推断
向水槽中加入一定量的水,滴加几滴酚酞,投入一块绿豆大的钠,待实验完后,观察实验现象。
仔细观察钠与水的反应现象,填写下表:
{5940675A-B579-460E-94D1-54222C63F5DA}
实验现象
分析结论
钠在水中的位置
钠的形状变化
钠的运动
反应的声音
溶液的颜色变化
反应方程式
离子方程式
浮于水面上
钠的密度小于水
0.971g·cm-3
熔成一个小球
反应放热,钠的熔点低
四处游动
生成气体
发出嘶嘶的响声
反应放热,热的钠使水蒸发
溶液变为红色
生成碱性物质
2Na + 2H2O == 2NaOH + H2↑
2Na + 2H2O == 2Na+ + 2OH- + H2↑
97.8℃
浮
熔
游
响
红
2. 与水的反应:
2Na + 2H2O 2NaOH + H2↑
2Na + O2 Na2O2
钠的单质
二、钠的化学性质:
1. 与氧气的反应:4Na + O2 2Na2O
金属钠通常保存在石蜡油或煤油中,以隔绝空气。
金属间的置换反应为什么不能用“K、Ca、Na”等金属呢?
这些金属过于活泼,加入水溶液中直接与水发生反应,不会置换金属。
钠投入硫酸铜溶液
钠投入氯化铁溶液
练习1:预测钠与浓盐酸反应的现象。
钠与酸反应比与水反应剧烈。钠与水反应,实质上是钠跟水电离出的H+反应;而酸中的H+浓度比水中H+浓度大。
练习2:预测钠投入煤油和水的混合物中的现象。
钠的密度介于水和煤油之间,所以钠在煤油和水的界面处,钠与水反应有气泡产生,固体上下跳动,至钠消失。
钠着火时,应如何灭火?
思考与交流
用干燥的沙土扑灭
1. 钠的物理性质:
2. 钠与氧气反应:
3. 钠与水反应:
4. 钠的保存和取用:
5. 钠的灭火:
银白色有金属光泽金属,密度小、质地软、熔点低。
2Na + 2H2O == 2NaOH + H2↑
现象:浮、熔、游、响、红。
用镊子夹取,剩余钠放回原瓶。
煤油或石蜡油中。
用干沙盖灭。
小结
4Na + O2 == 2Na2O(白色)
2Na + O2 Na2O2(淡黄色)
