1.1 物质的分类及转化 教案
文档属性
| 名称 | 1.1 物质的分类及转化 教案 |  | |
| 格式 | docx | ||
| 文件大小 | 887.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-10 11:49:34 | ||
图片预览

文档简介
109982001117600000人教版(2019) 必修第一册 第一章 物质及其变化
第一节 物质的分类及转化
教学设计
教学目标
1、通过对生活实例的总结,提炼分类的意义和方法,并迁移至物质分类,能对酸、碱、盐、氧化物及它们之间的反应进行描述和符号表征。
2、通过归纳相关物质间的化学反应关系,建立物质转化模型,认识物质的变化规律。
3、通过对Fe(OH)3胶体性质的讨论,能从微观粒子尺度和宏观性质相结合的角度解释相关自然现象。
教学重难点
重点:应用分类法建立各物质的转化关系模型
难点:各类物质间的转化关系
教学过程
一、导入新课
冰箱现在已经成为居家必备电器,那么同学们是否观察过冰箱的储物规律呢?
二、新课讲授
【PPT】展示冰箱储物的图片。
【学生】思考讨论冰箱储物规律
【师】放入冰箱的食物的共同点是需要低温储藏;食物应按“生熟”和“需冷冻还是冷藏”进行分类,放在冰箱内的不同区域。
【提问】对于化学物质,如果按照其所含物质种类的多少,可以怎样分类?对于化合物,我们按照不同的分类标准进行分类,可以产生哪些分类结果?
【学生】思考讨论。
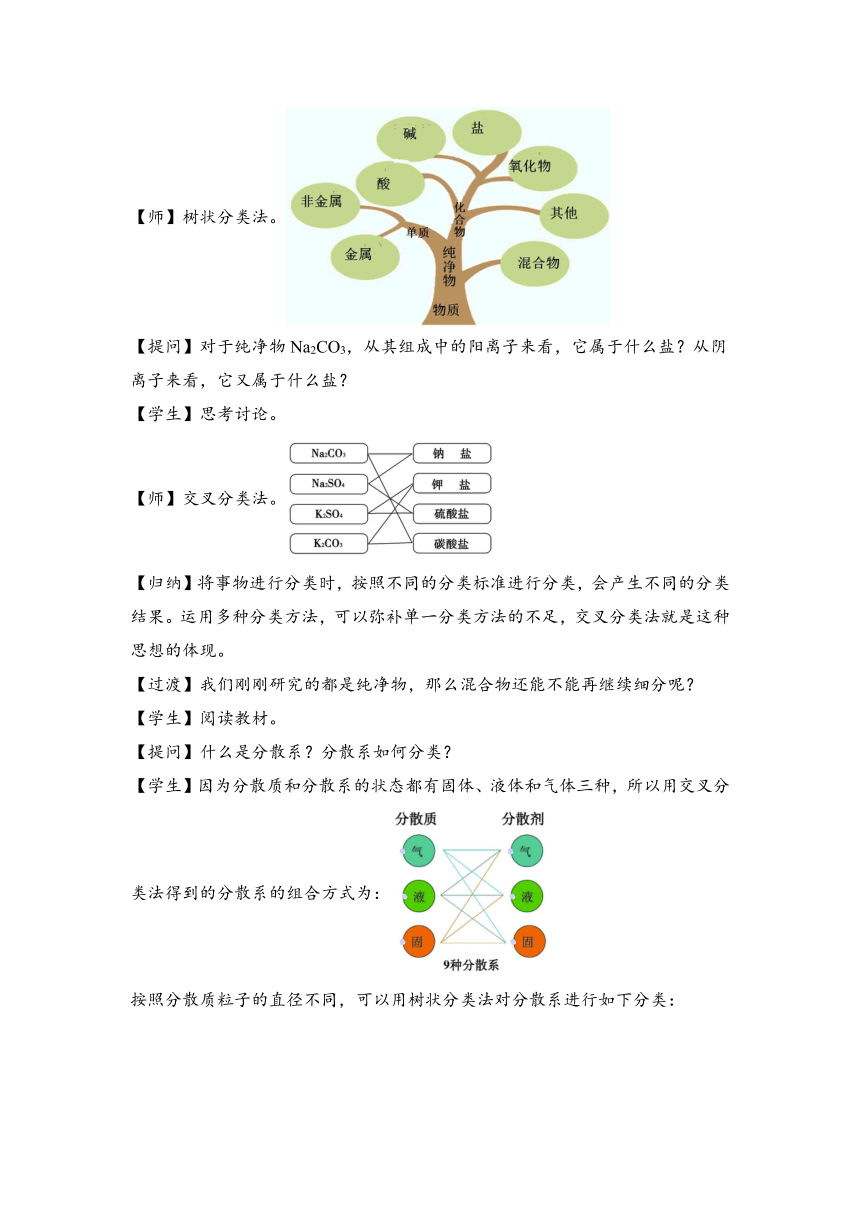
【师】树状分类法。
【提问】对于纯净物Na2CO3,从其组成中的阳离子来看,它属于什么盐?从阴离子来看,它又属于什么盐?
【学生】思考讨论。
【师】交叉分类法。
【归纳】将事物进行分类时,按照不同的分类标准进行分类,会产生不同的分类结果。运用多种分类方法,可以弥补单一分类方法的不足,交叉分类法就是这种思想的体现。
【过渡】我们刚刚研究的都是纯净物,那么混合物还能不能再继续细分呢?
【学生】阅读教材。
【提问】什么是分散系?分散系如何分类?
【学生】因为分散质和分散系的状态都有固体、液体和气体三种,所以用交叉分类法得到的分散系的组合方式为:
按照分散质粒子的直径不同,可以用树状分类法对分散系进行如下分类:
【师】胶体的性质
胶体的性质
内容
应用举例
丁达尔效应
胶体粒子对可见光的散射而产生的,是一种物理现象
鉴别胶体与溶液
介稳性
胶体的稳定性介于溶液和浊液之间,在一定条件下相对稳定
生产涂料、颜料、墨水、洗涤剂等
电泳
胶体粒子在外加电场作用下作定向移动
静电除尘、电泳电镀等
聚沉
胶体粒子聚集成较大的颗粒形成沉淀
明矾净水、制豆腐、制肥皂等
【提问】胶体的稳定性是相对而言的,一旦胶体稳定的环境发生破坏,那么胶体会发生聚沉。要使胶体发生聚沉可以采取哪些措施?
【学生】(1)加入电解质溶液 (2)加入带有相反电荷的胶粒的胶体 (3)加热或搅拌。
【实验】Fe(OH)3胶体的制备:在小烧杯中,加入25 mL蒸馏水,加热至沸腾,向沸水中慢慢滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。即可得到Fe(OH)3胶体。
【实验原理】FeCl3+3H2OFe(OH)3(胶体)+3HCl。
【过渡】不同的物质有不同的性质,我们该如何利用物质的性质解决生活问题呢?
【师】在初中阶段,我们已经初步学习了酸、碱、盐的性质,请同学以盐酸为例,回想盐酸能与哪些物质反应?举例说明。
【学生】盐酸可以与Fe、NaOH、CuO、AgNO3等物质反应。
【师】将能够与盐酸反应的物质进行分类,将其推广为酸的通性,填入表格。
【PPT】酸的通性
酸的主要化学性质
实例(化学反应方程式)
反应类型
与指示剂反应
使紫色石蕊试液变红
酸与活泼金属的反应
置换反应
酸与碱性氧化物的反应
复分解反应
酸与碱的反应
复分解反应
酸与某些盐的反应
复分解反应
【提问】为什么酸具有这些性质?
【学生】不同酸在组成上具有相似的化学性质,取决于不同酸溶液中含有H+。
【师】只要提到这里的任何一种酸,我们没必要在一一研究其性质,我们可以马上回顾酸所有的通性,这就是分类法学习的意义。请同学按照相同的方法,分析总结碱和盐的通性,填入表格。
【学生】学生交流讨论初中学习的碱及盐的化学性质,总结碱和盐的简单通性。
【师】不同碱在组成上具有相似的化学性质,取决于不同碱溶液中含有OH-。
不同碳酸盐在组成上具有相似的化学性质,取决于不同碳酸盐溶液中含有CO32-。
【思考讨论】1.金属单质、氧化物有哪些化学性质?
金属单质的通性:与单质(氧气)反应 ——化合反应;与酸反应——置换反应;与盐反应——置换反应。
氧化物的通性:
【拓展】(1)能溶于水的含氧酸,对应的酸性氧化物一般都能与H2O反应生成相应的含氧酸,如H2SO4:SO3+H2O=H2SO4。
(2)能溶于水的碱(NH3?H2O除外),对应的碱性氧化物一般都能与H2O反应生成相应的碱,如NaOH:Na2O+H2O=2NaOH。
(3)有盐和水生成的反应不一定是中和反应,如酸性氧化物与碱性氧化物、碱性氧化物与酸反应均有盐和水生成,但不是中和反应。
【思考讨论】2.写出下列物质之间转化的方程式,体会由金属单质到盐、非金属单质到盐的转化关系。
2Ca+O2=2CaO 、CaO+H2O=Ca(OH)2、Ca(OH)2+H2SO4=CaSO4+H2O
C+O2CO2、CO2+H2O=H2CO3、H2CO3+NaOH=Na2CO3+2H2O
【拓展】
(1)S燃烧不能直接生成SO3而是生成SO2。
(2)Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3
(3)NH3催化氧化不能直接生成NO2。
(4)Fe与Cl2反应不能生成FeCl2。
(5)Fe与H+、Cu2+、S、I2反应不能生成Fe3+。
板书
物质的分类及转化
1、根据物质的组成和性质分类
2、分散系及其分类
3、物质的转化
第一节 物质的分类及转化
教学设计
教学目标
1、通过对生活实例的总结,提炼分类的意义和方法,并迁移至物质分类,能对酸、碱、盐、氧化物及它们之间的反应进行描述和符号表征。
2、通过归纳相关物质间的化学反应关系,建立物质转化模型,认识物质的变化规律。
3、通过对Fe(OH)3胶体性质的讨论,能从微观粒子尺度和宏观性质相结合的角度解释相关自然现象。
教学重难点
重点:应用分类法建立各物质的转化关系模型
难点:各类物质间的转化关系
教学过程
一、导入新课
冰箱现在已经成为居家必备电器,那么同学们是否观察过冰箱的储物规律呢?
二、新课讲授
【PPT】展示冰箱储物的图片。
【学生】思考讨论冰箱储物规律
【师】放入冰箱的食物的共同点是需要低温储藏;食物应按“生熟”和“需冷冻还是冷藏”进行分类,放在冰箱内的不同区域。
【提问】对于化学物质,如果按照其所含物质种类的多少,可以怎样分类?对于化合物,我们按照不同的分类标准进行分类,可以产生哪些分类结果?
【学生】思考讨论。
【师】树状分类法。
【提问】对于纯净物Na2CO3,从其组成中的阳离子来看,它属于什么盐?从阴离子来看,它又属于什么盐?
【学生】思考讨论。
【师】交叉分类法。
【归纳】将事物进行分类时,按照不同的分类标准进行分类,会产生不同的分类结果。运用多种分类方法,可以弥补单一分类方法的不足,交叉分类法就是这种思想的体现。
【过渡】我们刚刚研究的都是纯净物,那么混合物还能不能再继续细分呢?
【学生】阅读教材。
【提问】什么是分散系?分散系如何分类?
【学生】因为分散质和分散系的状态都有固体、液体和气体三种,所以用交叉分类法得到的分散系的组合方式为:
按照分散质粒子的直径不同,可以用树状分类法对分散系进行如下分类:
【师】胶体的性质
胶体的性质
内容
应用举例
丁达尔效应
胶体粒子对可见光的散射而产生的,是一种物理现象
鉴别胶体与溶液
介稳性
胶体的稳定性介于溶液和浊液之间,在一定条件下相对稳定
生产涂料、颜料、墨水、洗涤剂等
电泳
胶体粒子在外加电场作用下作定向移动
静电除尘、电泳电镀等
聚沉
胶体粒子聚集成较大的颗粒形成沉淀
明矾净水、制豆腐、制肥皂等
【提问】胶体的稳定性是相对而言的,一旦胶体稳定的环境发生破坏,那么胶体会发生聚沉。要使胶体发生聚沉可以采取哪些措施?
【学生】(1)加入电解质溶液 (2)加入带有相反电荷的胶粒的胶体 (3)加热或搅拌。
【实验】Fe(OH)3胶体的制备:在小烧杯中,加入25 mL蒸馏水,加热至沸腾,向沸水中慢慢滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。即可得到Fe(OH)3胶体。
【实验原理】FeCl3+3H2OFe(OH)3(胶体)+3HCl。
【过渡】不同的物质有不同的性质,我们该如何利用物质的性质解决生活问题呢?
【师】在初中阶段,我们已经初步学习了酸、碱、盐的性质,请同学以盐酸为例,回想盐酸能与哪些物质反应?举例说明。
【学生】盐酸可以与Fe、NaOH、CuO、AgNO3等物质反应。
【师】将能够与盐酸反应的物质进行分类,将其推广为酸的通性,填入表格。
【PPT】酸的通性
酸的主要化学性质
实例(化学反应方程式)
反应类型
与指示剂反应
使紫色石蕊试液变红
酸与活泼金属的反应
置换反应
酸与碱性氧化物的反应
复分解反应
酸与碱的反应
复分解反应
酸与某些盐的反应
复分解反应
【提问】为什么酸具有这些性质?
【学生】不同酸在组成上具有相似的化学性质,取决于不同酸溶液中含有H+。
【师】只要提到这里的任何一种酸,我们没必要在一一研究其性质,我们可以马上回顾酸所有的通性,这就是分类法学习的意义。请同学按照相同的方法,分析总结碱和盐的通性,填入表格。
【学生】学生交流讨论初中学习的碱及盐的化学性质,总结碱和盐的简单通性。
【师】不同碱在组成上具有相似的化学性质,取决于不同碱溶液中含有OH-。
不同碳酸盐在组成上具有相似的化学性质,取决于不同碳酸盐溶液中含有CO32-。
【思考讨论】1.金属单质、氧化物有哪些化学性质?
金属单质的通性:与单质(氧气)反应 ——化合反应;与酸反应——置换反应;与盐反应——置换反应。
氧化物的通性:
【拓展】(1)能溶于水的含氧酸,对应的酸性氧化物一般都能与H2O反应生成相应的含氧酸,如H2SO4:SO3+H2O=H2SO4。
(2)能溶于水的碱(NH3?H2O除外),对应的碱性氧化物一般都能与H2O反应生成相应的碱,如NaOH:Na2O+H2O=2NaOH。
(3)有盐和水生成的反应不一定是中和反应,如酸性氧化物与碱性氧化物、碱性氧化物与酸反应均有盐和水生成,但不是中和反应。
【思考讨论】2.写出下列物质之间转化的方程式,体会由金属单质到盐、非金属单质到盐的转化关系。
2Ca+O2=2CaO 、CaO+H2O=Ca(OH)2、Ca(OH)2+H2SO4=CaSO4+H2O
C+O2CO2、CO2+H2O=H2CO3、H2CO3+NaOH=Na2CO3+2H2O
【拓展】
(1)S燃烧不能直接生成SO3而是生成SO2。
(2)Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3
(3)NH3催化氧化不能直接生成NO2。
(4)Fe与Cl2反应不能生成FeCl2。
(5)Fe与H+、Cu2+、S、I2反应不能生成Fe3+。
板书
物质的分类及转化
1、根据物质的组成和性质分类
2、分散系及其分类
3、物质的转化
